Прионные болезни человека: Прионы — Википедия – Прионные инфекции — способы диагностики, лечения и профилактики
Паразиты мозга: ученые нашли новые подтверждения опасности прионов
2019-01-17T08:00+0300
2019-01-17T11:22+0300
https://ria.ru/20190117/1549448358.html
Паразиты мозга: ученые нашли новые подтверждения опасности прионов
https://cdn24.img.ria.ru/images/153246/52/1532465216_0:0:1037:583_1036x0_80_0_0_40d874f724e99b50cc554db469525f34.jpg
РИА Новости
https://cdn22.img.ria.ru/i/export/ria/logo.png
РИА Новости
https://cdn22.img.ria.ru/i/export/ria/logo.png
МОСКВА, 17 янв — РИА Новости, Татьяна Пичугина. Большинство случаев коровьего бешенства у людей выявлено в Великобритании. Часть британцев, полагают ученые, генетически предрасположена к этой болезни. Считается, что ее вызывают прионы — белки с нарушенной структурой, действующие подобно инфекции. Несмотря на серьезные исследования, природа прионов до сих пор остается непонятной.
Европа напугана
В 1995 году в Великобритании у двух подростков диагностировали очень редкую форму губчатой энцефалопатии, или болезни Крейтцфельдта — Якоба. В марте 1996-го зафиксировали уже десять случаев. Пациенты страдали от болей, психических и нейродегенеративных расстройств, вскоре погибали.
Болезнь связали с распространением новой формы коровьего бешенства — инфекционной болезни, поражающей крупный рогатый скот, овец, оленей. Спекуляции, может ли вирус передаваться от домашних животных к людям, ходили давно. Лабораторные эксперименты показали, что существует препятствующий этому межвидовой барьер, однако, судя по вспышке середины 1990-х, этого оказалось недостаточно.
Распространение болезни вызвало широкий общественный резонанс в мире, заговорили о кризисе здравоохранения в Европейском союзе и о провале в знаниях, касающихся причин коровьего бешенства. Начались масштабные исследования, но и спустя тридцать лет ученые не могут четко ответить на ключевой вопрос — каковы риски заразиться прионными болезнями при употреблении мяса выращенных животных.
 23 ноября 2018, 07:09РИА НаукаВ глазах людей нашли смертельно опасные белки-прионы
23 ноября 2018, 07:09РИА НаукаВ глазах людей нашли смертельно опасные белки-прионыУжасные прионы
Белки — основной строительный материал живых организмов. Они синтезируются в клетках, согласно заложенной в ДНК информации. Чтобы выполнять свои функции, молекулы белков определенным образом скручиваются и упаковываются. Нарушение этих процессов отравляет организм и может вызвать заболевания. Класс таких патогенных белков, за синтез которых отвечают ошибки в гене PRNP, называют прионами.
По одной из распространенных гипотез, именно прионы вызывают различные формы губчатой энцефалопатии у животных и людей. Они способны заражать здоровые белки и размножаться, используя своего рода «семена» полимерных цепей. Из-за своей неправильной структуры они слипаются и образуют бляшки в мозге, нарушая работу нейронов. В результате мозг постепенно перестает нормально работать и погибает. Прионные болезни у людей очень редки. На сегодня в мире известен 231 случай, причем 178 из них — среди жителей Великобритании. После пика 2001-2002 годов количество их снижается.У заболевших выявили мутацию в 129-м кодоне 20-й хромосомы, что указывает на генетическую предрасположенность к этой болезни. Есть данные о том, что каждый двухтысячный в популяции Великобритании имеет эту мутацию. Ученые полагают, что у этих людей болезнь может внезапно возникнуть через семь-десять лет инкубационного периода. Или ее носители могут никогда не заболеть, но заразить других через донорство крови и органов, например сетчатки глаза. Этот путь распространения болезни сейчас активно изучают.
Старение и неправильные белки
За последние годы открыты новые формы прионных болезней у животных и людей. Например, их выявили у верблюдов и кошек, доказали, что можно заразить ими мартышек.
В 1992 году выяснили прионную природу очень редкого наследственного заболевания — фатальной семейной бессонницы. Болезнь проявляется у взрослых, человек теряет сон, видит галлюцинации, а затем погибает. Причина — также в мутации в гене PRNP, превращающей нормальный белок в прион.
Ученые выяснили, что белок, за который отвечает ген PRNP, имеет несколько форм, лишь одна из которых токсична. Опыты на мышах показали, что нормальные прионы появляются уже в мозге эмбриона и сопровождают его в процессе развития. У взрослых особей они есть в сердечных и скелетных мышцах, в иммунных клетках.
Хорошие прионы играют роль в сродстве клеток, передаче сигналов через клеточные мембраны, в метаболизме ионов меди, возможно, служат нейропротекторами.
Белки неправильной структуры (бета-амилоиды) сопровождают возрастные неизлечимые нарушения, в том числе болезни Альцгеймера, Паркинсона, Гентингтона, деменцию. В последнее время ученые стали всерьез рассматривать гипотезу о том, что бета-амилоиды так же накапливаются и распространяются в организме, как и патогенные прионы.
Несмотря на активные поиски, до сих пор неизвестно, зачем в организме возникают прионы и бета-амилоиды, служат они причиной нарушений работы мозга или наоборот. Связанные с ними заболевания по-прежнему неизлечимы.
 13 января 2017, 13:06РИА НаукаУченые нашли белок «коровьего бешенства» внутри бактерийБиологи нашли в микробах следы так называемых прионов – неправильно свернутых белков, считающихся сегодня причиной развития «коровьего бешенства» и болезни Альцгеймера.
13 января 2017, 13:06РИА НаукаУченые нашли белок «коровьего бешенства» внутри бактерийБиологи нашли в микробах следы так называемых прионов – неправильно свернутых белков, считающихся сегодня причиной развития «коровьего бешенства» и болезни Альцгеймера.Что такое прионные болезни? Диагностика и лечение
Самый «молодой» инфекционный агент был открыт около 30 лет назад. Он вызывает медленно протекающие заболевания, которые заканчиваются смертью. Сейчас врачи и ученые нашли пути профилактики прионных болезней, но лечение так и не разработано. Поэтому до сих пор они окружены тайнами. В этой статье подробно расскажем о том, что такое прионы.
«Новые» инфекции
Во второй половине прошлого столетия наука вирусология была в фазе «расцвета». Открыты такие вирусные заболевания как СПИД. Появились первые представления о прионных заболеваниях. И была раскрыта тайна медленных вирусных инфекций. Этот вид заболеваний схож по патогенезу и клинике с прионами. Расскажем о них ниже.
Медленные инфекции (МИ)
История этих вирусов началась в 60-е годы. Ученый Сиггурдсон изучал заболевание, которое поражало овец на острове Исландия. Характерные черты недуга – длительный инкубационный период (более года), разнообразие клинических проявлений, симптомы поражения ЦНС и неминуемая смерть. Позже был выделен вирус Висны – типичной медленной инфекции овец.
Но человек тоже может быть подвержен МИ. Оказалось, что вирус кори, который вызывает острую инфекцию, может стать причиной поражений организма с другой клиникой. Тяжелая смертельная болезнь детей и подростков подострый склерозирующий панэнцефалит также является следствием коревой инфицированности. Но заболевание может длится годами. Его симптомы охватывают весь организм и приводят к смерти.
Важно! Врожденная краснуха также протекает в организме плода как МИ.
Стенли Прузинер
Этот ученый известен тем, что в 1997 году стал обладателем Нобелевской премии по физиологии и медицине за открытие прионов и объяснение патогенеза этих заболеваний. Итак, впервые Прузинер столкнулся с пациентом, страдающим БКЯ в 1970-х годах. Тогда он был ординатором-неврологом. Все его попытки выделить инфекционный агент у зараженного не увенчались успехом.
Тогда он услышал, про труды исландского ученого Сиггурдсона. Патогенез вируса Висны у овец был похож на БКЯ. Инкубационный период длился годами (около 100-200 суток), болезнь поражала ЦНС и приводила к неминуемой гибели. Похожая картина наблюдалась при скрейпи овец («почесухе»).
Прузинер решил выделить инфекционный агент. Он брал биологический материал от инфицированных животных и вводил его лабораторным мышам. Несмотря на то что симптомы появились у всей группы, инкубационный период составил 100-200 суток. Это слишком много для лабораторной модели. Тогда подобный эксперимент был проведен на хомяках. И первые симптомы болезни появились гораздо раньше.
Прузинер сделал вывод, что инфекционным агентом является не вирус. Болезнь вызывает одиночный белок, который ведет себя как контагиозная частица. Попадая в организм, он превращает поверхностные протеины в себе подобные. Накопление патологического белка в тканях ведет к их гибели и нарушению функций.
Интересно! Для 1982 года доводы Прузинера оказались слишком прогрессивными. Он столкнулся с недоверием в научной среде. И только через 15 лет сообщество ученых оценило его заслуги.
Пути и способы заражения
Прионные заболевания приводят к смерти. И главная задача медицины – не допустить их распространения. Какие пути передачи прионной инфекции существуют?
- Прямое заражение;
- Наследственная или спорадическая передача;
- Комбинация этих двух путей.
Первый классический вариант – это поедание зараженной пищи, введение частиц в организм через препараты или с нестерильными медицинскими инструментами. Именно так передается болезнь Куру, заболевание Крейцфельдта-Якоба, скейпи. Прионы являются довольно устойчивыми агентами. Для их инактивации недостаточно обычных методов стерилизации.
Много прионных частиц в почве. Доказан даже аэрозольный путь передачи прионов. В 80-х годах после вспышки коровьего бешенства кости больного скота пустили на муку. Ее добавляли в корм животным. В результате в 2009 году эпидемия коровьего бешенства охватила Европу. Она унесла жизни более 200 человек и 179 тысяч голов крупного рогатого скота.
Спорадическая передача возможна при мутации отдельной клетки с образованием в ней патологического прионного белка. Или изменение формы здорового протеина головного мозга на аномальный в результате посттрансляционной модификации. Этот путь изучен менее всего.
Генетическая форма передачи характерна для фатальной семейной бессонницы. В норме на мембране клеток имеется белок PrP. Ген, ответственный за его выработку, расположен в 20 хромосоме. В результате поломки (аспарагин заменяется на аспарагиновую кислоту) ген синтезирует не Prp, а другой протеин-прион PrPSc.
Под воздействие патологического белка другие молекулы PrP переходят в измененную форму. Прекращается функционирование ткани, работа органа. Кстати, такая мутация передается по наследству доминантным путем.
Эпидемиология
Распространенность прионных инфекций может носить тотальный характер. Ученые выявили длительное сохранение агентов в почве, возможность передачи по воздуху. Однако, вспышки прионных болезней не так часто возникают. Опишем регионы, где за последние 200-300 лет регистрировали эту медленную инфекцию.
Скейпи или почесуха овец. Впервые случаи заболевания были описаны в 1732 году. Основные очаги в Европе, Южной Африке, Индии, США и Канаде. Ученые отмечают, что болезнь распространена на всех континентах, кроме Австралии (и Новой Зеландии).
Тот же прион отвечает за развитие губчатой энцефалопатии скота, болезни Крейцфельдта-Якоба у людей. Это заболевание повсеместно распространено в Европе. Вспышка коровьего бешенства охватила в 2009 году все страны Евросоюза. Случаи фиксировались в Бельгии, Франции, Великобритании, Португалии. Даже Швейцария и Кипр получили заражение на своей территории.
В России единственный центр, который занимается диагностикой БКЯ, расположен в городе Владимир. Пробы готовятся около 10 дней. По данным центра гигиены на территории России коровье бешенство не регистрировалось. Однако, в соседних странах – Украине, Польше и Беларуси отмечались эпидемиологические всплески этой болезни.
Интересно! Стоит понимать, что проблема БКЯ не только санитарная, но и политическая, и экономическая. Истинная информация о распространении прионов на территории России может утаиваться.
В стране регулярно регистрируются случаи быстропрогрессирующей деменции. Клиническая картина у таких пациентов нарастает в течение месяца. После этого они теряют возможность нормально мыслить и обслуживать себя. Однако, официального подтверждения диагноза родственники не смогли добиться. Поэтому в России официально не зарегистрировано ни одного случая БКЯ.
Фатальная инсомния регистрируется в Европе, США, Японии, Африке. Случаи семейные, они проявляются у родственников. Во всем мире регистрируется около 40 фамилий с этим заболеванием.
Патогенез
Белок Prp располагается на мембране клеток. При генетической трансформации на смену ему приходит протеин PrPSc. Этот протеин и является прионом. Он меняется свою конформационную структуру. В норме он представляет собой три альфа-спирали и двухцепочечного антипараллельного бета-листа. Такой белок компактно расположен на мембране клетки и выполняет некоторые функции. Точная структура прионного белка неизвестна.
Но ученые предполагают, что в ней преобладают бета-формы. Таким образом, теряется компактное строение протеина. При контакте с другим подобным белком он превращает его в свою копию. А потом они объединяются, образуя амилоидные бляшки. Этот «мусор» накапливается, затрудняя работу нейронов и приводя их к гибели.
Прионы (белки)
Впервые о прионных болезнях заговорили в 80-х годах 20-го столетия. У ученых появился интерес к таким «старым» болезням, как скейпи. А связано это с тем, что в Новой Гвинее племя аборигенов поразила неизвестная инфекция.
Изучать ее отправился доктор Карлтон Гайдушек, который определил поразительные сходства мозга погибших пациентов и образцов овец, умерших от губчатой энцефалопатии. Тогда же он предположил, что речь идет о новой инфекционной патологии. А также он доказал возможность передачи инфекции (через поедание мозга пораженного пациента).
Строение
Однако, история со скейпи у овец и заболеванием Куру у аборигенов оставила больше вопросов, чем дала ответов. И в США Стенли Прузинер решил разгадать тайну инфекционной частицы. Ведь до этого возбудителя так и не выделили.
После десятилетия экспериментов выяснилось, что болезнь вызывал белок. Не бактерия, вирус или фаг, которые имеют ДНК или РНК. Просто белковая молекула, набор аминокислот с чрезвычайной токсичностью и поразительной устойчивостью. Что же он собой представляет?
По современным представлениям, считается, что нормальный белок-предшедственник приона расположен на мембранах клеток любого живого существа. Он носит название PrP
Если оригинал состоял из 253 аминокислот и «весил» около 33 кДа, то патологическая молекула меняет только пространственную структуру протеина. Ранее в ней были две альфа-цепи и один бета-слой. А теперь бета слои преобладают, благодаря чему молекула теряет свою компактность.
«Новые» молекулы особым образом взаимодействуют с белками, превращая их в себе подобные. Конец каждого приона – это участок для «сцепки». К нему крепится новый патологический отрезок, благодаря чему молекулы разрастаются. Они превращаются в амилоидные волокна, бляшки, микротельца. Тем самым формируется межклеточный «мусор», нарушающий работу здоровых нейронов.
Характеристика и свойства прионов
Уже в 80-х годах ученые обратили внимание на необычные свойства возбудителя болезней. Они не росли на питательных средах, как вирусы и бактерии. Инфекционные агенты были устойчивы к нагреванию, обработке формальдегидом и другими известными дезинфектантами. На них не влияло облучение и воздействие ферментов (гидролаз, нуклеаз).
Уничтожить прионы может хлорная известь, гидроксид натрия и сильнокислые моющие вещества. Эффективно сжигание пораженных тканей при температуре 1000 градусов Цельсия.
Сравнительная характеристика классических вирусов и прионов
| Свойства | Вирусы | Прионы |
| Наличие ДНК или РНК | Есть | Отсутствует |
| Устойчивость во внешней среде, физическим и химическим факторам | Зависит от конкретной вирусной частицы, многие агенты быстро инактивируются в окружающей среде, реагируют на стандартные методы дезинфекции и стерилизации | Проявляют чрезвычайную устойчивость как во внешней среде, так и к воздействию УФ и ионизирующего облучения, нагреванию, действию ферментов, антисептиков |
| Реакция организма | Выработка антивирусных антител, иммунный и воспалительный ответ организма | Не вызывает ни воспалительного, ни иммунного ответа, что затрудняет идентификацию и борьбу с ними |
| Электронная микроскопия | Хорошо видны | Не распознаваемы |
Какими признаками живой материи обладают прионы?
Белки-прионы обладают всеми свойствами живых организмов и способны к эволюции. Это доказали исследования начала 2000-х годов.
- Протеин PrP имеет несколько вариантов «неправильной трансформации» в PrPsc. Каждый из этих вариантов наследуется;
- При заражении новых поколений один и тем же прионом, сокращается инкубационный период болезни у новых линий. Протеин адаптируется к организму и ведет себя более агрессивно;
- При помещении прионов в неблагоприятную среду (добавляли вещество ингибитор SWA), прион постепенно «привыкает» и адаптируется к нему.
Значение прионов и вироидов в патологии человека
Вироиды представляют собой цепь вирусной РНК без окружения белковой оболочки. В отличие от классических агентов, их не удается идентифицировать серологическими методами диагностики. Ведь для этого обследования необходим протеин на оболочке частицы. Вироиды не инфицируют людей, являясь источником болезней у растений. Однако, возможно их эволюционирование и преодоление видового барьера.
Прионы изучены мало. Но уже известно около десятка патологий, которые вызывают эти инфекционные агенты. Это болезнь Крейцфельдта-Якоба, фатальная семейная бессонница, синдром Альперса, Гейстманна-Штрейстлера, Куру. О симптомах прионных недугов расскажем ниже.
Заболевания
Типичные проявления прионов характеризуются поражением мозга. У человека заболевание протекает как нейродегенерация, которая имеет быстрые темпы развития. Изначально появляются фобии, тревожность, бессонница, расстройства памяти.
Через несколько недель прогрессирует слабость, невозможность ходить, выполнять профессиональные и бытовые обязанности. А через несколько месяцев человек впадает в бессознательное состояние, когда жизнь поддерживается в нем только благодаря чужим усилиям.
Губчатая энцефалопатия
Развивается у крупного рогатого скота и носит название «коровьего бешенства». Связано это с тем, что коровы ведут себя нетипично. Они становятся пугливыми, боятся узких пространств, плохо принимают корм, агрессивны с человеком и другими особями. Отсутствуют классические симптомы бешенства – водобоязнь и слюнотечение. На поздних стадиях животное не может встать на ноги и погибает.
Важно! «Коровье бешенство» передается через корм, а также может наследоваться.
Болезнь Крейтцфельдта-Якоба
Заболевание коров вызывает схожие симптомы и у человека. Ранее считалось, что БКЯ возникает спонтанно из-за мутации или является наследуемой формой. Но в начале 21 века ученые предположили заражение болезнью через пищу.
«Старая» форма БКЯ характеризовалась длительным инкубационным периодом и поздним возрастом проявления. «Новые» случаи поражали молодых трудоспособных людей, у которых не отмечалось признаков других патологий.
Симптомы БКЯ
Нk
Прионные болезни: причины, симптомы, диагностика, лечение
Как диагностируются прионные болезни?
Диагностика прионных болезней не разработана.
ЭЭГ. Установлено, что у 60-80% больных болезнью Крейтцфельда-Якоба выявляют 0,5-2,0 Гц генерализованные двух-трёхфазные комплексы, повторяющиеся с частотой 1 раз в секунду (сходные характеристики ЭЭГ бывают и при других патологиях головного мозга). Однако негативный результат ЭЭГ не может служить основанием для отмены диагноза болезни Крейтцфельда-Якоба.
МРТ имеет невысокую диагностическую значимость, так как у 80% обследованных регистрируют неспецифические сигналы. Тем не менее МРТ позволяет выявить атрофию мозга, выраженность которой усугубляется по мере прогрессии заболевания.
Исследование ликвора. Возможно проведение теста на наличие нейроспецифического белка 14-3-3. Данное исследование методом ИФА или вестерн-блоттинга демонстрирует хорошую чувствительность и специфичность при спорадических случаях болезни Крейтцфельда-Якоба как на ранних, так и на поздних стадиях заболевания. При семейных формах и ятрогенной болезни Крейтцфельда-Якоба этот метод менее информативен (специфичность около 50%).
Исследование крови. Возможна идентификация прионов методом иммуно-блоттинга в периферических лимфоцитах.
Молекулярно-генетические исследования. В настоящее время разработаны методы иммуноблоттинга с применением моноклональных антител (МКА-15ВЗ), позволяющих распознавать PrPSc и РrРс.
Применяют методы ПЦР, позволяющие проводить секвенирование генома человека и анализ локализации мутаций гена PRNP.
Исследование аутопсийного материала. Выявляют Status spongiosis (формы вакуолизации нервной ткани), признаки церебрального амилоидоза, образование характерных амилоидных бляшек.
Биологические методы диагностики. Трансгенные мыши, несущие ген. кодирующий нормальный РrР человека, рекомендованы ВОЗ для тестирования инфекционной активности материалов, подозрительных на контаминацию прионами.
Дифференциальная диагностика прионных болезней
Дифференциальная диагностика прионных болезней, в том числе и болезни Крейтцфельда-Якоба проводится со всеми болезнями, одним из проявлений которых бывает деменция: болезнью Альцгеймера, васкулитами, нейросифилисом. стрептококковым менингитом, герпетическим энцефалитом, миоклонус-эпилепсией, болезнью Паркинсона и т.д.
 [20], [21], [22], [23], [24], [25], [26]
[20], [21], [22], [23], [24], [25], [26]
болезни и лечение – ответы на главные вопросы
Структура и воспроизведение прионов
Разобраться в структуре и механизмах репликации прионов млекопитающих, по крайней мере на молекулярном уровне, крайне сложно. Сначала нужно объяснить, как неправильно свернутые белки могут распространяться в роли патогенов, не перенося своего собственного нуклеинового генома. Затем следует также объяснить, как белки с единой последовательностью аминокислот, такие как PrP того или иного животного-хозяина, могут образовывать разные штаммы прионов, которые исправно распространяются и вызывают различные фенотипы болезни без генетических мутаций, объясняющих вариации штаммов в обычных патогенах.
Множество исследований указывает на то, что прионы млекопитающих — это упорядоченные скопления нескольких молекул PrP, плотно упакованных и часто фибриллярных или нитевидных. Молекулы PrP (мономеры) в прионах по сравнению с нормальными свободными молекулами PrP пересвернуты практически полностью. Когда правильные молекулы PrP включаются в растущие прионные агрегаты, эти агрегаты вызывают их рефолдинг, причем прионы действуют как штамм-специфические шаблоны или затравки, которые каким-то образом придают свои собственные аберрантные формы каждой входящей молекуле, контролируя стабильную репликацию своего штамма.
За рамками этого грубого описания детали структуры и распространения прионов на молекулярном уровне остаются неясными. Также нерешенным остается вопрос о том, как прионы распространяются за пределы исходного места заражения в организме-хозяине. Существующие данные свидетельствуют о том, что наиболее эффективная межклеточная передача прионов связана с мембранозными структурами, такими как экзосомы или туннелирующие нанотрубки, — скорее всего, потому, что прионы обычно связаны с мембранами липидными якорями; однако возможность этих мембранных структур способствовать распространению прионов in vivo еще предстоит определить. Очень важно понять механизмы распространения прионов, поскольку способности различных неправильно свернутых белковых агрегатов распространяться внутри и между клетками, тканями и индивидами определяют то, действуют ли они как инфекционные патогены или являются относительно безобидными сбоями белкового метаболизма.
Прионные болезни
Многие виды млекопитающих, включая людей, низших приматов, крупный рогатый скот, овец, коз, оленей, лосей, кошек, норок, грызунов и различных экзотических копытных, восприимчивы к прионным заболеваниям PrP. Но такими являются не все виды: собаки и лошади, судя по всему, представляют собой заметные исключения. Разные виды обычно экспрессируют несколько разные нормальные молекулы PrP, и различия в аминокислотной последовательности PrP могут сильно влиять на восприимчивость хозяина к входящим прионным инфекциям. Например, люди, как известно, до некоторой степени восприимчивы к губчатой энцефалопатии крупного рогатого скота (ГЭКРС), но, по-видимому, устойчивы к скрейпи овец и, насколько нам известно, хронической изнуряющей болезни оленей. По какой-то причине лесные полевки и беличьи обезьяны необычайно восприимчивы к широкому спектру прионных инфекций других видов.
Механизмы, с помощью которых прионные инфекции вызывают нейродегенеративные заболевания, нам пока неизвестны. Агрегаты различных прионных штаммов в организмах-хозяевах разных видов могут накапливаться преимущественно в разных областях центральной нервной системы и вызывают ряд невропатологических расстройств. Очевидно, что конечным эффектом по крайней мере частичного повреждения является сбой в работе нейронов и их потеря, что вызывает множество клинических симптомов и приводит к летальному исходу. Известно, что ряд нейрофизиологических процессов и путей нарушается, но многое еще предстоит определить относительно того, связаны ли такие нарушения с прямой или косвенной токсичностью прионов и в какой степени та или иная недостаточность или комбинация недостаточностей наиболее ответственна за кончину больного.
Прионная болезнь — это… Что такое Прионная болезнь?
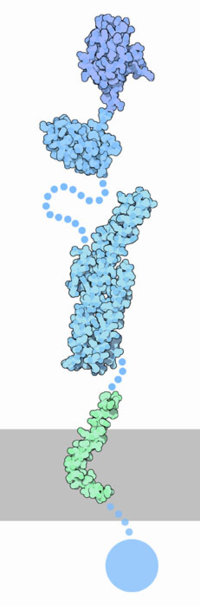
Белок, образующий β-амилоиды — предшественник прионов
- Не путать с гипотетическими элементарными частицами — преонами
Прио́ны (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»).
Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои.
История
Во второй половине XX века врачи столкнулись с необычным заболеванием человека — постепенно прогрессирующим разрушением головного мозга, происходящим в результате гибели нервных клеток. Это заболевание получило название губчатой энцефалопатии. Похожие симптомы были известны давно, но наблюдались они не у человека, а у животных (скрейпи овец), и долгое время между ними не находили достаточной обоснованной связи.
Новый интерес к их изучению возник в 1996 г., когда в Великобритании появилась новая форма заболевания, обозначаемая как «новый вариант болезни Крейтцфельдта-Якоба (nvCJD)».
Важным событием было распространение «Коровьего бешенства» в Великобритании, эпидемия которого была сначала в 1992—1993 гг, а потом и в 2001 г охватила несколько европейских государств, но тем не менее мясо было экспортировано во многие страны. Заболевание связывают с использованием «прионизированной» костной муки в кормах и премиксах, изготовленной из туш павших или заболевших животных, возможно, и не имевших явных признаков заболевания.
Пути переноса причинного фактора болезни, механизмы проникновения прионов в организм и патогенез заболевания изучены пока недостаточно.
Свойства молекул
Трехмерные структуры С-концевых участков белков PrPC (слева) и PrPSc. Фиолетовым цветом окрашены альфа-спирали, зелёным — бета тяжи.N-концевой участок белка релаксирован и не поддаётся рентгеноструктурному анализу.
Прионовые белки млекопитающих не сходны с прионовыми белками дрожжей по аминокислотной последовательности. Несмотря на это, основные структурные особенности (формирование амилоидных волокон и высокая специфичность, препятствующая передаче прионов от одного вида организмов к другому) у них общие. Вместе с тем, прион, отвечающий за коровье бешенство, обладает способностью передаваться от вида к виду.
Правый рисунок — модель двух конформаций приона; слева известная, нормальная, конформация структуры терминального участка C-terminal PrPC. (для отображения/загрузки см. RCSB Protein Databank).
Молекулярные основы патогенеза

Предполагаемый механизм «размножения» прионов.
В ходе исследований мозговых тканей умерших от прионных инфекций животных было показано, что прионы не содержат нуклеиновых кислот, а представляют собой белки. Одним из первых охарактеризованных прионнных белков стал PrP (от англ. prion-related protein или protease-resistant protein) массой около 35 кДа. Известно, что PrP может существовать в двух конформациях — «здоровой» — PrPC, которую он имеет в нормальных клетках (C — от англ. cellular — «клеточный»), в которой преобладают альфа-спирали, и «патологической» — PrPSc, собственно прионной (Sc— от scrapie), для которой характерно наличие большого количества бета-тяжей. При попадании в здоровую клетку, PrPSc катализирует переход клеточного PrPC в прионную конформацию. Накопление прионного белка сопровождается его агрегацией, образованием высокоупорядоченных фибрил (амилоидов), что в конце концов приводит к гибели клетки. Высвободившийся прион, по-видимому, оказывается способен проникать в соседние клетки, также вызывая их гибель.
Функции белка PrPC в здоровой клетке пока не определены. В норме белок PrPC ассоциирован с клеточной мембраной, гликозилирован остатком сиаловой кислоты. Он совершает циклические переходы внутрь клетки и обратно на поверхность в ходе эндо- и экзоцитоза. Один такой цикл длится около часа. В эндоцитозном пузырьке или на поверхности клетки молекула PrPC может разрезаться протеазами на две примерно равные части.
До конца механизм спонтанного возникновения прионных инфекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе белков. Мутации генов, кодирующих прионный белок (PrP), ошибки трансляции, процессы протеолиза — считаются главными кандидатами на механизм возникновения прионов.
Есть данные, дающее основание считать, что прионы являются не только инфекционными агентами, но и имеют функции в нормальных биопроцессах. Так, например, существует гипотеза, что через прионы осуществляется механизм генетически обусловленного стохастического старения.
Классификация
Этиология
Человек может заразиться прионами, содержащимися в пище, так как они не разрушаются ферментами пищеварительного тракта. Беспрепятственно проникая через стенку тонкого кишечника, они в конечном итоге попадают в центральную нервную систему. Так переносится новый вариант болезни Крейтцфельдта-Якоба (nvCJD), которой люди заражаются после употребления в пищу говядины, содержащей нервную ткань из голов скота, больных бычьей губчатой энцефалопатией (BSE, коровье бешенство).
Прионы могут проникать в тело и парентеральным путем. Были описаны случаи заражения при внутримышечном введении препаратов, изготовленных из человеческих гипофизов (главным образом гормоны роста для лечения карликовости), а также заражение мозга инструментами при нейрохирургических операциях, поскольку прионы устойчивы к применяемым в настоящее время термическим и химическим методам стерилизации. Эта форма болезни Крейтцфельдта-Якоба обозначается как ятрогенная (1CJD).
При определённых, неизвестных условиях, в организме человека может произойти спонтанная трансформация прионового протеина в прион. Так возникает так называемая спорадическая болезнь Крейтцфельдта-Якоба (sCJD), впервые описанная в 1920 г. независимо друг от друга Гансом Герхардом Крейтцфельдтом и Альфонсом Марией Якобом. Предполагается, что спонтанное возникновение этой болезни связано с фактом, что в норме в человеческом теле постоянно возникает небольшое количество прионов, которые эффективно ликвидируются клеточным Аппаратом Гольджи. Нарушение этой способности «самоочищения» клеток может привести к повышению уровня прионов выше допустимой границы нормы и к их дальнейшему неконтролируемому распространению. Причиной возникновения спорадической болезни Крейтцфельдта-Якоба согласно этой теории является нарушение функции Аппарата Гольджи в клетках.
Особую группу прионовых заболеваний представляют собой наследственные (врожденные) болезни, вызванные мутацией гена прионового протеина, который делает возникший прионовый протеин более подверженным спонтанному изменению пространственной конфигурации и превращения их в прионы. К этой группе наследственных заболеваний относится и наследственная форма болезни Крейтцфельдта-Якоба (fCJD), которая наблюдается в ряде стран мира.
При прионовой патологии наивысшая концентрация прионов обнаружена в нервной ткани заражённых людей. Значительное количество прионов встречается в лимфатической ткани. Наличие прионов в биологических жидкостях, включая слюну, пока не было однозначно подтверждено. Если представление о постоянном возникновении небольшого количества прионов верно, то можно предположить, что новые, более чувствительные методы диагностики откроют это количество прионов, разбросанное по различным тканям. В данном случае, однако, речь пойдёт о «физиологическом» уровне прионов, которые не представляют собой никакой угрозы для человека.
Пути заражения
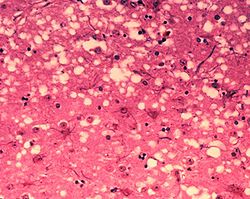
Гистологический препарат, поражение ткани прионами с образованием характерной губчатой структуры.
Очень мало известно о молекулярном характере прионов, вызывающих заболевания. Заражение могут вызвать примерно 100 000 молекул, которые в большинстве случаев образуют большие скопления. Значение агрегации отдельных молекул в ассоциации для вирулентности прионов пока не известна. Нельзя исключить, что вирулентными являются и отдельные молекулы прионов. Из некоторых экспериментов следует, что для возникновения прионов в ткани достаточно лишь временного контакта ткани с материалом, содержащим прионы, и нет необходимости, чтобы прионы были навсегда внесены в организм. Этот риск является актуальным, например, в связи с использованием хирургических инструментов, заражённых прионами. Процесс трансформации «здоровых» прионовых протеинов в прионы может быть инициирован простым контактом здоровых тканей с прионами, зафиксированными на хирургическом инструменте.
Ход болезни и распространение прионов по организму зависит от типа приона. Прионы отличаются составом аминокислот, характерных для данного вида, определяемых видовым геном прионового протеина, а также так называемыми посттрансляционными модификациями или степенью гликозилирования базовой белковой цепочки. Посттрансляционная модификация значительно влияет на характеристики прионов и именно ей приписывают разницу между так называемыми прионовыми родами. В случае нового варианта (nvCJD) был пока что описан лишь один вид приона, сходный с прионами скота, заражённого бычьей губчатой энцефалопатией. Поэтому течение заболевания у человека и животных, заражённых новым вариантам, практически одинаково. У прочих видов живых существ, однако, известно много прионовых родов. У овец были описано примерно два десятка таких родов, которые не вирулентны для человека. Течение овечьего прионового заболевания в зависимости от рода прионов и драматически отличается — от очень быстрого, с практически внезапной гибелью, до медленного, затяжного.
Нетипичные случаи клинического течения нового варианта у скота, заражённого бычьей губчатой энцефалопатией, которые имели место в Японии и Италии, наводят на мысль о существовании большего количества родов бычьих прионов. Если бы этот род бычьих прионов попал в организм человека, следовало бы ожидать возникновение нового варианта с симптомами и клиническим течением, отличными от известных случаев.
У пациентов, больных болезнью Крейтцфельдта-Якоба, прионы распространяются в нервной системе, тканях глаза и лимфатических тканям, включая миндалины, селезенку, а также в слепой кишке. Наибольшее количество прионов находится в нервной системе, а наименьшее — в лимфатической ткани.
Пока что не был зарегистрирован ни один случай переноса нового варианта болезни Крейтцфельдта-Якоба (nvCJD) при медицинском вмешательстве, что является, разумеется, хорошей новостью. С другой стороны, специалисты предупреждают о преувеличенном оптимизме, прежде всего в условиях Великобритании, так как инкубационный период может быть достаточно долгим (от 5-8 месяцев до 10-15 лет).
Прионы и медицинские инструменты
Прионы очень стойки к обычным методам дезинфекции. Ионизирующее, ультрафиолетовое или микроволновое излучение на них практически не действует. Дезинфекционные средства, обычно используемые в медицинской практике, действуют на них лишь в очень ограниченной мере. Надёжно их ликвидируют дезинфицирующие реактивы — сильные окислители, разрушающе действующие на протеины.
Другое затруднение представляет собой стойкость прионов к высоким температурам. Даже при автоклавировании при 134 °C в течение 18 минут невозможно достичь полного разрушения прионов, и прионы «выживают» в форме, способной вызвать заражение. Стойкость к высоким температурам ещё более возрастает, если прионы засохнут на поверхности металла или стекла или если образцы перед автоклавированием были подвергнуты действию формальдегида.
В Великобритании, где новый вариант является очень серьёзной проблемой, по этим причинам уже используются одноразовые хирургические инструменты для тонзиллэктомии. В будущем напрашивается альтернативное решение: создания новых инструментов, с учётом повышенных требований к очистке и обеззараживанию. Одноразовое использование инструментов согласно принципам ВОЗ требуется в случае стоматологического обслуживания пациентов с диагностированным прионным заболеванием или в случае подозрения на него.
Намного более сложным решением этой проблемы является лечение пациентов группы риска. К ним относятся пациенты, которые подверглись операциям, при которых была использована потенциально заражённая твёрдая мозговая оболочка, или пациенты из семей с наследственной формой болезни Крейтцфельдта-Якоба. ВОЗ в этом случае не требует никаких специальных мер. Британский Консультационный научный комитет по губчатой энцефалопатии в своём решении в 1998 г. счёл возможным ограничиться более тщательной очисткой и обеззараживанием инструментов, в сочетании с более длительным автоклавированием.
Прионные заболевания человека
Наиболее известные прионные инфекции, связанные с поражением головного мозга:
Потенциальная опасность для человека
Несмотря на незначительное количество явных случаев прионных заболеваний у людей, многие специалисты считают, что имеется высокая степень опасности «медленных» инфекций для человека.
Имеются данные, что источником распространения могут быть стоматологические процедуры, связанные с попаданием прионов в кровяное русло.
Под подозрение попал также лецитин животного происхождения, что вызвало сокращение применения его в фармакологической промышленности, и вытеснение растительным (в основном, соевым) лецитином.
Исследования прионов дрожжей и др. микромицетов
Прион-подобные белки, поведение которых подобно поведению PrP найдены в природных популяциях микромицетов и дрожжей. Исследования прионов дрожжей подтвердили гипотезу о том, что превращение белков в прионное состояние зависит только от белков. Было показано, что прионы, экстрагированные из клеток, могут служить «семенами» образования прионов в пробирке. Одним из наиболее хорошо изученных белков, склонных к образованию прионов у дрожжей — фактор терминации трансляции (eRF3), который образует так назваемые PSI+ клетки. Такие клетки имеют изменёное физиологическое состояние и изменённый уровень выражения некоторых генов, что позволило выдвинуть гипотезу о том, что у дрожжей образование прионов может играть адаптативную роль [1] .
Критика
Mark Purdy и David R. Brown предположили, что металлоионы, взаимодействуя с протеинами приона могут быть причиной развития прион-индуцированных (prion-mediated) заболеваний.[2]
Purdy провёл кластерное эпидемиологическое исследование при прионных заболеваниях в районах с низкой концентрацией меди в почвах.
Примечания
См. также
Литература
Источники
- ing. Jaroslav Petr, DrSc. Phony a ustni dutina. Progresdent, 2004, № 2, s. 12-16
Ссылки
На английском языке
- Mad Cow Disease Инфорация о коровьем бешенстве, Center for Global Food Issues.
- Madcowering A BSE-TSE blog.
- The Pathological Protein — Mad Cow, Chronic Wasting, and Other Deadly Prion Diseases (2003, updated online 2005). Philip Yam, Scientific American magazine writer and News Editor.
- Прионные заболевания (2003). Dr. Sean Heaphy, Leicester University.
- Prion Diseases and the BSE Crisis (1997). Статья Stanley Prusiner — первооткрывателя прионов, из Science magazine.
- Britannica Nobel: Прион, 1997
- ICTVdb 90.001.0.01. Mammalian Prions
- Официальная страница сайта о болезни коровьего бешенства Mad Cow Disease
- News & Views on Mad Cow Disease, Mad Deer Disease, Chronic Wasting Disease, and Bovine Spongiform Encephalopathy
- Biography of Dr Prusiner
- Science Daily статья о вакцине против прионных заболеваний
- Science Daily article on transmission of prions through soil
- Хороший обзор по прионам из Science Creative Quarterly
На русском языке
Wikimedia Foundation. 2010.
идеальные убийцы и возможный ключ к бессмертию – Москва 24, 17.06.2015
Фото: M24.ru/Евгения Смолянская
За свою историю человечество сталкивалось с огромным количеством войн, эпидемий, стихийных бедствий и других катаклизмов. В XXI веке, когда с эпидемиями, казалось, было покончено, у человечества появился новый вызов – прионы. Что это такое, чем они грозят людям и почему прионами так интересуются ученые всего мира – в материале M24.ru.
Ты помнишь, как все начиналось
В двадцатые годы прошлого столетия врачи столкнулись с новым и неизведанным доселе заболеванием. Немецкий невропатолог Ганс Герхард Крейтцфельдт наблюдал в своей клинике одну пациентку – 20-летнюю девушку. На начальной стадии болезни у нее была нарушена чувствительность в руках и ногах, быстро прогрессировали расстройства памяти, нервной деятельности, больная все чаще впадала в бессознательное состояние. Через несколько месяцев девушка умерла от расстройств дыхания и сердечной деятельности. Невропатолог, который в будущем станет видным нацистским врачом и будет принимать участие в программе «Эвтаназия», задокументировал ход болезни.
Спустя несколько месяцев доктор Альфонс Мария Якоб из Гамбурга столкнулся с тремя аналогичными пациентами. Молодые люди страдали от расстройств нервной деятельности, глотания, практически не осознавали происходящее вокруг и вскоре умерли. При вскрытии Якоб увидел интересное явление, которое раньше врачам наблюдать не приходилось, – поражен у больных был только мозг. Была зафиксирована массовая гибель клеток серого вещества головного мозга, а сохранившиеся нейроны отличались необычным набуханием. Ни в одном другом органе не было зафиксировано никаких патологических изменений. В память о двух первооткрывателях заболевание получило название болезни Крейтцфельдта – Якоба.
Ссылки по теме
В те далекие годы вирусология как наука находилась еще в зачаточной стадии. Поэтому заболеванию было суждено долгое время оставаться в забвении. Этому поспособствовали Великая депрессия и Вторая мировая война. И лишь в пятидесятые годы прошлого века ученые начали активно интересоваться, что же все-таки происходит с людьми, которым не посчастливилось подхватить болезнь Крейтцфельдта – Якоба.
В то же время ученые открывают еще два заболевания, которые по своим симптомам и течению весьма и весьма напоминают описанный выше страшный недуг – куру и скрейпи. Первая болезнь была распространена среди народности форе на острове Папуа – Новая Гвинея, а вторым страдали овцы по всему миру. Но важным оказалось другое: симптомы болезней несколько отличались от болезни Крейтцфельдта – Якоба, но характер поражений был практически идентичен – образование пустот в тканях головного мозга и массовая гибель нервных клеток.
Казалось бы, все ясно. Имеется болезнь, ее вызывает какой-то вирус или бактерия, давайте разберемся, кто является возбудителем и устраним причину. Но не тут-то было! Все оказалось не так просто…
Исследования
Ученым удалось достаточно быстро установить, почему болеют папуасы. Выяснилось, что заболевают только те из них, кто участвовал в ритуальном поедании тел погибших от куру родственников. Согласно местным верованиям того времени, дети должны были обязательно отведать мозга умершего, считалось, что от этого у них прибавится ума. Неизвестно, прибавлялось ли у детей от этого ума, но все малолетние, участвовавшие в таких трапезах, обязательно оказывались зараженными куру.
Особенно масштабные исследования развернулись с агентом скрейпи. Для начала определили его размеры, они оказались стандартными для вирусов – 17–27 нанометров. После этого вирусологи всего мира стали разбираться в свойствах неизвестного возбудителя заболевания, и тут их ждали сюрпризы. Оказалось, что инфекционный агент совершенно невосприимчив к формалину, пепсину и трипсину, не реагирует на ферменты, разрушающие ДНК и РНК, устойчив к кипячению, ультрафиолетовому излучению и… проникающей радиации! С такими вирусами ученым сталкиваться еще не приходилось.
Фото: M24.ru/Александр Авилов
Больше того, возбудителя заболевания никак не удавалось увидеть в электронный микроскоп, что было уж совсем странно. В то время ученые уже умели распознавать вирусные частицы намного мельче, чем 17 нанометров, но вирус скрейпи (почесуха) так никто и не увидел – наблюдали лишь фрагменты клеточных мембран.
Еще одной интересной загадкой оказалось всякое отсутствие иммунного ответа организма больных. Организм людей, больных куру, и овец, страдавших от скрейпи, никак не реагировал на течение заболевания. При обычных болезнях, вроде гриппа и простуды, в организме увеличивается синтез интерферона (отвечает за иммунитет), что ведет к быстрому выпуску антител, которые соединяются с вирусными частицами и растворяют их. Ученые пытались обнаружить признаки хоть каких-либо антител, но потерпели неудачу.
Отчаявшиеся исследователи начали выдвигать гипотезы, что возбудителем является не вирус, а молекула полисахарида или же белка, но подтверждения эта версия так и не нашла. Ученые топтались на месте, пока в 1982 году американский невролог Стэнли Прузинер не заявил об открытии нового класса инфекционных агентов – прионах.
Что такое прион
До открытия прионов считалось, что болезни человека и животных могут вызываться исключительно живыми организмами или хотя бы вирусами, содержащими нуклеиновую кислоту. Однако все оказалось не так просто. Прион – это особый вид белка, который присутствует в любом человеческом организме.
Выяснилось, что либо под воздействием непонятных факторов, либо из-за мутаций в организме некоторых людей нормальный прионный белок, входящий в состав клеточных мембран, заменяется «неправильным». Второй вид прионного белка имеет другую структуру, вызывает гибель клеток, но самое интересное – способен самостоятельно размножаться (без каких-либо ДНК и РНК!) и менять нормальные прионы в соседних клетках на дефектные.
Таким образом, прионы оказались единственным видом инфекционных агентов, которых никак нельзя причислить к живым существам. Ведь, по своей сути, они не содержат никакой генетической информации и самостоятельно синтезируются организмом.
Естественно, исследователей заинтересовал самый главный вопрос – а зачем вообще в человеческом организме нужны прионы? В настоящее время известно уже достаточно много прионных болезней. Все они являются экстремально редкими, самая распространенная – болезнь Крейтцфельдта – Якоба – наблюдается у одного из миллиона человек. Также известно о синдроме Герстманна – Штраусслера – Шайнкера, фатальной семейной бессонице и куру. Некоторые исследователи включают в группу прионных заболеваний человека также болезнь Альперса у детей, амиотрофический лейкоспонгиоз (описан белорусскими учеными в конце прошлого века, болели работники одной из ферм) и спонгиоформный миозит (мышечное истощение).
Все эти заболевания являются смертельными, и лекарств от них пока не предложено. Но все же зачем организм синтезирует прионы? Какую он отводит роль для них?
Зачем нужны прионы?
В 70-е годы прошлого века два английских исследователя – Паттисон и Джебет – изучали на мышах действие вещества под названием купризон. В нормальных условиях оно связывает в организме ионы меди. Животным включили купризон в обязательную диету с целью посмотреть, какое действие он произведет на грызунов. И поразились! После 30 с лишним дней купризоновой диеты совершенно здоровые до этого мыши превратились в тяжелобольных. Причем все признаки заболевания полностью отвечали симптомами скрепи. Часть мышей, участвовавших в эксперименте, вскрыли и посмотрели – оказалось, что в головном мозгу животных произошли абсолютно те же изменения, что и при прионных болезнях.
Возник вопрос: а что если купризон мышам больше не давать? Попробовали – и через несколько дней грызуны выздоровели. Уже через 30 дней у них исчезли и вызванные купризоном изменения в мозговой ткани.
Спустя много лет было выяснено, что прионы весьма и весьма похожи на положительно заряженные частицы двухвалентной меди. И изменения, которые они вызывают в организме, практически идентичны. Таким образом, исследователи сделали вывод о том, что в нормальном состоянии прионы отвечают за оборот металлов, в частности меди. Но эти данные пока остаются лишь гипотезой.
Фото: ТАСС/Станислав Красильников
Еще одна группа американских исследователей принялась копать в другом направлении. Им удалось получить данные, что прионы помогают клеткам мозга прикрепляться друг к другу и участвуют в передаче сигналов внутри клетки. Это означает, что отсутствие прионов или их дефекты не позволяют клеткам мозга получать сигнал о других клеток, что ведет к развитию тяжелых нарушений в работе нервной и других систем организма.
Но самым интересным является предположение о том, что прионы участвуют в механизмах клеточного старения. Не секрет, что долгое время прионные болезни относили к группе старческих болезней, потому что вызываемые ими изменения весьма сходны с другими заболеваниями (вроде болезни Пика, Альцгеймера и других неврологических недугов). Наличие прионной инфекции как бы подталкивает организм к ускоренному старению. Естественно, это ставит очень важный вопрос: если лекарство от таких болезней будет найдено, не станет ли оно своеобразным ключом к долголетию или даже бессмертию организма? Но ответ на этот вопрос пока дать невозможно, поскольку функции прионов изучены еще недостаточно хорошо.
Способы заражения
В заключение поговорим о способах заражения. Их четыре. В первом и самом распространенном случае заболевание возникает как бы из ниоткуда. То есть жил себе человек, да вдруг взял и заболел. Этот путь возникновения болезни называется спорадическим и, кстати сказать, является наиболее распространенным. По нынешним представлениям, это происходит спонтанно под действием каких-то пока не установленных факторов.
Второй способ – наследственный. Некоторые виды болезней являются семейными и возникают из-за мутаций. В свою очередь, гены передаются потомству. Известно около 40 семей, страдающих фатальной бессоницей. Каждый десятый страдающий болезнью Крейтцфельдта – Якоба – страдает семейной формой этого заболевания.
Фото: M24.ru/Михаил Сипко
Третий способ – ятрогенный. Это означает, что заражение прионами произошло по вине медицинских работников при проведении каких-либо оперативных вмешательств. Однако описаны лишь несколько таких случаев, и все они произошло в 70-е годы прошлого века, когда о свойствах прионов еще никто не знал. Так, одна женщина заболела после того, как ей пересадили роговицу глаза от страдавшего болезнью Крейтцфельдта – Якоба мужчины.
А вот последний способ наиболее коварен и опасен. Дело в том, что человек восприимчив к прионам, которые поражают крупный рогатый скот. И при употреблении в пищу мяса больных животных заболевают и люди – у них развивается болезнь Крейтцфельдта – Якоба. В девяностые годы прошлого века настоящая эпидемия этого страдания разразилась в Англии.
Лечения пока нет. Однако ученые уже выяснили, что некоторые виды прионов разлагаются лишайниками, другим удалось описать особые антиприонные антитела (к инфекционным прионам).
Иными словами, перед исследователями стоит весьма непростая задача, которая не только поможет найти лекарство от тяжелых заболеваний, но и, возможно, поможет открыть секрет долголетия. Для этого нужно только одно – понять прионы.
Прионная болезнь — это… Что такое Прионная болезнь?
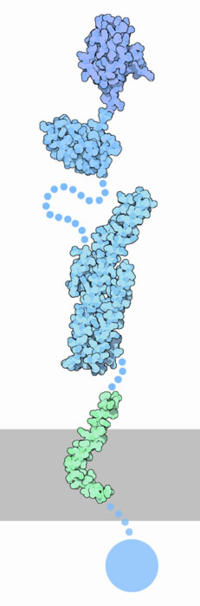
Белок, образующий β-амилоиды — предшественник прионов
- Не путать с гипотетическими элементарными частицами — преонами
Прио́ны (от англ. proteinaceous infectious particles — белковые заразные частицы) — особый класс инфекционных агентов, чисто белковых, не содержащих нуклеиновых кислот, вызывающих тяжёлые заболевания центральной нервной системы у человека и ряда высших животных (т. н. «медленные инфекции»).
Прионный белок, обладающий аномальной трёхмерной структурой, способен прямо катализировать структурное превращение гомологичного ему нормального клеточного белка в себе подобный (прионный), присоединяясь к белку-мишени и изменяя его конформацию. Как правило, прионное состояние белка характеризуется переходом α-спиралей белка в β-слои.
История
Во второй половине XX века врачи столкнулись с необычным заболеванием человека — постепенно прогрессирующим разрушением головного мозга, происходящим в результате гибели нервных клеток. Это заболевание получило название губчатой энцефалопатии. Похожие симптомы были известны давно, но наблюдались они не у человека, а у животных (скрейпи овец), и долгое время между ними не находили достаточной обоснованной связи.
Новый интерес к их изучению возник в 1996 г., когда в Великобритании появилась новая форма заболевания, обозначаемая как «новый вариант болезни Крейтцфельдта-Якоба (nvCJD)».
Важным событием было распространение «Коровьего бешенства» в Великобритании, эпидемия которого была сначала в 1992—1993 гг, а потом и в 2001 г охватила несколько европейских государств, но тем не менее мясо было экспортировано во многие страны. Заболевание связывают с использованием «прионизированной» костной муки в кормах и премиксах, изготовленной из туш павших или заболевших животных, возможно, и не имевших явных признаков заболевания.
Пути переноса причинного фактора болезни, механизмы проникновения прионов в организм и патогенез заболевания изучены пока недостаточно.
Свойства молекул
Трехмерные структуры С-концевых участков белков PrPC (слева) и PrPSc. Фиолетовым цветом окрашены альфа-спирали, зелёным — бета тяжи.N-концевой участок белка релаксирован и не поддаётся рентгеноструктурному анализу.
Прионовые белки млекопитающих не сходны с прионовыми белками дрожжей по аминокислотной последовательности. Несмотря на это, основные структурные особенности (формирование амилоидных волокон и высокая специфичность, препятствующая передаче прионов от одного вида организмов к другому) у них общие. Вместе с тем, прион, отвечающий за коровье бешенство, обладает способностью передаваться от вида к виду.
Правый рисунок — модель двух конформаций приона; слева известная, нормальная, конформация структуры терминального участка C-terminal PrPC. (для отображения/загрузки см. RCSB Protein Databank).
Молекулярные основы патогенеза

Предполагаемый механизм «размножения» прионов.
В ходе исследований мозговых тканей умерших от прионных инфекций животных было показано, что прионы не содержат нуклеиновых кислот, а представляют собой белки. Одним из первых охарактеризованных прионнных белков стал PrP (от англ. prion-related protein или protease-resistant protein) массой около 35 кДа. Известно, что PrP может существовать в двух конформациях — «здоровой» — PrPC, которую он имеет в нормальных клетках (C — от англ. cellular — «клеточный»), в которой преобладают альфа-спирали, и «патологической» — PrPSc, собственно прионной (Sc— от scrapie), для которой характерно наличие большого количества бета-тяжей. При попадании в здоровую клетку, PrPSc катализирует переход клеточного PrPC в прионную конформацию. Накопление прионного белка сопровождается его агрегацией, образованием высокоупорядоченных фибрил (амилоидов), что в конце концов приводит к гибели клетки. Высвободившийся прион, по-видимому, оказывается способен проникать в соседние клетки, также вызывая их гибель.
Функции белка PrPC в здоровой клетке пока не определены. В норме белок PrPC ассоциирован с клеточной мембраной, гликозилирован остатком сиаловой кислоты. Он совершает циклические переходы внутрь клетки и обратно на поверхность в ходе эндо- и экзоцитоза. Один такой цикл длится около часа. В эндоцитозном пузырьке или на поверхности клетки молекула PrPC может разрезаться протеазами на две примерно равные части.
До конца механизм спонтанного возникновения прионных инфекций не ясен. Считается (но ещё не полностью доказано), что прионы образуются в результате ошибок в биосинтезе белков. Мутации генов, кодирующих прионный белок (PrP), ошибки трансляции, процессы протеолиза — считаются главными кандидатами на механизм возникновения прионов.
Есть данные, дающее основание считать, что прионы являются не только инфекционными агентами, но и имеют функции в нормальных биопроцессах. Так, например, существует гипотеза, что через прионы осуществляется механизм генетически обусловленного стохастического старения.
Классификация
Этиология
Человек может заразиться прионами, содержащимися в пище, так как они не разрушаются ферментами пищеварительного тракта. Беспрепятственно проникая через стенку тонкого кишечника, они в конечном итоге попадают в центральную нервную систему. Так переносится новый вариант болезни Крейтцфельдта-Якоба (nvCJD), которой люди заражаются после употребления в пищу говядины, содержащей нервную ткань из голов скота, больных бычьей губчатой энцефалопатией (BSE, коровье бешенство).
Прионы могут проникать в тело и парентеральным путем. Были описаны случаи заражения при внутримышечном введении препаратов, изготовленных из человеческих гипофизов (главным образом гормоны роста для лечения карликовости), а также заражение мозга инструментами при нейрохирургических операциях, поскольку прионы устойчивы к применяемым в настоящее время термическим и химическим методам стерилизации. Эта форма болезни Крейтцфельдта-Якоба обозначается как ятрогенная (1CJD).
При определённых, неизвестных условиях, в организме человека может произойти спонтанная трансформация прионового протеина в прион. Так возникает так называемая спорадическая болезнь Крейтцфельдта-Якоба (sCJD), впервые описанная в 1920 г. независимо друг от друга Гансом Герхардом Крейтцфельдтом и Альфонсом Марией Якобом. Предполагается, что спонтанное возникновение этой болезни связано с фактом, что в норме в человеческом теле постоянно возникает небольшое количество прионов, которые эффективно ликвидируются клеточным Аппаратом Гольджи. Нарушение этой способности «самоочищения» клеток может привести к повышению уровня прионов выше допустимой границы нормы и к их дальнейшему неконтролируемому распространению. Причиной возникновения спорадической болезни Крейтцфельдта-Якоба согласно этой теории является нарушение функции Аппарата Гольджи в клетках.
Особую группу прионовых заболеваний представляют собой наследственные (врожденные) болезни, вызванные мутацией гена прионового протеина, который делает возникший прионовый протеин более подверженным спонтанному изменению пространственной конфигурации и превращения их в прионы. К этой группе наследственных заболеваний относится и наследственная форма болезни Крейтцфельдта-Якоба (fCJD), которая наблюдается в ряде стран мира.
При прионовой патологии наивысшая концентрация прионов обнаружена в нервной ткани заражённых людей. Значительное количество прионов встречается в лимфатической ткани. Наличие прионов в биологических жидкостях, включая слюну, пока не было однозначно подтверждено. Если представление о постоянном возникновении небольшого количества прионов верно, то можно предположить, что новые, более чувствительные методы диагностики откроют это количество прионов, разбросанное по различным тканям. В данном случае, однако, речь пойдёт о «физиологическом» уровне прионов, которые не представляют собой никакой угрозы для человека.
Пути заражения
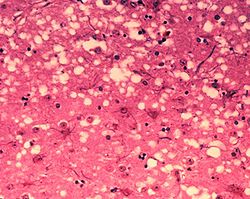
Гистологический препарат, поражение ткани прионами с образованием характерной губчатой структуры.
Очень мало известно о молекулярном характере прионов, вызывающих заболевания. Заражение могут вызвать примерно 100 000 молекул, которые в большинстве случаев образуют большие скопления. Значение агрегации отдельных молекул в ассоциации для вирулентности прионов пока не известна. Нельзя исключить, что вирулентными являются и отдельные молекулы прионов. Из некоторых экспериментов следует, что для возникновения прионов в ткани достаточно лишь временного контакта ткани с материалом, содержащим прионы, и нет необходимости, чтобы прионы были навсегда внесены в организм. Этот риск является актуальным, например, в связи с использованием хирургических инструментов, заражённых прионами. Процесс трансформации «здоровых» прионовых протеинов в прионы может быть инициирован простым контактом здоровых тканей с прионами, зафиксированными на хирургическом инструменте.
Ход болезни и распространение прионов по организму зависит от типа приона. Прионы отличаются составом аминокислот, характерных для данного вида, определяемых видовым геном прионового протеина, а также так называемыми посттрансляционными модификациями или степенью гликозилирования базовой белковой цепочки. Посттрансляционная модификация значительно влияет на характеристики прионов и именно ей приписывают разницу между так называемыми прионовыми родами. В случае нового варианта (nvCJD) был пока что описан лишь один вид приона, сходный с прионами скота, заражённого бычьей губчатой энцефалопатией. Поэтому течение заболевания у человека и животных, заражённых новым вариантам, практически одинаково. У прочих видов живых существ, однако, известно много прионовых родов. У овец были описано примерно два десятка таких родов, которые не вирулентны для человека. Течение овечьего прионового заболевания в зависимости от рода прионов и драматически отличается — от очень быстрого, с практически внезапной гибелью, до медленного, затяжного.
Нетипичные случаи клинического течения нового варианта у скота, заражённого бычьей губчатой энцефалопатией, которые имели место в Японии и Италии, наводят на мысль о существовании большего количества родов бычьих прионов. Если бы этот род бычьих прионов попал в организм человека, следовало бы ожидать возникновение нового варианта с симптомами и клиническим течением, отличными от известных случаев.
У пациентов, больных болезнью Крейтцфельдта-Якоба, прионы распространяются в нервной системе, тканях глаза и лимфатических тканям, включая миндалины, селезенку, а также в слепой кишке. Наибольшее количество прионов находится в нервной системе, а наименьшее — в лимфатической ткани.
Пока что не был зарегистрирован ни один случай переноса нового варианта болезни Крейтцфельдта-Якоба (nvCJD) при медицинском вмешательстве, что является, разумеется, хорошей новостью. С другой стороны, специалисты предупреждают о преувеличенном оптимизме, прежде всего в условиях Великобритании, так как инкубационный период может быть достаточно долгим (от 5-8 месяцев до 10-15 лет).
Прионы и медицинские инструменты
Прионы очень стойки к обычным методам дезинфекции. Ионизирующее, ультрафиолетовое или микроволновое излучение на них практически не действует. Дезинфекционные средства, обычно используемые в медицинской практике, действуют на них лишь в очень ограниченной мере. Надёжно их ликвидируют дезинфицирующие реактивы — сильные окислители, разрушающе действующие на протеины.
Другое затруднение представляет собой стойкость прионов к высоким температурам. Даже при автоклавировании при 134 °C в течение 18 минут невозможно достичь полного разрушения прионов, и прионы «выживают» в форме, способной вызвать заражение. Стойкость к высоким температурам ещё более возрастает, если прионы засохнут на поверхности металла или стекла или если образцы перед автоклавированием были подвергнуты действию формальдегида.
В Великобритании, где новый вариант является очень серьёзной проблемой, по этим причинам уже используются одноразовые хирургические инструменты для тонзиллэктомии. В будущем напрашивается альтернативное решение: создания новых инструментов, с учётом повышенных требований к очистке и обеззараживанию. Одноразовое использование инструментов согласно принципам ВОЗ требуется в случае стоматологического обслуживания пациентов с диагностированным прионным заболеванием или в случае подозрения на него.
Намного более сложным решением этой проблемы является лечение пациентов группы риска. К ним относятся пациенты, которые подверглись операциям, при которых была использована потенциально заражённая твёрдая мозговая оболочка, или пациенты из семей с наследственной формой болезни Крейтцфельдта-Якоба. ВОЗ в этом случае не требует никаких специальных мер. Британский Консультационный научный комитет по губчатой энцефалопатии в своём решении в 1998 г. счёл возможным ограничиться более тщательной очисткой и обеззараживанием инструментов, в сочетании с более длительным автоклавированием.
Прионные заболевания человека
Наиболее известные прионные инфекции, связанные с поражением головного мозга:
Потенциальная опасность для человека
Несмотря на незначительное количество явных случаев прионных заболеваний у людей, многие специалисты считают, что имеется высокая степень опасности «медленных» инфекций для человека.
Имеются данные, что источником распространения могут быть стоматологические процедуры, связанные с попаданием прионов в кровяное русло.
Под подозрение попал также лецитин животного происхождения, что вызвало сокращение применения его в фармакологической промышленности, и вытеснение растительным (в основном, соевым) лецитином.
Исследования прионов дрожжей и др. микромицетов
Прион-подобные белки, поведение которых подобно поведению PrP найдены в природных популяциях микромицетов и дрожжей. Исследования прионов дрожжей подтвердили гипотезу о том, что превращение белков в прионное состояние зависит только от белков. Было показано, что прионы, экстрагированные из клеток, могут служить «семенами» образования прионов в пробирке. Одним из наиболее хорошо изученных белков, склонных к образованию прионов у дрожжей — фактор терминации трансляции (eRF3), который образует так назваемые PSI+ клетки. Такие клетки имеют изменёное физиологическое состояние и изменённый уровень выражения некоторых генов, что позволило выдвинуть гипотезу о том, что у дрожжей образование прионов может играть адаптативную роль [1] .
Критика
Mark Purdy и David R. Brown предположили, что металлоионы, взаимодействуя с протеинами приона могут быть причиной развития прион-индуцированных (prion-mediated) заболеваний.[2]
Purdy провёл кластерное эпидемиологическое исследование при прионных заболеваниях в районах с низкой концентрацией меди в почвах.
Примечания
См. также
Литература
Источники
- ing. Jaroslav Petr, DrSc. Phony a ustni dutina. Progresdent, 2004, № 2, s. 12-16
Ссылки
На английском языке
- Mad Cow Disease Инфорация о коровьем бешенстве, Center for Global Food Issues.
- Madcowering A BSE-TSE blog.
- The Pathological Protein — Mad Cow, Chronic Wasting, and Other Deadly Prion Diseases (2003, updated online 2005). Philip Yam, Scientific American magazine writer and News Editor.
- Прионные заболевания (2003). Dr. Sean Heaphy, Leicester University.
- Prion Diseases and the BSE Crisis (1997). Статья Stanley Prusiner — первооткрывателя прионов, из Science magazine.
- Britannica Nobel: Прион, 1997
- ICTVdb 90.001.0.01. Mammalian Prions
- Официальная страница сайта о болезни коровьего бешенства Mad Cow Disease
- News & Views on Mad Cow Disease, Mad Deer Disease, Chronic Wasting Disease, and Bovine Spongiform Encephalopathy
- Biography of Dr Prusiner
- Science Daily статья о вакцине против прионных заболеваний
- Science Daily article on transmission of prions through soil
- Хороший обзор по прионам из Science Creative Quarterly
На русском языке
Wikimedia Foundation. 2010.
