После операции на кишечнике понос: Информация о резекции толстой кишки
Послеоперационные нарушения функции пищеварительного тракта
Рассматриваются патогенетические и клинические аспекты состояния пищеварительной системы в раннем послеоперационном периоде.
Одной из причин и принципиально важной составной частью дисметаболических изменений у пациентов после хирургических вмешательств является нарушение функций пищеварительного тракта, известное как синдром энтеральной недостаточности (син. — синдром кишечной недостаточности, послеоперационная мальдигестия). Большинство авторов под послеоперационной дисфункцией пищеварительного тракта (при любом ее терминологическом обозначении) понимает невозможность энтерального питания с ограничением или полным исключением абсорбции адекватного количества питательных веществ, возникающую в период 72 часов с момента окончания операции и охватывающую большое число нежелательных явлений от тошноты и рвоты до стойкого пареза, выраженной нутритивной и, в коечном счете, полиорганной недостаточности.
Нарушение перистальтики в ближайшем послеоперационном периоде является стандартной ситуацией для абдоминальной хирургии и возникает не менее чем у 90% больных. Несмотря на это ряд авторов сообщает о том, что на фоне мультимодального подхода к ведению больных в послеоперационном периоде собственно илеус (динамическая кишечная непроходимость) возникает не более чем у 5% пациентов. Дисфункция пищеварительного тракта является более широким понятием, чем послеоперационный парез, и включает в себя широкий диапазон изменений, зависящих степени хирургической агрессии. Относительно небольшое число иследований включает пациентов с нарушениями функции пищеварительной трубки после экстраабдоминальных оперативных вмешательств.
Патогенез послеоперационной дисфункции пищеварительного тракта представляет собой целый комплекс различных факторов. Синдром энтеральной недостаточности объединяет в себе несколько взаимосвязанных и протекающих последовательно или параллельно патологических процессов в пищеварительном тракте, а именно: нарушение моторики пищеварительной трубки, нарушение внутрипросветного и пристеночного пищеварения, нарушение абсорбции питательных веществ, возникновение феномена бактериальной транслокации.
Традиционно в качестве ведущей составляющей синдрома энтеральной недостаточности у оперированных пациентов рассматривается нарушение моторно-эвакуаторной функции пищеварительного тракта. Исследования, посвященные изучению механизмов возникновения послеоперационного пареза пищеварительной трубки имеют длительную историю. Впервые угнетающее влияние спинальных рефлексов на деятельность кишечника в эксперименте установил еще в 1872 году F. Goltz. В 1899 году в своем классическом труде «The movements and innervation of the small intestine» W. Bayliss и E. Starling показали, что абляция nn. splanchnici может повышать моторную активность кишечника, угнетенную после лапаротомии. Авторы установили данную связь, используя так называемый энтерограф, позволивший им исследовать моторику интактной и поврежденной тонкой кишки в эксперименте. В последующие десятилетия ряд работ подтвердил влияние симпатической нервной системы на возникновение послеоперационного пареза пищеварительной трубки.
Bayliss и E. Starling показали, что абляция nn. splanchnici может повышать моторную активность кишечника, угнетенную после лапаротомии. Авторы установили данную связь, используя так называемый энтерограф, позволивший им исследовать моторику интактной и поврежденной тонкой кишки в эксперименте. В последующие десятилетия ряд работ подтвердил влияние симпатической нервной системы на возникновение послеоперационного пареза пищеварительной трубки.
С точки зрения современной физиологии нормальная перистальтика является результатом комплекса взаимодействий нервных сплетений пищеварительной трубки, центральной нервной системы, гормональных влияний, локальных факторов, влияющих на гладкомышечную активность. Известно, что перистальтика желудка и тонкой кишки зависит от фазы пищеварения. По сравнению с периодом голодания перистальтика после приема пищи представляет собой набор низкочастотных, с вариабельной амплитудой, несгруппированных сокращений, чьи число, интенсивность и продолжительность зависят от физического состояния и химического состава пищи.

Как известно мышечная оболочка желудка и тонкой кишки представлена тесно ассоциированным клеточным массивом, предполагающим возможность реализации электрофизиологических отправлений. Различают три разновидности электропотенциала мышечной оболочки: потенциал покоя, медленноволновой потенциал и пиковый потенциал, вызывающий гладкомышечные сокращения. При этом пиковый потенциал может возникнуть только при фоновом наличии медленноволнового потенциала, обусловленного активностью кишечного пейсмекера. Мнение об основополагающем и определяющем влиянии гастроинтестинальных гормонов на моторную активность пищеварительной трубки в последние годы подверглось серьезному пересмотру. В настоящее время принято считать, что моторная активность желудка и тонкой кишки определяется комплексом взаимодействий локальных электрофизиологических процессов, нисходящих нервных влияний и действия гастроинтестинальных гормонов.
Толстая кишка, чья основная роль заключается в абсорбции воды и формировании кала, по своей структуре и функционированию от других отделов кишечника. Измерение электрической активности толстой кишки показало наличие нерегулярных импульсов с различной амплитудой. Гладкая мускулатура толстой кишки не содержит достаточного числа специфических межклеточных контактов и поэтому не функционирует как единое целое. В толстой кишке также различают три вида электрической активности: собственно мембранный потенциал, дискретную электрическую активность, представляющую собой периодически возникающие пиковые потенциалы, накладывающиеся на осцилляции мембранного потенциала, и продолжительную электрическую активность, не относящуюся к осцилляциям мембранного потенциала, но определяющую возникновение мышечных сокращений и пассаж пищевых масс.
Хирургические манипуляции на пищеварительной трубке сопровождаются нарушением нормальной базальной электрической активности гладкомышечных клеток желудка и тонкой кишки. В частности в желудке отмечается нерегулярность возникновения пиковой активности и медленноволновой активности. Единственным стимулом перистальтических сокращений кишечника в послеоперационном периоде у пациентов, не получающих энтерально пищевые субстанции, остается мигрирующий моторный комплекс. Поэтому голодание в послеоперационном периоде уже само по себе закономерно влечет наличие минимальной перистальтической активности кишечника.
В частности в желудке отмечается нерегулярность возникновения пиковой активности и медленноволновой активности. Единственным стимулом перистальтических сокращений кишечника в послеоперационном периоде у пациентов, не получающих энтерально пищевые субстанции, остается мигрирующий моторный комплекс. Поэтому голодание в послеоперационном периоде уже само по себе закономерно влечет наличие минимальной перистальтической активности кишечника.
Установлено, что многие фармакологические агенты, например средства для наркоза, могут оказывать весьма вариабельное воздействие на активность мигрирующего моторного комплекса. Так галотан ингибирует активность мигрирующего моторного комплекса, в то время как энфлюран, напротив — возбуждает. Рассечение париетальной брюшины также уменьшает активность мигрирующего моторного комплекса, а длительное угнетение его активности наблюдается при любых механических воздействиях на кишечник в ходе операции. Вследствие операционной травмы также нарушаются и все три вида электрической активности толстой кишки.
Моторика пищеварительной трубки во многом определяется балансом стимулирующих влияний парасимпатического отдела и тормозящих влияний симпатического отдела вегетативной нервной системы. Влияние симпатической нервной системы, являясь эфферентной составляющей многих патологических рефлексов, является определяющим в ингибировании моторной активности кишечника. Механизм симпатического ингибирования заключается в препятствовании освобождению ацетилхолина в синапсах и проведению стимулирующего моторную активность нервного импульса волокнами парасимпатического мезентериального сплетения. Подтверждением этого является возможность нивелирования послеоперационного пареза кишечника и угнетения моторики желудка медикаментозной симпатэктомией с помощью 6-гидроксидопамина. Подтверждением роли симпатической нервной системы в развитии послеоперационного пареза может служить и экспериментально выявленный факт быстрого выхода из кишечного депо катехоламинов в ответ на операционную травму. Тем не менее клинические наблюдения показывают, что блокады симпатических нервных сплетений не всегда успешны в разрешении послеоперационного пареза. Очевидно в этой связи, что в развитии послеоперационного угнетения моторной активности пищеварительной трубки, помимо адренергических и холинергических влияний, играют роль и другие патогенетические механизмы. К настоящему времени доказано влияние на возникновения послеоперационного пареза активации калликреин-кининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ; снижения биологической активности клеток APUD-системы (продуцентов серотонина — субстанции Р и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и определяющих локальную гемоперфузию кишечной стенки; дисрегуляторного поступления секретина, холецистокинина и энтероглюкагона.
Подтверждением этого является возможность нивелирования послеоперационного пареза кишечника и угнетения моторики желудка медикаментозной симпатэктомией с помощью 6-гидроксидопамина. Подтверждением роли симпатической нервной системы в развитии послеоперационного пареза может служить и экспериментально выявленный факт быстрого выхода из кишечного депо катехоламинов в ответ на операционную травму. Тем не менее клинические наблюдения показывают, что блокады симпатических нервных сплетений не всегда успешны в разрешении послеоперационного пареза. Очевидно в этой связи, что в развитии послеоперационного угнетения моторной активности пищеварительной трубки, помимо адренергических и холинергических влияний, играют роль и другие патогенетические механизмы. К настоящему времени доказано влияние на возникновения послеоперационного пареза активации калликреин-кининовой системы с избыточным поступлением в кровоток гистамина, брадикинина, протеолитических ферментов и других биологически активных веществ; снижения биологической активности клеток APUD-системы (продуцентов серотонина — субстанции Р и мотилина), участвующих в работе мигрирующего миоэлектрического комплекса кишки и определяющих локальную гемоперфузию кишечной стенки; дисрегуляторного поступления секретина, холецистокинина и энтероглюкагона. Так, в качестве факторов, влияющих на развитие послеоперационного пареза, рассматривалось большое число нейротрансмиттеров, локальных регуляторных полипептидов и гормонов, однако не один из них не был признан определяющим. Тем не менее механизмы влияния тех или иных факторов достаточно хорошо изучены и подтверждены экспериментально. Вазоактивный интестинальный пептид (VIP) потенцирует влияние холинэргических нейронов в желудке, что проявляется снижением активности мышечного слоя антрального отдела и пилоруса. Субстанция Р, являющаяся нейротрансмиттером и участвующая в эфферентной ноцицептивной передаче, напротив, оказывает стимулирующее влияние на перистальтику в послеоперационном периоде. Серотонин также усиливает двигательную активность гладкой мускулатуры, благодаря усилению секреции субстанции Р в окончаниях сенсорных нейронов и путем воздействия на ионотропные и метаботропные рецепторы.
Так, в качестве факторов, влияющих на развитие послеоперационного пареза, рассматривалось большое число нейротрансмиттеров, локальных регуляторных полипептидов и гормонов, однако не один из них не был признан определяющим. Тем не менее механизмы влияния тех или иных факторов достаточно хорошо изучены и подтверждены экспериментально. Вазоактивный интестинальный пептид (VIP) потенцирует влияние холинэргических нейронов в желудке, что проявляется снижением активности мышечного слоя антрального отдела и пилоруса. Субстанция Р, являющаяся нейротрансмиттером и участвующая в эфферентной ноцицептивной передаче, напротив, оказывает стимулирующее влияние на перистальтику в послеоперационном периоде. Серотонин также усиливает двигательную активность гладкой мускулатуры, благодаря усилению секреции субстанции Р в окончаниях сенсорных нейронов и путем воздействия на ионотропные и метаботропные рецепторы.
В настоящее время известно, что серотонин играет важную роль в регуляции функций желудочно-кишечного тракта. Наибольший запас серотонина в организме находится в желудочно-кишечном тракте, составляя более чем 95 % от серотонина во всем организме. Основная часть серотонина содержится в энтерохроматофинных клетках кишечного эпителия, в пределах которого серотонин синтезируется из L-триптофана и хранится в секреторных гранулах. Серотонин действует как медиатор межнейрональных связей в мышечной оболочке тонкой кишки. Серотонин, выделяемый из энтерохроматофинных клеток, в ответ на химическую или механическую стимуляцию, воздействует на желудочно-кишечную моторику и кишечный транспорт электролитов. Перистальтика различных отделов кишечника координируется нейронами тонкокишечной нервной системы, которые после активации серотониновых механизмов продуцируют другие медиаторы. Помимо этого серотонин, находящийся в энтерохроматофинных клетках, регулирует рост соседних эпителиоцитов и может замедлять кишечное поглощение сахара и L-альфа-аминоизокапроновой кислоты (И.А. Соловьев, 2013).
Наибольший запас серотонина в организме находится в желудочно-кишечном тракте, составляя более чем 95 % от серотонина во всем организме. Основная часть серотонина содержится в энтерохроматофинных клетках кишечного эпителия, в пределах которого серотонин синтезируется из L-триптофана и хранится в секреторных гранулах. Серотонин действует как медиатор межнейрональных связей в мышечной оболочке тонкой кишки. Серотонин, выделяемый из энтерохроматофинных клеток, в ответ на химическую или механическую стимуляцию, воздействует на желудочно-кишечную моторику и кишечный транспорт электролитов. Перистальтика различных отделов кишечника координируется нейронами тонкокишечной нервной системы, которые после активации серотониновых механизмов продуцируют другие медиаторы. Помимо этого серотонин, находящийся в энтерохроматофинных клетках, регулирует рост соседних эпителиоцитов и может замедлять кишечное поглощение сахара и L-альфа-аминоизокапроновой кислоты (И.А. Соловьев, 2013).
В 2003 году А. П. Симоненков и соавт. представили патогенетическую концепцию серотониновой недостаточности как ключевого фактора развития синдрома энтеральной недостаточности, в том числе и в послеоперационном периоде. Согласно данной концепции, дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. На основании экспериментальных и клинических исследований установлено, что при патологических состояниях в организме увеличивается количество лигандов серотониновых рецепторов. Антагонисты серотонина при взаимодействии с серотониновыми рецепторами вызывают паралич гладкой мускулатуры. Агонисты напротив вызывают спазм гладкой мускулатуры. Согласно данной концепции дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей.
П. Симоненков и соавт. представили патогенетическую концепцию серотониновой недостаточности как ключевого фактора развития синдрома энтеральной недостаточности, в том числе и в послеоперационном периоде. Согласно данной концепции, дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. На основании экспериментальных и клинических исследований установлено, что при патологических состояниях в организме увеличивается количество лигандов серотониновых рецепторов. Антагонисты серотонина при взаимодействии с серотониновыми рецепторами вызывают паралич гладкой мускулатуры. Агонисты напротив вызывают спазм гладкой мускулатуры. Согласно данной концепции дисфункция гладкой мускулатуры, возникшая в результате нарушения взаимодействия серотонина с его рецепторами, ведет к нарушению эндогенной вазомоторики, нарушению микроциркуляции, к возникновению локальной и региональной гипоксии, повреждению и некрозу тканей. В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Всё это ведёт к растяжению кишечных петель и повышению внутриполостного давления, приводя к повреждению, как всей пищеварительной системы, так и других функциональных систем гомеостаза.
В дальнейшем миоциты оказываются неспособными к восприятию нервных импульсов ввиду выраженных метаболических сдвигов и внутриклеточных электролитных нарушений. Всё это ведёт к растяжению кишечных петель и повышению внутриполостного давления, приводя к повреждению, как всей пищеварительной системы, так и других функциональных систем гомеостаза.
Оксид азота (NO) в настояще время рассматривается как наиболее значимый нехолинергический и неадренергический ингибитор мышечной активности пищеварительной трубки. Считается, что свое ингибирующее действие NO оказывает внутри кишечных нейронов вследствие активизации NO-синтетазы. В экспериментах показано, что антагонист вазоактивного интестинального пептида, субстанция Р, и ингибиторы NO-синтетазы, достоверно усиливают кишечную перистальтику. Кальцитонин ген-связанный пептид присутствует в афферентных нейронах пищеварительного тракта, а также в интерстициальных рецепторах. Показана роль кальцитонин ген-связанного пептида в замедлении перистальтики и, в частности, в задержке эвакуации из желудка. Предполагается, что высвобождение кальцитонин ген-связанного пептида стимулируется операционной травмой и реализуется в замедлении перистальтики, что подтверждается влиянием антагонистов рецепторов данного медиатора или специфических моноклональных тел к нему на активизацию моторной активности пищеварительной трубки.
Предполагается, что высвобождение кальцитонин ген-связанного пептида стимулируется операционной травмой и реализуется в замедлении перистальтики, что подтверждается влиянием антагонистов рецепторов данного медиатора или специфических моноклональных тел к нему на активизацию моторной активности пищеварительной трубки.
Эндогенные опиоиды, в большом количестве высвобождаемые в ответ на операционную травму, также рассматриваются как фактор возникновения послеоперационного пареза. Их тормозящий эффект на моторную активность желудка и кишечника реализуется посредством активации мю-опиоидных рецепторов. Так энкефалин вызывает угнетение желудочной и кишечной перистальтики и считается одним из факторов возникновения послеоперационного пареза.
Как обсуждалось выше кортикотропин-релизинг фактор (КРФ) является одним из ключевых медиаторов любой стрессовой реакции организма. Установлено, что КРФ и КРФ-связанный пептид индуцируют задержку эвакуации из желудка и ингибируют кишечную перистальтику, создавая картину, аналогичную послеоперационному парезу. При этом замедление перистальтики не зависит от приема питательных субстанций как энтерально, так и парентерально. В эксперименте было показано, что введение антагонистов КРФ-рецепторов перед оперативным вмешательством исключает возникновение пареза даже в случае механического воздействия на кишечник как минимум в течение 3 часов после операции. Отмечено повышение плазменного уровня КРФ в ответ на операционную травму, однако место синтеза данного медиатора до настоящего времени не установлено. Известно лишь, что данный пептид имеется в мозговом слое надпочечников, а активность чревных нервов и гормональная стимуляция катехоламинами является триггером к его высвобождению в кровоток. Отмечено также, что вазопрессин, выделяемый в ответ на физический стресс, может способствовать высвобождению КРФ.
При этом замедление перистальтики не зависит от приема питательных субстанций как энтерально, так и парентерально. В эксперименте было показано, что введение антагонистов КРФ-рецепторов перед оперативным вмешательством исключает возникновение пареза даже в случае механического воздействия на кишечник как минимум в течение 3 часов после операции. Отмечено повышение плазменного уровня КРФ в ответ на операционную травму, однако место синтеза данного медиатора до настоящего времени не установлено. Известно лишь, что данный пептид имеется в мозговом слое надпочечников, а активность чревных нервов и гормональная стимуляция катехоламинами является триггером к его высвобождению в кровоток. Отмечено также, что вазопрессин, выделяемый в ответ на физический стресс, может способствовать высвобождению КРФ.
В 2001 году N. Schwarz в эксперименте установил факт увеличения экспрессии циклооксигеназы 2 типа (ЦОГ-2) в тканевых макрофагах и нейронах кишечной стенки после механических манипуляций на кишечной трубке, что сопровождается увеличением концентрации простагландинов в перитонеальной жидкости и в плазме.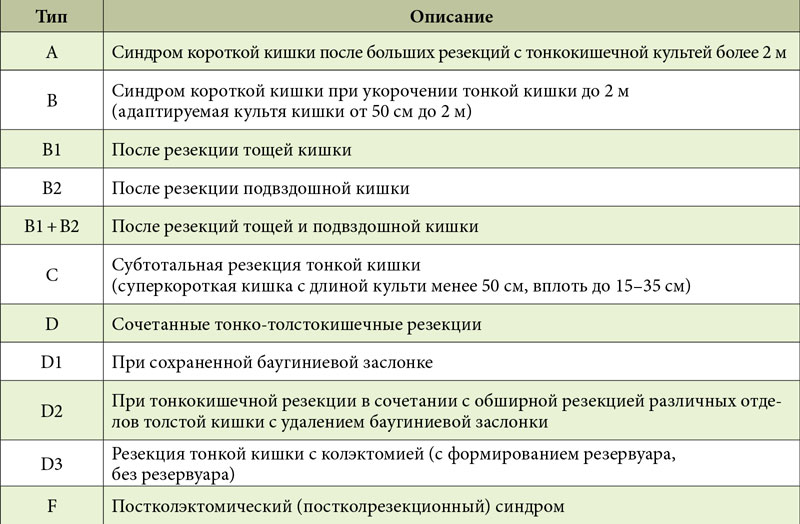 При этом повышение концентрации простагландинов коррелирует со степенью снижения моторной активности кишечника, а ингибиторы ЦОГ-2 восстанавливают моторику кишечной трубки.
При этом повышение концентрации простагландинов коррелирует со степенью снижения моторной активности кишечника, а ингибиторы ЦОГ-2 восстанавливают моторику кишечной трубки.
Как указывалось выше целый ряд средств анестезиологического пособия оказывают выраженное влияние на послеоперационные изменения моторики пищеварительного тракта. Известно, что средства для наркоза оказывают наибольшее ингибирующее влияние на моторику толстой кишки, что связано с особенностями ее автономной иннервации, а именно — с отсутствием плотных интрацеллюлярных контактов в гладкомышечном слое. Задержка эвакуации из желудка наиболее часто наблюдается при длительном воздействии препаратов, используемых при проведении нароза, таких как атропин, галотан, энфлюран.
Эпидуральная анестезия способна блокировать афферентные и эфферентные рефлексы, ингибирующие перистальтику, увеличивать спланхнический кровоток и оказывать противовоспалительное действие. Помимо этого еще одним положительным фактором проведения эпидуральной анестезии является способность к блокаде афферентных стимулов, служащих триггерами для развития эндокринной и метаболической реакции на стресс, что опосредованно снижает интенсивность послеоперационного катаболизма. Многочисленными исследованиями показано, что эпидуральная анестезия бупивокаином (за исключением нижне-грудного и поясничного уровней) достоверно снижает выраженность послеоперационного пареза пищеварительного тракта по сравнению с системным или эпидуральным введением опиоидов. Сами по себе опиоиды оказывают выраженный ингибирующий эффект на моторную активность желудка, вызывая при этом гипертонус его антрального отдела и проксимальной части двенадцатиперстной кишки. Влияние опиоидов на тонкую кишку более сложно. Морфин имеет двухфазное действие: 1) инициальная стимуляция моторики кишечника при активации третьей фазы мигрирующего моторного комплекса, 2) возникновение атонии мышечного слоя кишечной трубки. Морфин повышает тонус и амплитуду непропульсивных сокращений и снижает выраженность пропульсивных волн в толстой кишке, что в целом сопровождается снижением ее моторной активности. Вместе с тем использование антагониста опиоидных рецепторов налоксона оказывается неэффективным в лечении послеоперационного пареза.
Многочисленными исследованиями показано, что эпидуральная анестезия бупивокаином (за исключением нижне-грудного и поясничного уровней) достоверно снижает выраженность послеоперационного пареза пищеварительного тракта по сравнению с системным или эпидуральным введением опиоидов. Сами по себе опиоиды оказывают выраженный ингибирующий эффект на моторную активность желудка, вызывая при этом гипертонус его антрального отдела и проксимальной части двенадцатиперстной кишки. Влияние опиоидов на тонкую кишку более сложно. Морфин имеет двухфазное действие: 1) инициальная стимуляция моторики кишечника при активации третьей фазы мигрирующего моторного комплекса, 2) возникновение атонии мышечного слоя кишечной трубки. Морфин повышает тонус и амплитуду непропульсивных сокращений и снижает выраженность пропульсивных волн в толстой кишке, что в целом сопровождается снижением ее моторной активности. Вместе с тем использование антагониста опиоидных рецепторов налоксона оказывается неэффективным в лечении послеоперационного пареза. С другой стороны новые антагонисты опиоидных рецепторов, не оказывающие центрального действия (метилналтрексон) в клинических исследованиях зарекомендовали себя как средства, способствующие разрешению пареза на фоне системной анальгезии морфином. Новые агонисты опиоидных рецепторов k (ADL-8-2698), обладая анальгетическими свойствами опиоидов, при этом не оказывают влияния на перистальтику кишечника и даже способствуют раннему разрешению послеоперационного пареза.
С другой стороны новые антагонисты опиоидных рецепторов, не оказывающие центрального действия (метилналтрексон) в клинических исследованиях зарекомендовали себя как средства, способствующие разрешению пареза на фоне системной анальгезии морфином. Новые агонисты опиоидных рецепторов k (ADL-8-2698), обладая анальгетическими свойствами опиоидов, при этом не оказывают влияния на перистальтику кишечника и даже способствуют раннему разрешению послеоперационного пареза.
Нарушение моторики пищеварительной трубки, а именно – возникновение ее пареза, определяет нарушение пассажа химуса, возникновение внутрипросветного дисбаланса его жидкой и газовой фаз, влекущего за собой, помимо нарушения всасывания, изменение микробной флоры кишки и проницаемости кишечной стенки.
Согласно патогенетической концепции, изложенной И.П. Колесник (2007), непосредственно после возникновения пареза пищеварительной трубки, несмотря на глубокое угнетение ее моторной функции, вследствие сохранности гемоциркуляции в кишечной стенке скопления газов и жидкости в просвете кишки не происходит. При этом процессы всасывания, моррфологическая структура эпителиоцитов слизистой оболочки тонкой кишки и микроциркуляции в кишечной стенке не нарушены. При сохранении пареза нарушение абсорбции начинается с угнетения всасывания сначала газов, а затем воды, электролитов и мономеров основных питательных веществ. Происходит растяжение кишечных петель и скопление в просвете кишки больших объемов газа и жидкости. Морфологические исследования выявляют выраженные изменения со стороны эпителия ворсинок и сосудов микроциркуляции, что проявляется нарушением оттока из ворсин по венам и лимфатическим сосудам, что при сохранности артериального притока ведет к увеличению фильтрационной секреции в просвет кишечной трубки и нарушению всасывания. Данный процесс принято обозначать термином «внутрипросветная секвестрация жидкости». В дальнейшем прогрессирование нарушения моторной и эвакуаторной функции приводит к нарушению всасывания газов и дальнейшему повышению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что в свою очередь обуславливает дальнейшее растяжение кишечных петель и нарушение артериальной перфузии кишечной стенки.
При этом процессы всасывания, моррфологическая структура эпителиоцитов слизистой оболочки тонкой кишки и микроциркуляции в кишечной стенке не нарушены. При сохранении пареза нарушение абсорбции начинается с угнетения всасывания сначала газов, а затем воды, электролитов и мономеров основных питательных веществ. Происходит растяжение кишечных петель и скопление в просвете кишки больших объемов газа и жидкости. Морфологические исследования выявляют выраженные изменения со стороны эпителия ворсинок и сосудов микроциркуляции, что проявляется нарушением оттока из ворсин по венам и лимфатическим сосудам, что при сохранности артериального притока ведет к увеличению фильтрационной секреции в просвет кишечной трубки и нарушению всасывания. Данный процесс принято обозначать термином «внутрипросветная секвестрация жидкости». В дальнейшем прогрессирование нарушения моторной и эвакуаторной функции приводит к нарушению всасывания газов и дальнейшему повышению внутрикишечного давления. Когда величина последнего достигает уровня диастолического давления, прекращается всасывание жидкости, что в свою очередь обуславливает дальнейшее растяжение кишечных петель и нарушение артериальной перфузии кишечной стенки.
Возникновение ишемии пищеварительной трубки в послеоперационном периоде является закономерным следствием системной дисциркуляции и по мнению целого ряда авторов играет решающую роль в развитии синдрома энтеральной недостаточности. К основным причинам ишемизации стенки кишечника (вообще и в послеоперационном периоде — в частности) относят системное токсическое влияние медиаторов воспаления (цитокины, активированные нейтрофилы, свободные кислородные радикалы), нарушение микроциркуляции и периферического шунтирования крови (нарушение реологии, чрезмерный выброс цитокинов и вазоактивных веществ, активация эластиназы), системные нарушения кровоснабжения кишечника (централизация кровообращения, артериальная гипотония, снижение сердечного выброса), анатомические особенности кровоснабжения слизистой кишечника («феномен шпилькообразной петли и сепарации плазмы»), открытие артериоло-венулярных шунтов и выключение из кровообращения части микрососудистой сети, перивазальные изменения в виде отека тканей, лейкоцитарной инфильтрации и микрогеморрагий.
Очевидно, что перфузия кишечной стенки ухудшается по мере повышения внутриполостного кишечного давления. А.А. Курыгин и совт. (2007) указывают на то, что критическое давление в просвете кишки составляет 30 мм рт. ст. При повышении давления до 40-60 мм рт. ст. почти вся кровь минует интрамуральную капиллярную сеть и шунтируется в венозное русло. При этом нарушения регионарного кровообращения и микроциркуляции ведут к недостаточной доставке кислорода и энергетических субстратов к тканям стенки кишки, в результате чего развиваются вторичная тканевая гипоксия и глубокие нарушения метаболических процессов. Ишемия приводит к анаэробному метаболизму, ацидозу, исчерпанию энергетических запасов клетки и необратимым её изменениям. Снижается активность дыхательных ферментов клетки, уменьшается образование макроэргов. Активизируются распад тканевых липидов, катаболизм белков, дезаминирование и переаминирование аминокислот. Нарушение процесса окислительного фосфорилирования, который происходит в митохондриях, может приводить к переходу клетки на анаэробный метаболизм даже в присутствии кислорода. На сегодняшний день общепризнанной является точка зрения, согласно которой максимальное повреждающее действие на ткани оказывает не столько ишемия, сколько феномен реперфузии. В условиях восстановленного кровотока в присутствии кислорода фермент ксантиноксидаза преобразует гипоксантин в ураты и кислородные радикалы (О2‾, ОН+), запускающие процесс перекисного окисления тканей. Причем, это явление происходит не только при абсолютной, но и на фоне относительной гипероксии. Происходят активация перекисного окисления липидов, приводищее, в первую очередь, к повреждению клеточных мембран, состоящих из фосфолипидов. Перекисное окисление белков вызывает инактивацию ферментов; углеводов — деполимеризацию полисахаридов, составляющих основу межклеточного вещества. Кроме того, при реперфузии повреждающим механизмом является перемещение ионов кальция внутрь клетки. При этом разрушаются рибосомы с последующим нарушением синтеза белка и АТФ, развивается вазоспазм, активируется метаболизм арахидоновой кислоты, что приводит в результате к усилению расстройств микроциркуляции и нарушению проницаемости мембран.
На сегодняшний день общепризнанной является точка зрения, согласно которой максимальное повреждающее действие на ткани оказывает не столько ишемия, сколько феномен реперфузии. В условиях восстановленного кровотока в присутствии кислорода фермент ксантиноксидаза преобразует гипоксантин в ураты и кислородные радикалы (О2‾, ОН+), запускающие процесс перекисного окисления тканей. Причем, это явление происходит не только при абсолютной, но и на фоне относительной гипероксии. Происходят активация перекисного окисления липидов, приводищее, в первую очередь, к повреждению клеточных мембран, состоящих из фосфолипидов. Перекисное окисление белков вызывает инактивацию ферментов; углеводов — деполимеризацию полисахаридов, составляющих основу межклеточного вещества. Кроме того, при реперфузии повреждающим механизмом является перемещение ионов кальция внутрь клетки. При этом разрушаются рибосомы с последующим нарушением синтеза белка и АТФ, развивается вазоспазм, активируется метаболизм арахидоновой кислоты, что приводит в результате к усилению расстройств микроциркуляции и нарушению проницаемости мембран. По А.П. Зильберу (1995) возросшая в условиях ишемии осмолярность тканей (на 40—50 мосм) после восстановления кровотока способствует привлечению воды в чрезмерно большом количестве, что неизбежно приводит к развитию отека тканей.
По А.П. Зильберу (1995) возросшая в условиях ишемии осмолярность тканей (на 40—50 мосм) после восстановления кровотока способствует привлечению воды в чрезмерно большом количестве, что неизбежно приводит к развитию отека тканей.
Морфологическими проявлениями нарушения гемоперфузии кишечной стенки является разрушение микроворсинок щеточной каймы, гликокаликса и самой цитоплазматической мембраны с выходом в просвет кишки цитоплазматических органелл и включений, а также к расширение межклеточных контактов и разрыхлению самой плазмоллемы. При длительной гипоксии кишечной стенки выявляются некроз и слущивание энтероцитов в просвет кишки, в глубокие дистрофические изменения структуры миоцитов и клеток серозной оболочки. При этом возникает утрата эпителиальной целостности слизистой оболочки с формированием эрозий и язв.
Следствием гипоксии кишечной стенки и дистрофических изменений в ее мышечном слое является нарушение проводимости в интрамуральных нервных сплетениях и резкое снижение сократительной способности гладкомышечных клеток. Данная ситуация в еще большей степени усугубляет парез пищеварительной трубки и тем самым усиливает нарушение ее гемоперфузии, замыкая circulus vitiosus.
Данная ситуация в еще большей степени усугубляет парез пищеварительной трубки и тем самым усиливает нарушение ее гемоперфузии, замыкая circulus vitiosus.
Нарушение пассажа кишечного содержимого практически сразу же влечет за собой нарушение микробного пейзажа кишечника. При этом имеет место восходящая миграция толстокишечной микрофлоры и избыточная (от 10 4 до 10 12 КОЕ/мл) бактериальное обсеменение тонкой кишки, обозначаемая в литературе как синдром избыточной бактериальной колонизации. Гиперпролиферация условно-патогенных бактерий сопровождается усилением бродильных процессов и повышением газообразования, что определяет дальнейшее повышение внутрипросветного давления с растяжением кишечной стенки. Происходит избыточное образование высокотоксичных веществ: индола, скатола, кадаверина. Дополнительное повреждающее действие на кишечную стенку оказывают и образующиеся в процессе микробного метаболизма аммиак и сероводород. Вследствие гипоксии и нарушения кровообращения подавляется биосинтез муцина и эпителий слизистой повреждается ферментами. Прогрессирующие деструктивные процессы слизистой оболочки, а именно — разрушение слоя слизи и гликокаликса, щеточной каймы и самих энтероцитов, деструкция базальной мембраны и собственной пластинки слизистой, приводят к утрате кишечной трубкой барьерной функции и возникновению феномена бактериальной транслокации. Лимфоидная ткань пищеварительной трубки в норме предотвращает внедрение инфекционных агентов во внутреннюю среду организма. В экспериментах установлено, что при стимуляции моторики усиливается синтез IL-4 и IL-10 собственной оболочкой тонкого кишечника, что увеличивает продукцию IgA на поверхности слизистой и ингибирует внутриклеточную молекулу адгезии — 1 (ICAM-1) сосудистого эндотелия и последующие нейтрофил-ассоциированное воспаление и повреждение. При возникновении пареза кишечной трубки утрачивается антагонистическая активность эпителия по отношению к патогенным микроорганизмам. Усиленное их размножение и активное функционирование нарушают транспорт электролитов и усиливают секрецию в просвет кишки.
Прогрессирующие деструктивные процессы слизистой оболочки, а именно — разрушение слоя слизи и гликокаликса, щеточной каймы и самих энтероцитов, деструкция базальной мембраны и собственной пластинки слизистой, приводят к утрате кишечной трубкой барьерной функции и возникновению феномена бактериальной транслокации. Лимфоидная ткань пищеварительной трубки в норме предотвращает внедрение инфекционных агентов во внутреннюю среду организма. В экспериментах установлено, что при стимуляции моторики усиливается синтез IL-4 и IL-10 собственной оболочкой тонкого кишечника, что увеличивает продукцию IgA на поверхности слизистой и ингибирует внутриклеточную молекулу адгезии — 1 (ICAM-1) сосудистого эндотелия и последующие нейтрофил-ассоциированное воспаление и повреждение. При возникновении пареза кишечной трубки утрачивается антагонистическая активность эпителия по отношению к патогенным микроорганизмам. Усиленное их размножение и активное функционирование нарушают транспорт электролитов и усиливают секрецию в просвет кишки. Происходит адгезия микробов к кишечному эпителию с последующим внедрением в энтероциты, под базальную мембрану и собственную пластинку. При этом экзо- и эндотоксины микробных клеток, сами бактерии и токсичные продукты их метаболизма проникают в лимфатическое русло и кровоток, определяя резкое усугубление системной воспалительной реакции. Нарушение барьерной функции кишечника принято рассматривать как принципиально важное звено в патогенезе синдрома системного воспалительного ответа и полиорганной недостаточности, индуцированных воспалительными цитокинами. В настоящее время именно бактериальной транслокации придаётся ведущая роль в насыщении организма эндотоксином (с включением липополисахаридного комплекса), являющимся основным индуктором развития синдрома системного воспалительного ответа, абдоминального сепсиса и полиорганной недостаточности. Считается, что с интенсивностью бактериальной транслокации связаны характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции.
Происходит адгезия микробов к кишечному эпителию с последующим внедрением в энтероциты, под базальную мембрану и собственную пластинку. При этом экзо- и эндотоксины микробных клеток, сами бактерии и токсичные продукты их метаболизма проникают в лимфатическое русло и кровоток, определяя резкое усугубление системной воспалительной реакции. Нарушение барьерной функции кишечника принято рассматривать как принципиально важное звено в патогенезе синдрома системного воспалительного ответа и полиорганной недостаточности, индуцированных воспалительными цитокинами. В настоящее время именно бактериальной транслокации придаётся ведущая роль в насыщении организма эндотоксином (с включением липополисахаридного комплекса), являющимся основным индуктором развития синдрома системного воспалительного ответа, абдоминального сепсиса и полиорганной недостаточности. Считается, что с интенсивностью бактериальной транслокации связаны характер и выраженность эндогенной интоксикации, развитие и прогрессирование синдрома полиорганной дисфункции.
В результате сочетанного действия вышеуказанных факторов энтеральной недостаточности развиваются имеющие принципиальное значение в нарушении системного метаболизма нарушение полостного и пристеночного пищеварения и нарушение всасывания питательных веществ. Динамическое исследование амилолитической активности слизистой оболочки всех отделов тонкой кишки в ранние сроки после операций большого объема позволило выявить функциональные нарушения процессов полостного, пристеночного и внутриклеточного пищеварения и структурные изменения в стенке органа, обусловленные тяжелыми послеоперационными расстройствами микроциркуляции. При этом первоначально отмечается повышение ферментативной активности слизистой, что многие авторы склонны расценивать как компенсаторно-приспособительный механизм, обеспечивающий усиление переваривания поступающих в пищеварительный тракт нутриентов и всасывания мономеров в критических состояниях. А. М. Уголевым и соавт. (1995) в эксперименте было доказано, что имеет место отрицательная корреляция между повышением активности полостной фракции фермента и одновременным снижением активности фракций фермента щеточной каймы слизистой оболочки тонкой кишки, и наоборот..gif) У больных после резекции желудка увеличивается содержание энтерокиназы и щелочной фосфатазы в кишечном содержимом, а после гастрэктомии активность этих ферментов в тощей кишке в 6-8 раз превышает показатели у здоровых людей. Данные компенсаторные возможности ферментовыделительной функции тонкой кишки зависят от состояния питания организма. У истощенных субъектов с исходными нарушениями деятельности пищеварительной системы значительного увеличения активности ферментов не наступает. Согласно данным, полученным Л.О. Барской и соавт. (2013), уже через 6 часов после операции большого объема выявляется значительное повышение активности полостной фракции амилазы во всех отделах тонкой кишки на фоне явного снижения активности десорбируемых фракций щеточной каймы дистальных отделов органа. По мнению исследователей это следует расценивать как компенсаторно-приспособительную реакцию слизистой оболочки тонкой кишки в ответ на чрезмерное поступление панкреатического сока в полость двенадцатиперстной кишки, тем более что на данном сроке послеоперационного периода структурных изменений в стенке тонкой кишки выявлено не было.
У больных после резекции желудка увеличивается содержание энтерокиназы и щелочной фосфатазы в кишечном содержимом, а после гастрэктомии активность этих ферментов в тощей кишке в 6-8 раз превышает показатели у здоровых людей. Данные компенсаторные возможности ферментовыделительной функции тонкой кишки зависят от состояния питания организма. У истощенных субъектов с исходными нарушениями деятельности пищеварительной системы значительного увеличения активности ферментов не наступает. Согласно данным, полученным Л.О. Барской и соавт. (2013), уже через 6 часов после операции большого объема выявляется значительное повышение активности полостной фракции амилазы во всех отделах тонкой кишки на фоне явного снижения активности десорбируемых фракций щеточной каймы дистальных отделов органа. По мнению исследователей это следует расценивать как компенсаторно-приспособительную реакцию слизистой оболочки тонкой кишки в ответ на чрезмерное поступление панкреатического сока в полость двенадцатиперстной кишки, тем более что на данном сроке послеоперационного периода структурных изменений в стенке тонкой кишки выявлено не было. Однако к 12 часам послеоперационного периода в двенадцатиперстной кишке на фоне повышенной активности полостной амилазы выявляется значтельное повышение внутриклеточной фракции фермента, что свидетельствует о нарушении прочности связей фермента с мембраной энтероцитов и поступлении его в полость кишки, суммируя эффект нарастания активности поджелудочной фракции амилазы. Кроме этого, нарушаются процессы адсорбции в щеточной кайме, обусловленные ее гипоксическим, ишемическим и реперфузионным повреждением. Однако уже спустя сутки после операции на фоне высокой активности полостной амилазы возрастает активность всех фракций фермента тонкой и подвздошной кишок, а морфологические проявления нарушений микроциркуляции носят неравномерный характер и приходятся на зоны максимального скопления сосудов. Они выражаются деструктивными изменениями слизистой оболочки в местах максимальной плотности микрососудов и нарастанием отека периваскулярных образований собственной пластинки и подслизистого слоя тонкой кишки.
Однако к 12 часам послеоперационного периода в двенадцатиперстной кишке на фоне повышенной активности полостной амилазы выявляется значтельное повышение внутриклеточной фракции фермента, что свидетельствует о нарушении прочности связей фермента с мембраной энтероцитов и поступлении его в полость кишки, суммируя эффект нарастания активности поджелудочной фракции амилазы. Кроме этого, нарушаются процессы адсорбции в щеточной кайме, обусловленные ее гипоксическим, ишемическим и реперфузионным повреждением. Однако уже спустя сутки после операции на фоне высокой активности полостной амилазы возрастает активность всех фракций фермента тонкой и подвздошной кишок, а морфологические проявления нарушений микроциркуляции носят неравномерный характер и приходятся на зоны максимального скопления сосудов. Они выражаются деструктивными изменениями слизистой оболочки в местах максимальной плотности микрососудов и нарастанием отека периваскулярных образований собственной пластинки и подслизистого слоя тонкой кишки. Все эти структурные изменения отражаются и на функциональном состоянии щеточной каймы: вследствие резкого уменьшения площади пищеварения снижается адсорбционная способность и угнетаются процессы пристеночного гидролиза полисахаридов. В последующие сутки послеоперационного периода на фоне достаточно высокой активности панкреатической фракции амилазы прогрессирует повышение активности всех фракций щеточной каймы тонкой кишки, что свидетельствует о снижении адсорбционной способности и угнетении процессов пристеночного пищеварения. Данные функциональные изменения имеют структурную основу: в эти сроки наблюдаются деструктивные изменения всех отделов тонкой кишки, а именно поверхностные эрозии слизистой оболочки с отсутствием в них ворсин. К 7-м суткам отчетливо выражены процессы репаративной регенерации кишечных ворсин. Однако данный эпителий морфологически незрел, а значит, и неспособен выполнять свою специфическую пищеварительную функцию в условиях послеоперационного периода. А.А. Курыгин и совт.
Все эти структурные изменения отражаются и на функциональном состоянии щеточной каймы: вследствие резкого уменьшения площади пищеварения снижается адсорбционная способность и угнетаются процессы пристеночного гидролиза полисахаридов. В последующие сутки послеоперационного периода на фоне достаточно высокой активности панкреатической фракции амилазы прогрессирует повышение активности всех фракций щеточной каймы тонкой кишки, что свидетельствует о снижении адсорбционной способности и угнетении процессов пристеночного пищеварения. Данные функциональные изменения имеют структурную основу: в эти сроки наблюдаются деструктивные изменения всех отделов тонкой кишки, а именно поверхностные эрозии слизистой оболочки с отсутствием в них ворсин. К 7-м суткам отчетливо выражены процессы репаративной регенерации кишечных ворсин. Однако данный эпителий морфологически незрел, а значит, и неспособен выполнять свою специфическую пищеварительную функцию в условиях послеоперационного периода. А.А. Курыгин и совт. (2003) считают, что, благодаря компенсаторным процессам, максимальный уровень снижения амилолитической активности в первые дни после операций на проксимальном отделе пищеварительной трубки не превышает 50 %. В течение 10 сут после операции полного восстановления функций энтероцитов проксимального отдела тощей кишки не происходит, однако уровень амилолитической активности позволяет проводить энтеральное зондовое питание не только моно- и олигосахаридами, но и полисахаридами.
(2003) считают, что, благодаря компенсаторным процессам, максимальный уровень снижения амилолитической активности в первые дни после операций на проксимальном отделе пищеварительной трубки не превышает 50 %. В течение 10 сут после операции полного восстановления функций энтероцитов проксимального отдела тощей кишки не происходит, однако уровень амилолитической активности позволяет проводить энтеральное зондовое питание не только моно- и олигосахаридами, но и полисахаридами.
В раннем послеоперационном периоде происходят выраженные изменения условий функционирования гидролитического механизма тонкой кишки во всех его основных звеньях — синтез кишечных ферментов, транслокация, встраивание в апикальную мембрану энтероцитов, а также адсорбция ферментов (преимущественно панкреатических) из полости кишечной трубки. Недостаточное образование ферментов, расщепляющих белки, транспортных переносчиков конечных продуктов пищеварения через кишечную стенку приводит к дефициту аминокислот и белковому голоданию организма. Дефекты процесса гидролиза, расстройство всасывания и утилизации углеводов обусловливают дефицит моно- и дисахаридов. Нарушение процессов расщепления и всасывания липидов усиливает стеаторею. Патология слизистой оболочки наряду с дисбактериозом кишечника, пониженной секрецией панкреатической липазы и нарушением эмульгирования жиров желчными кислотами ведут к недостаточному всасыванию жиров. Расстройство всасывания жира возникает и при избыточном поступлении солей кальция и магния. На дефицит водо- и жирорастворимых витаминов, железа, микроэлементов, связанный с изменением всасывания этих веществ обращают внимание многие исследователи.
Дефекты процесса гидролиза, расстройство всасывания и утилизации углеводов обусловливают дефицит моно- и дисахаридов. Нарушение процессов расщепления и всасывания липидов усиливает стеаторею. Патология слизистой оболочки наряду с дисбактериозом кишечника, пониженной секрецией панкреатической липазы и нарушением эмульгирования жиров желчными кислотами ведут к недостаточному всасыванию жиров. Расстройство всасывания жира возникает и при избыточном поступлении солей кальция и магния. На дефицит водо- и жирорастворимых витаминов, железа, микроэлементов, связанный с изменением всасывания этих веществ обращают внимание многие исследователи.
Большинство современных исследователей, рассматривая проблему послеоперационной мальдигестии, акцентируют внимание на высокой чувствительности самой тонкой кишки к белково-энергетической недостаточности питания, связанной с ежедневными специфическими потерями питательных веществ из-за необходимости перманентного обновления кишечного эпителия (период полного обновления составляет в среднем 2-3 дня). Известно, что тонкая кишка получает питание не только из системы кровообращения, но и непосредственно из собственного просвета не менее чем на 50%, а толстая — не менее чем на 70%. Энтероциты страдают без поступления важнейших веществ, содержащихся обычно в химусе, при сбалансированной диете, включающей основные нутриенты, а также витамины, витаминоподобные вещества, микроэлементы и антиоксиданты. При отсутствии поступления и расщепления пищевых субстанций в прсвете кишечной трубки формируется еще один порочный круг. Патологический процесс в тонкой кишке при недостаточном поступлении нутриентов в энтероциты характеризуется истончением слизистой оболочки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением верхних отделов тонкой кишки бактериями, что приводит к еще более выраженным трофическим нарушениям в самой слизистой. Клинические наблюдения свидетельствуют о том, что при длительном парентеральном питании возникает выраженная атрофия секреторных желез слизистой, появляется прогрессирующая ферментная недостаточность, нарушается экскреция желчи.
Известно, что тонкая кишка получает питание не только из системы кровообращения, но и непосредственно из собственного просвета не менее чем на 50%, а толстая — не менее чем на 70%. Энтероциты страдают без поступления важнейших веществ, содержащихся обычно в химусе, при сбалансированной диете, включающей основные нутриенты, а также витамины, витаминоподобные вещества, микроэлементы и антиоксиданты. При отсутствии поступления и расщепления пищевых субстанций в прсвете кишечной трубки формируется еще один порочный круг. Патологический процесс в тонкой кишке при недостаточном поступлении нутриентов в энтероциты характеризуется истончением слизистой оболочки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением верхних отделов тонкой кишки бактериями, что приводит к еще более выраженным трофическим нарушениям в самой слизистой. Клинические наблюдения свидетельствуют о том, что при длительном парентеральном питании возникает выраженная атрофия секреторных желез слизистой, появляется прогрессирующая ферментная недостаточность, нарушается экскреция желчи. При этом помимо слизистой оболочки страдает ассоциированная с кишечником лимфоидная ткань, нарушается биоценоз и усиливается бактериальная транслокация.
При этом помимо слизистой оболочки страдает ассоциированная с кишечником лимфоидная ткань, нарушается биоценоз и усиливается бактериальная транслокация.
Параллельно в патогенез синдрома энтеральной недостаточности включается угнетение резорбции жидкости из просвета кишки, полностью прекращающаяся при повышении внутрикишечного давления примерно до уровня диастолического давления крови. В просвет кишки поступают значительные объемы жидкости. Помимо транссудации, большую роль играет усиленная, так называемая «паралитическая», секреция кишечных желез. В гастродуоденальной зоне она возрастает до 120 мл/час (норма 30-35 мл/час), в тонкой кишке – до 65 мл/час (норма 1,5 мл/час). Вместе с жидкостью в просвет кишки поступает значительное количество электролитов и белка, прежде всего калия и альбуминов из-за относительно небольшого размера их молекул. Принято считать, что снижение абсорбционной способности кишечной трубки связано с цитоплазматической перегрузкой кальцием и истощение запасов АТФ в эпителиоцитах, со сниженной активностью ферментов щеточной каймы, с уменьшением всасывательной поверхности эпителия, а также с гипоальбуминемией. Введение в просвет кишки легкоусваиваемых питательных веществ (олиго- и мономеров) сохраняет запасы АТФ в энтероцитах, защищает от повреждения слизистую и улучшает ее абсорбирующую способность. С другой стороны вследствие повреждения структуры слизистой оболочки тонкой кишки изменяется ее пассивная проницаемость, благодаря чему крупные макромолекулы могут проникать в субэпителиальные ткани, повышается вероятность функционального повреждения межклеточных связей.
Введение в просвет кишки легкоусваиваемых питательных веществ (олиго- и мономеров) сохраняет запасы АТФ в энтероцитах, защищает от повреждения слизистую и улучшает ее абсорбирующую способность. С другой стороны вследствие повреждения структуры слизистой оболочки тонкой кишки изменяется ее пассивная проницаемость, благодаря чему крупные макромолекулы могут проникать в субэпителиальные ткани, повышается вероятность функционального повреждения межклеточных связей.
Во многом нарушение пищеварения при синдроме энтеральной недостаточности связаны с избыточной бактериальной колонизацией тонкой кишки. При этом бактериальная флора действует как конкурент макроорганизма в метаболизации пищевых субстратов и секрета кишки, нарушая таким образом процессы полостного пищеварения и переваривания пищевых веществ. Кроме того, имеются данные о поражении микробами щеточной каймы и гликокаликса энтероцитов, в результате чего нарушаются процессы мембранного пищеварения и всасывания. Посредством гидролитических ферментов кишечных бактерий происходит замена собственного пищеварения симбионтным и интенсивное образование биологически активных среднемолекулярных пептидов. В свою очередь низкомолекулярные фракции этих соединений, поступая через нарушенный кишечный барьер в кровь и лимфу, оказывают системный провоспалительный эффект и локальное воздействие, провоцируя вазодилатацию и повышение проницаемости капиллярной стенки. Таким образом избыточная бактериальная колонизация значительно усугубляет и без того имеющиеся нарушения полостного пищеварения, переваривания в слоях слизи, мембранного пищеварения и всасывания, которые в свою очередь способствуют прогрессированию гиперпролиферации бактериальной флоры. Следует отметить, что помимо нарушения пищеварительной функции избыточная бактериальная колонизация имеет отношение и к нарушению процесса абсорбции питательных веществ. Нарушение всасывания белков при гиперколонизации возникает вследствие собственно утилизации пищевых белков бактериями, вызванных микробной инвазией функциональных расстройств слизистой оболочки со значительным уменьшением всасывания аминокислот, а также вследствие потери белков при усиленной транссудации.
В свою очередь низкомолекулярные фракции этих соединений, поступая через нарушенный кишечный барьер в кровь и лимфу, оказывают системный провоспалительный эффект и локальное воздействие, провоцируя вазодилатацию и повышение проницаемости капиллярной стенки. Таким образом избыточная бактериальная колонизация значительно усугубляет и без того имеющиеся нарушения полостного пищеварения, переваривания в слоях слизи, мембранного пищеварения и всасывания, которые в свою очередь способствуют прогрессированию гиперпролиферации бактериальной флоры. Следует отметить, что помимо нарушения пищеварительной функции избыточная бактериальная колонизация имеет отношение и к нарушению процесса абсорбции питательных веществ. Нарушение всасывания белков при гиперколонизации возникает вследствие собственно утилизации пищевых белков бактериями, вызванных микробной инвазией функциональных расстройств слизистой оболочки со значительным уменьшением всасывания аминокислот, а также вследствие потери белков при усиленной транссудации. Мальабсорбция углеводов при этом также относится к многофакторным процессам, включающим внутриполостной бактериальный катаболизм и нарушение всасывания. Доказано, что некоторые виды бактерий, особенно В. fragilis, С. perfringens и S.faecalis, содержат протеазы, способные удалять мальтазу из щеточной каймы, а некоторые виды бактероидов образуют протеазы, разрушающие дисахаридазы щеточной каймы энтероцитов человека. Наиболее частым проявлением избыточной бактериальной колонизации тонкой кишки является мальабсорбция жиров, которая клинически проявляется стеатореей, когда с фекалиями выделяется больше жиров, чем поступает с пищей. При наличии способных к деконъюгации бактерий концентрация связанных желчных солей снижается, что собственно и приводит к недостаточному образованию мицелл, мальабсорбции жиров и стеаторее. Нарушение метаболизма жирных кислот в свою очередь определяет нарушение всасывания жирорастворимых витаминов A, D, Е, К.
Мальабсорбция углеводов при этом также относится к многофакторным процессам, включающим внутриполостной бактериальный катаболизм и нарушение всасывания. Доказано, что некоторые виды бактерий, особенно В. fragilis, С. perfringens и S.faecalis, содержат протеазы, способные удалять мальтазу из щеточной каймы, а некоторые виды бактероидов образуют протеазы, разрушающие дисахаридазы щеточной каймы энтероцитов человека. Наиболее частым проявлением избыточной бактериальной колонизации тонкой кишки является мальабсорбция жиров, которая клинически проявляется стеатореей, когда с фекалиями выделяется больше жиров, чем поступает с пищей. При наличии способных к деконъюгации бактерий концентрация связанных желчных солей снижается, что собственно и приводит к недостаточному образованию мицелл, мальабсорбции жиров и стеаторее. Нарушение метаболизма жирных кислот в свою очередь определяет нарушение всасывания жирорастворимых витаминов A, D, Е, К.
Очевидно, что в наибольшей степени выраженные нарушения пищеварения отмечаются у пациентов после операций на структурах пищеварительного тракта. Из курса нормальной физиологии нам известно, что кишечное переваривание и всасывание белков, углеводов, жиров и других нутриентов начинается в двенадцатиперстной кишке и почти заканчивается в пределах первых 120–150 см тощей кишки. Тонкая кишка получает дополнительно 6–8 л жидкости ежедневно, 80% которой всасывается в дистальной части подвздошной кишки. Подвздошная кишка является единственным местом всасывания витамина В12 и солей желчных кислот. Только от 1,5 до 2 л жидкости входит в толстую кишку, где все, за исключением 150 мл, реабсорбируется. Данные факты объясняют возникновение умеренной диареи после обширной резекции тощей кишки. И напротив, полная резекция подвздошной кишки приводит к большим расстройствам всасывания, и диарея зависит не от повышенного объема жидкости, входящей в толстую кишку, а и от солей желчных кислот и невсосавшихся жирных кислот, достигающих толстой кишки и вызывающих диарею и стеаторею со значительной потерей жирорастворимых витаминов. Сохранение толстой кишки способствует ферментации растворимых пищевых волокон до короткоцепочечных жирных кислот, таким образом повышая всасывание энергетических субстратов на 5%.
Из курса нормальной физиологии нам известно, что кишечное переваривание и всасывание белков, углеводов, жиров и других нутриентов начинается в двенадцатиперстной кишке и почти заканчивается в пределах первых 120–150 см тощей кишки. Тонкая кишка получает дополнительно 6–8 л жидкости ежедневно, 80% которой всасывается в дистальной части подвздошной кишки. Подвздошная кишка является единственным местом всасывания витамина В12 и солей желчных кислот. Только от 1,5 до 2 л жидкости входит в толстую кишку, где все, за исключением 150 мл, реабсорбируется. Данные факты объясняют возникновение умеренной диареи после обширной резекции тощей кишки. И напротив, полная резекция подвздошной кишки приводит к большим расстройствам всасывания, и диарея зависит не от повышенного объема жидкости, входящей в толстую кишку, а и от солей желчных кислот и невсосавшихся жирных кислот, достигающих толстой кишки и вызывающих диарею и стеаторею со значительной потерей жирорастворимых витаминов. Сохранение толстой кишки способствует ферментации растворимых пищевых волокон до короткоцепочечных жирных кислот, таким образом повышая всасывание энергетических субстратов на 5%.
После обширной резекции тонкой кишки возникает значительный дефицит всасывающей поверхности, снижается стимуляция функций поджелудочной железы секретином и холецистокинином, синтез которых в оставшейся после резекции кишке снижается. При резекции дистальных отделов подвздошной кишки с удалением или выключением илеоцекальной области бактериальная флора из толстой кишки легко проникает в тонкую, в результате чего может развиться синдром избыточной бактериальной колонизации тонкой кишки со свойственным ему синдромом мальабсорбции и мальдигестии. Развитию энтеральной недостаточности после резекции тонкой кишки способствует ускорение транзита химуса по укороченной кишке, как было сказано выше, наиболее выраженное после резекции подвздошной кишки.
По данным А.А. Курыгина и соавт. (2003) абсолютной зависимости между тяжестью синдрома мальабсорбции и объемом резекции тонкой кишки нет, если удаляется менее половины ее длины. Состояние пищеварения после операции зависит от многих факторов. Основными из них являются: протяженность и локализация резекции, сохранение илеоцекального отдела кишечника, вариант межкишечного анастомоза (тонко-тонкокишечный или тонко-толстокишечный), морфологическое и функциональное состояния слизистой оболочки тонкой кишки до операции, состояние желудка, печени и поджелудочной железы. Резекция 40 % тонкой кишки хорошо переносится больными при условии сохранения двенадцатиперстной кишки, дистальной половины подвздошной и илеоцекального сфинктера. Резекция дистальных отделов подвздошной кишки с илеоцекальной областью может вызвать выраженную диарею и мальабсорбцию, если удалено даже менее 25 % тонкой кишки. Резекция более 50 % тонкой кишки приводит к выраженной энтеральной недостаточности, а 70 % и более — к катастрофическим последствиям.
Основными из них являются: протяженность и локализация резекции, сохранение илеоцекального отдела кишечника, вариант межкишечного анастомоза (тонко-тонкокишечный или тонко-толстокишечный), морфологическое и функциональное состояния слизистой оболочки тонкой кишки до операции, состояние желудка, печени и поджелудочной железы. Резекция 40 % тонкой кишки хорошо переносится больными при условии сохранения двенадцатиперстной кишки, дистальной половины подвздошной и илеоцекального сфинктера. Резекция дистальных отделов подвздошной кишки с илеоцекальной областью может вызвать выраженную диарею и мальабсорбцию, если удалено даже менее 25 % тонкой кишки. Резекция более 50 % тонкой кишки приводит к выраженной энтеральной недостаточности, а 70 % и более — к катастрофическим последствиям.
Безусловно, на функционирование пищеварительного тракта влияют резекция его анатомических образований и те или иные варианты реконструкции пищеварительной трубки. Так M. Chang et al. (2013), анализируя изменения функционирования пищеварительного тракта после гастропанкреатодуоденальной резеции, отметил, что дуоденэктомия не только разрушает согласованную работу мигрирующего моторного комплекса желудка и кишечника, но и нарушает взаимосвязь пищеварительной моторики и панкреатической секреции, циклические колебания уровня гастроинтестинальных гормонов в плазме крови в межпищеварительном периоде. С другой стороны А.А. Курыгин и соавт. (2003) на основании анализа функциональных результатов операций на гастродуоденальной зоне пришли к выводу о том, что действительно как в ранние, так и в отдаленные сроки после резекции желудка всегда имеются те или иные функциональные расстройства тонкой кишки. Эти изменения у разных больных могут касаться различных функций (в первую очередь тех, нарушения которых уже имелись до операции), могут быть выражены в различной степени (нередко на субклиническом уровне), но в большинстве случаев не вызывают значительных диспепсических расстройств благодаря компенсаторным механизмам органов пищеварительной системы.
С другой стороны А.А. Курыгин и соавт. (2003) на основании анализа функциональных результатов операций на гастродуоденальной зоне пришли к выводу о том, что действительно как в ранние, так и в отдаленные сроки после резекции желудка всегда имеются те или иные функциональные расстройства тонкой кишки. Эти изменения у разных больных могут касаться различных функций (в первую очередь тех, нарушения которых уже имелись до операции), могут быть выражены в различной степени (нередко на субклиническом уровне), но в большинстве случаев не вызывают значительных диспепсических расстройств благодаря компенсаторным механизмам органов пищеварительной системы.
Таким образом послеоперационные нарушения функции пищеварительного тракта, являясь закономерным следствием нейро-гуморальных составляющих системного ответа на операционную травму, с одной стороны определяют возникновение дефицита экзогенных питательных субстанций, что в свою очередь, усугубляет процессы катаболизма с расходованием эндогенных источников энергии и пластического материала, а с другой стороны — возникновением бактериальной транслокации, продукцией цитокинов и эйкозаноидов способствуют прогрессированию системной воспалительной реакции.
Статья добавлена 27 января 2016 г.
Операции на кишечнике — Закофальк
Для чего делаются операции на кишечнике?
Операция на кишечнике является распространенной хирургической процедурой. Количество таких операций ежегодно в России составляет 500 000.
В большинстве случаев операция направлена на радикальное излечение заболевания – например, удаление злокачественной опухоли, либо помогает существенно облегчить состояние человека в некоторых случаях.
После операции необходим длительный и сложный восстановительный период, который зависит от тяжести (удалена вся толстая кишка – тотальная колэктомия или ее часть – резекция кишечника), способа операции и состояния самого пациента.
Какие процессы происходят с толстым кишечником после операции?
Удаление части толстого кишечника, предоперационная подготовка (очистка кишечника) и операционная травма, назначение антибиотиков приводят к нарушению процессов пищеварения в кишечнике и послеоперационному дисбиозу.
Поскольку в толстой кишке происходит реабсорбция (всасывание) воды, что, в зависимости от удалённого отрезка толстой кишки, может нарушаться процесс формирования стула. Это приводит к более или менее сильной диарее. Также нарушается моторная функция кишечника, что может приводить к запорам, вздутию живота.
Также возникают послеоперационный дисбиоз микрофлоры кишечника, преходящие нарушения трофики, воспалительные изменения, снижается барьерная функция слизистой оболочки кишечника, вызванные операционной травмой, стрессом, а также действием лекарственных препаратов, в первую очередь антибиотиков (о влиянии антибиотиков на микрофлору и слизистую кишечника можно подробно ознакомиться в разделе – прием антибиотиков).
Наиболее выражены эти процессы у пожилых, пациентов с сопутствующими заболеваниями (сахарным диабетом, атеросклерозом), больных, перенесших предоперационную химио или лучевую терапию.
Применение масляной кислоты после операций на кишечнике
Применение Закофалька для восстановления слизистой кишечника и нормализации микрофлоры и функции кишечника обосновано основными эффектами масляной кислоты в отношении слизистой оболочки толстой кишки:
1. Антиатрофическое действие — восстановление трофики слизистой оболочки толстой кишки.
Антиатрофическое действие — восстановление трофики слизистой оболочки толстой кишки.
2. Противовоспалительное действие. Восстановление барьерных функций толстой кишки.
3. Регуляция процессов нормального созревания и развития клеток слизистой толстой кишки.
4. Антидиарейное действие – регуляция водно-электролитного баланса в толстой кишке.
5. Пребиотическое действие – создание благоприятной среды для роста собственной полезной микрофлоры.
В исследовании, проведенном в клинике госпитальной хирургии им. В.А. Оппеля, СЗГМУ им.И.И.Мечникова было показано, что включение Закофалька в схему ведения больных после операций на толстой кишке, приводило к более раннему восстановлению перистальтики кишечника, субъективное уменьшение боли и улучшение общего самочувствия.
У пациентов, перенесших операции на толстой кишке (резекция кишечника, эндоскопическое удаление полипов), в составе комплексной терапии в послеоперационном периоде, Закофальк применяется по 1 т 3-4 раза в день, минимальный курс 1 месяц, возможна поддерживающая терапия 1 т 2 раза в день длительно.
Нутриционная поддержка после обширных резекций кишечника: новые подходы uMEDp
Авторы представили собственную классификацию типов клинико-нутриционных (метаболических) нарушений, возникающих вследствие обширных резекций кишечника, в зависимости от уровня и объема оперативного вмешательства. Обоснована необходимость применения стимуляторов микробиоты и заместительной коррекции желчных кислот в рамках нутриционной поддержки у пациентов с постколэктомическим синдромом. Показано, что даже в отдаленном периоде (свыше 5 лет после операции) введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и препарата урсодезоксихолевой кислоты (Урсосан) способствует более быстрому восстановлению нутриционного статуса по сравнению с традиционной нутриционной метаболической коррекцией.
Таблица 1. Классификация вариантов обширных резекций кишечника
Таблица 2. Эффективность нутриционной коррекции после обширных резекций кишечника в отдаленном периоде у больных с метаболическими нарушениями типа F
Эффективность нутриционной коррекции после обширных резекций кишечника в отдаленном периоде у больных с метаболическими нарушениями типа F
 Нами предложена классификация [8–10] типов метаболических нарушений, возникающих вследствие обширных резекций кишечника различного объема и уровня (табл. 1). Выделенные типы описаны на основе анализа данных 675 больных в течение двадцатилетнего периода наблюдений.
При этом типе метаболических нарушений отмечается относительно удовлетворительное качество жизни: клинические проявления либо отсутствуют вовсе, либо выражены незначительно – эпизодическая неустойчивость стула, непереносимость некоторых продуктов; в отдаленном периоде более 5 лет после операции у таких больных чаще отмечаются холецистолитиаз, оксалатные почечные камни. Адаптивные процессы в кишечнике весьма активны, окончательно формируются примерно через полгода-год после операции и характеризуются как минимум гиперплазией клеток ворсинок, увеличением глубины крипт (что повышает площадь поверхности слизистой оболочки), повышением ферментативной активности в зоне пристеночного пищеварения, увеличением синтеза гормонов кишечника и панкреатодуоденальной зоны.
Нами предложена классификация [8–10] типов метаболических нарушений, возникающих вследствие обширных резекций кишечника различного объема и уровня (табл. 1). Выделенные типы описаны на основе анализа данных 675 больных в течение двадцатилетнего периода наблюдений.
При этом типе метаболических нарушений отмечается относительно удовлетворительное качество жизни: клинические проявления либо отсутствуют вовсе, либо выражены незначительно – эпизодическая неустойчивость стула, непереносимость некоторых продуктов; в отдаленном периоде более 5 лет после операции у таких больных чаще отмечаются холецистолитиаз, оксалатные почечные камни. Адаптивные процессы в кишечнике весьма активны, окончательно формируются примерно через полгода-год после операции и характеризуются как минимум гиперплазией клеток ворсинок, увеличением глубины крипт (что повышает площадь поверхности слизистой оболочки), повышением ферментативной активности в зоне пристеночного пищеварения, увеличением синтеза гормонов кишечника и панкреатодуоденальной зоны. Биохимические параметры близки к норме. Дефицит массы тела отсутствует. Потребности в белковом и энергетическом компонентах соответствуют наблюдаемым в здоровом организме. Адаптация полная, прогноз благоприятный [11–13].
Обширная резекция тощей кишки – основного абсорбционного насосного участка – сопровождается нарушением всасывания. Типично наличие слабовыраженной или умеренной диареи. При резекции тощей кишки в большей степени, чем при удалении других участков тонкой кишки, развивается гиперсекреция соляной кислоты [14]. В основе этого нарушения лежит следующий механизм: прекращается синтез ингибиторных гормонов (гастральный ингибирующий пептид, вазоактивный интестинальный пептид), из-за чего повышается уровень гастрина и стимулируется синтез соляной кислоты. Повышенная нагрузка соляной кислотой усугубляет диарею, так как инактивируются панкреатическая липаза и конъюгация солей желчных кислот в кишке. Отмечаются дисгидрические нарушения, как правило, 1–2-й степени тяжести при волемических изменениях в виде нормоцитемической гиповолемии, незначительно повышенном гематокритном показателе, дефиците циркулирующих белка, натрия, кальция, магния, цинка.
Биохимические параметры близки к норме. Дефицит массы тела отсутствует. Потребности в белковом и энергетическом компонентах соответствуют наблюдаемым в здоровом организме. Адаптация полная, прогноз благоприятный [11–13].
Обширная резекция тощей кишки – основного абсорбционного насосного участка – сопровождается нарушением всасывания. Типично наличие слабовыраженной или умеренной диареи. При резекции тощей кишки в большей степени, чем при удалении других участков тонкой кишки, развивается гиперсекреция соляной кислоты [14]. В основе этого нарушения лежит следующий механизм: прекращается синтез ингибиторных гормонов (гастральный ингибирующий пептид, вазоактивный интестинальный пептид), из-за чего повышается уровень гастрина и стимулируется синтез соляной кислоты. Повышенная нагрузка соляной кислотой усугубляет диарею, так как инактивируются панкреатическая липаза и конъюгация солей желчных кислот в кишке. Отмечаются дисгидрические нарушения, как правило, 1–2-й степени тяжести при волемических изменениях в виде нормоцитемической гиповолемии, незначительно повышенном гематокритном показателе, дефиците циркулирующих белка, натрия, кальция, магния, цинка. Дефицит массы тела либо отсутствует, либо соответствует трофологической недостаточности (гипотрофии) 1–2-й степени. В течение 1–1,5 лет изменяется компонентный состав тела: сначала происходит уменьшение жировой массы тела (до 9–10% содержания жира в организме) и потеря соматических и висцеральных белков, что соответствует легкой или средней степени недостаточности питания, затем компонентный состав тела стабилизируется. Адаптивные процессы, направленные главным образом на купирование синдрома кишечной недостаточности, аналогичны развивающимся при типе А, однако достигают максимальных величин значительно позднее (через 1 год – 1,5–2 года). Для подтипа B1 характерна частичная адаптация функций пищеварительного канала. В качестве приспособительной реакции практически вдвое увеличивается синтез гормонов кишечника и панкреатодуоденальной зоны. На ранних этапах диарея практически полностью купируется при приеме соответствующих препаратов, в последующем лечится диетой с совместным назначением медикаментов, обеспечивающих потенцирование нутритивной коррекции (фармаконутрицевтиков), препаратов анаболического действия и корректоров волемических и электролитных нарушений, витаминов.
Дефицит массы тела либо отсутствует, либо соответствует трофологической недостаточности (гипотрофии) 1–2-й степени. В течение 1–1,5 лет изменяется компонентный состав тела: сначала происходит уменьшение жировой массы тела (до 9–10% содержания жира в организме) и потеря соматических и висцеральных белков, что соответствует легкой или средней степени недостаточности питания, затем компонентный состав тела стабилизируется. Адаптивные процессы, направленные главным образом на купирование синдрома кишечной недостаточности, аналогичны развивающимся при типе А, однако достигают максимальных величин значительно позднее (через 1 год – 1,5–2 года). Для подтипа B1 характерна частичная адаптация функций пищеварительного канала. В качестве приспособительной реакции практически вдвое увеличивается синтез гормонов кишечника и панкреатодуоденальной зоны. На ранних этапах диарея практически полностью купируется при приеме соответствующих препаратов, в последующем лечится диетой с совместным назначением медикаментов, обеспечивающих потенцирование нутритивной коррекции (фармаконутрицевтиков), препаратов анаболического действия и корректоров волемических и электролитных нарушений, витаминов. Иногда диагностируются неярко выраженные явления дисбиоза (вздутие живота, повышение уровня короткоцепочечных жирных кислот (КЦЖК) в копрофильтрате и проч.). Подтип В2, подтип В1 + В2 Полная резекция подвздошной кишки приводит к серьезным расстройствам всасывания. Причиной диареи служат потери солей желчных кислот (холагенная диарея) и невсосавшиеся жирные кислоты (при подтипе В2). Отмечается пониженная концентрация желчных солей в желчи, что учащает встречаемость (образование) желчных камней. Выявляется снижение секреции холецистокинина, вследствие чего регистрируется гипокинезия желчного пузыря (в свою очередь способствующая застою желчи и камнеобразованию). При подтипе В1 + В2 развитию диареи также способствует механизм гиперсекреции соляной кислоты. Дисгидрические нарушения в основном имеют смешанный генез. Их выраженность зависит от длины культи. При длине 50–200 см культя адаптируемая, однако сроки адаптации зависят от объема удаляемой части, функционального резерва оставшегося отрезка и характера заболевания (при онкопатологии и рецидивах воспалительных заболеваний кишечника неизвестной этиологии функциональный резерв значительно снижен).
Иногда диагностируются неярко выраженные явления дисбиоза (вздутие живота, повышение уровня короткоцепочечных жирных кислот (КЦЖК) в копрофильтрате и проч.). Подтип В2, подтип В1 + В2 Полная резекция подвздошной кишки приводит к серьезным расстройствам всасывания. Причиной диареи служат потери солей желчных кислот (холагенная диарея) и невсосавшиеся жирные кислоты (при подтипе В2). Отмечается пониженная концентрация желчных солей в желчи, что учащает встречаемость (образование) желчных камней. Выявляется снижение секреции холецистокинина, вследствие чего регистрируется гипокинезия желчного пузыря (в свою очередь способствующая застою желчи и камнеобразованию). При подтипе В1 + В2 развитию диареи также способствует механизм гиперсекреции соляной кислоты. Дисгидрические нарушения в основном имеют смешанный генез. Их выраженность зависит от длины культи. При длине 50–200 см культя адаптируемая, однако сроки адаптации зависят от объема удаляемой части, функционального резерва оставшегося отрезка и характера заболевания (при онкопатологии и рецидивах воспалительных заболеваний кишечника неизвестной этиологии функциональный резерв значительно снижен). Дисгидрические нарушения могут быть достаточно тяжелыми, сопровождаться развитием отечного синдрома; волемические изменения могут достигать степени гипоцитемической гиповолемии. Возможно наличие признаков В12-дефицитной и железодефицитной анемии (вследствие снижения всасывания железа). Может отмечаться дефицит циркулирующих белков, магния, натрия, калия, железа. Регистрируется дискинезия желчного пузыря, наблюдаются колебания показателей холестерина и трансаминаз (аспартатаминотрансфераза и аланинаминотрансфераза), снижается уровень креатинина плазмы, возможно появление белка в моче, уробилиногена. Иногда диагностируются явления неярко выраженного дисбиоза (вздутие живота, изменения уровней КЦЖК в копрофильтрате и проч.). Дефицит массы тела, как правило, соответствует трофологической недостаточности (гипотрофии) 3-й степени. Изменение компонентного состава тела происходит в течение 1–1,5 лет и характеризуется как понижением жировой массы тела (6–8% содержания жира в организме), так и потерей соматических и висцеральных белков, что в большинстве случаев соответствует средней или тяжелой, но корригируемой степени недостаточности питания.
Дисгидрические нарушения могут быть достаточно тяжелыми, сопровождаться развитием отечного синдрома; волемические изменения могут достигать степени гипоцитемической гиповолемии. Возможно наличие признаков В12-дефицитной и железодефицитной анемии (вследствие снижения всасывания железа). Может отмечаться дефицит циркулирующих белков, магния, натрия, калия, железа. Регистрируется дискинезия желчного пузыря, наблюдаются колебания показателей холестерина и трансаминаз (аспартатаминотрансфераза и аланинаминотрансфераза), снижается уровень креатинина плазмы, возможно появление белка в моче, уробилиногена. Иногда диагностируются явления неярко выраженного дисбиоза (вздутие живота, изменения уровней КЦЖК в копрофильтрате и проч.). Дефицит массы тела, как правило, соответствует трофологической недостаточности (гипотрофии) 3-й степени. Изменение компонентного состава тела происходит в течение 1–1,5 лет и характеризуется как понижением жировой массы тела (6–8% содержания жира в организме), так и потерей соматических и висцеральных белков, что в большинстве случаев соответствует средней или тяжелой, но корригируемой степени недостаточности питания. Потребности в белковом компоненте и энергии повышены примерно в 1,5 раза. Адаптивные процессы направлены на купирование синдрома кишечной недостаточности и гепаторенальной дисфункции. Прогноз сомнительный.
Больные, перенесшие субтотальную резекцию тонкой кишки, относятся к наиболее тяжелой группе пациентов – 9–12 баллов согласно модифицированной системе оценки здоровья пациента (тяжести заболевания) АРАСНЕ-II (Acute physiological and chronic health evaluation – Оценка острых и хронических изменений состояния здоровья). При типе C отмечаются все наблюдаемые при подтипе В1 + В2 симптомы в наиболее выраженном виде. Из особенностей следует выделить выраженную слабость, дефицит массы тела 4-й степени, выраженную гипокалиемию (на уровне жизнеугрожающих величин), дефицит кальция, хлоридов, магния, цинка, микроэлементов, витаминов. Отмечается гипопротеинемия, гипоальбуминемия. Функциональный резерв кишечника отсутствует, печени и почек снижен. Происходит нарушение энтерогепатической циркуляции и, по-видимому, механизмов обратной регуляторной связи.
Потребности в белковом компоненте и энергии повышены примерно в 1,5 раза. Адаптивные процессы направлены на купирование синдрома кишечной недостаточности и гепаторенальной дисфункции. Прогноз сомнительный.
Больные, перенесшие субтотальную резекцию тонкой кишки, относятся к наиболее тяжелой группе пациентов – 9–12 баллов согласно модифицированной системе оценки здоровья пациента (тяжести заболевания) АРАСНЕ-II (Acute physiological and chronic health evaluation – Оценка острых и хронических изменений состояния здоровья). При типе C отмечаются все наблюдаемые при подтипе В1 + В2 симптомы в наиболее выраженном виде. Из особенностей следует выделить выраженную слабость, дефицит массы тела 4-й степени, выраженную гипокалиемию (на уровне жизнеугрожающих величин), дефицит кальция, хлоридов, магния, цинка, микроэлементов, витаминов. Отмечается гипопротеинемия, гипоальбуминемия. Функциональный резерв кишечника отсутствует, печени и почек снижен. Происходит нарушение энтерогепатической циркуляции и, по-видимому, механизмов обратной регуляторной связи. При крайней степени тяжести состояния пациента в отсутствие специальной коррекции развивается полиорганная недостаточность. Адаптивные процессы направлены на сохранение гомеостаза. Без периодической коррекции в стационаре метаболических нарушений потеря массы тела у больных составляет почти 5% в год. Индекс массы тела – менее 18 кг/м2, снижается мышечная сила, увеличивается утомляемость, резко уменьшается масса свободного жира (менее 8–4%), повышаются уровни маркеров воспаления (фактор некроза опухоли (ФНО), интерлейкин (ИЛ) 6, C-реактивный белок). Анемия достигает значений по гемоглобину менее 12 г/дл, снижение альбумина плазмы достигает уровня менее 32 г/л, развивается дефицит омега-3 жирных кислот, то есть выявляются все диагностические критерии кахексии. В отсутствие направленной инфузионно-нутритивной коррекции в соответствии с критериями алиментационно-волемического диагноза развиваются эндотоксикоз, полиорганная недостаточность. Прогноз неблагоприятный.
Наблюдается осмотическая диарея.
При крайней степени тяжести состояния пациента в отсутствие специальной коррекции развивается полиорганная недостаточность. Адаптивные процессы направлены на сохранение гомеостаза. Без периодической коррекции в стационаре метаболических нарушений потеря массы тела у больных составляет почти 5% в год. Индекс массы тела – менее 18 кг/м2, снижается мышечная сила, увеличивается утомляемость, резко уменьшается масса свободного жира (менее 8–4%), повышаются уровни маркеров воспаления (фактор некроза опухоли (ФНО), интерлейкин (ИЛ) 6, C-реактивный белок). Анемия достигает значений по гемоглобину менее 12 г/дл, снижение альбумина плазмы достигает уровня менее 32 г/л, развивается дефицит омега-3 жирных кислот, то есть выявляются все диагностические критерии кахексии. В отсутствие направленной инфузионно-нутритивной коррекции в соответствии с критериями алиментационно-волемического диагноза развиваются эндотоксикоз, полиорганная недостаточность. Прогноз неблагоприятный.
Наблюдается осмотическая диарея. Выявляется на первый взгляд необъяснимый лактатный (метаболический) ацидоз, что связано с бактериальной ферментацией лактозы в толстом кишечнике и выработкой избытка D-молочной кислоты, которая усиливает осмотическую диарею. Из особенностей выделим следующие: происходит транслокация кишечной микрофлоры (намного более выраженная при подтипе D2) в проксимальном направлении, развивается изменение активности толстокишечной микробиоты, приводящее в свою очередь к дефициту не только микроэлементов, но и витаминов, снижению иммунного ответа, развитию системного остеопороза и т.д. Особенно характерен дефицит магния. Потребности в белковом компоненте близки к норме, энергопотребность возрастает в 1,5–1,7 раза.
Для пациентов с постколэктомическим (постколрезекционным) синдромом характерны симптомы нарушения микробиоценоза кишечника. При этом у больных с левосторонней гемиколэктомией, по данным Л.Б. Лазебника и соавт., отмечается более выраженный дисбиоз, чем при правосторонней гемиколэктомии [15].
Выявляется на первый взгляд необъяснимый лактатный (метаболический) ацидоз, что связано с бактериальной ферментацией лактозы в толстом кишечнике и выработкой избытка D-молочной кислоты, которая усиливает осмотическую диарею. Из особенностей выделим следующие: происходит транслокация кишечной микрофлоры (намного более выраженная при подтипе D2) в проксимальном направлении, развивается изменение активности толстокишечной микробиоты, приводящее в свою очередь к дефициту не только микроэлементов, но и витаминов, снижению иммунного ответа, развитию системного остеопороза и т.д. Особенно характерен дефицит магния. Потребности в белковом компоненте близки к норме, энергопотребность возрастает в 1,5–1,7 раза.
Для пациентов с постколэктомическим (постколрезекционным) синдромом характерны симптомы нарушения микробиоценоза кишечника. При этом у больных с левосторонней гемиколэктомией, по данным Л.Б. Лазебника и соавт., отмечается более выраженный дисбиоз, чем при правосторонней гемиколэктомии [15]. В связи с нарушениями активности и спектра микробиоты возникают иммунные сдвиги: регистрируется повышение уровней ИЛ-6, ФНО. При левосторонней гемиколэктомии повышается уровень холестерина, липопротеидов низкой плотности, триглицеридов. При правосторонней гемиколэктомии наблюдается рост липопротеидов высокой плотности, что может стать предпосылкой для разработки антиатерогенных операций в метаболической хирургии. При колэктомии по причине изменения энтерогепатической циркуляции практически не происходит образования вторичных желчных кислот и, как следствие, достаточного количества урсодезоксихолевой кислоты, что диктует необходимость применения фармаконутрицевтиков в структуре нутриционной метаболической коррекции [16]. В стадии декомпенсации могут проявиться признаки эндотоксикоза, развитие которого при постколэктомическом синдроме обусловлено нарушением двух основных механизмов дезинтоксикации. Во-первых, при постколэктомическом синдроме отсутствует следующий эффект, наблюдаемый в естественных условиях: снижение рН при образовании КЦЖК приводит к тому, что аммиак, образующийся в толстой кишке, при микробном преобразовании белков и аминокислот переходит в ионы аммония, которые не могут свободно диффундировать через кишечную стенку в кровь, а выводятся в виде аммонийных солей с калом.
В связи с нарушениями активности и спектра микробиоты возникают иммунные сдвиги: регистрируется повышение уровней ИЛ-6, ФНО. При левосторонней гемиколэктомии повышается уровень холестерина, липопротеидов низкой плотности, триглицеридов. При правосторонней гемиколэктомии наблюдается рост липопротеидов высокой плотности, что может стать предпосылкой для разработки антиатерогенных операций в метаболической хирургии. При колэктомии по причине изменения энтерогепатической циркуляции практически не происходит образования вторичных желчных кислот и, как следствие, достаточного количества урсодезоксихолевой кислоты, что диктует необходимость применения фармаконутрицевтиков в структуре нутриционной метаболической коррекции [16]. В стадии декомпенсации могут проявиться признаки эндотоксикоза, развитие которого при постколэктомическом синдроме обусловлено нарушением двух основных механизмов дезинтоксикации. Во-первых, при постколэктомическом синдроме отсутствует следующий эффект, наблюдаемый в естественных условиях: снижение рН при образовании КЦЖК приводит к тому, что аммиак, образующийся в толстой кишке, при микробном преобразовании белков и аминокислот переходит в ионы аммония, которые не могут свободно диффундировать через кишечную стенку в кровь, а выводятся в виде аммонийных солей с калом. Во-вторых, нарушается преобразование билирубина в уробилиноген, который в норме частично всасывается и экскретируется с мочой, а частично выводится с калом. В итоге в копрограмме появляются особенности, которые при благоприятном прогнозе по мере адаптации кишечника существенно нивелируются [17, 18].
Во-вторых, нарушается преобразование билирубина в уробилиноген, который в норме частично всасывается и экскретируется с мочой, а частично выводится с калом. В итоге в копрограмме появляются особенности, которые при благоприятном прогнозе по мере адаптации кишечника существенно нивелируются [17, 18].Функциональный резерв остального кишечника (при нагрузке сахарозой) в целом достаточен для обеспечения нутритивной поддержки у 78% перенесших обширные операции на толстой кишке, у 22% пациентов он снижен или резко снижен в течение полугода после операции. Функциональные нарушения печени (и сниженный функциональный резерв), выявленные по данным ультразвукового ангиосканирования, могут быть верифицированы в соответствии со шкалой М.Д. Дибирова и В.С. Акопян (2008) [19]: в первые полгода у 88,2% отмечается легкая степень печеночной дисфункции (2–3 балла), у 11,8% – средняя степень (4–6 баллов). Среди последствий обширных резекций толстого кишечника выражены электролитные нарушения, в частности отмечается значительный дефицит магния, нарушение энтерогепатической циркуляции.
 Далее по всей длине тонкой кишки происходит пассивное всасывание незначительного количества желчных кислот. Исключение представляет подвздошная кишка, где активно всасывается 80% желчных кислот. Невсосавшиеся желчные кислоты (около 16%) проходят ниже, в толстую кишку, и подвергаются процессу деконъюгации ферментами кишечной микробиоты. Незначительная часть деконъюгированных желчных кислот также всасывается, но большая их часть превращается в дегидрохолевую и литохолевую кислоты (вторичные желчные кислоты), которые также всасываются в толстой кишке (пассивно) и затем попадают в печень, чтобы снова повторить цикл энтерогепатической циркуляции (ЭГЦ). Потери желчных кислот с калом составляют 2–5%. В сутки выполняется 5–10 циклов ЭГЦ [20], обеспечивающих экономию количества желчных кислот в организме, так как печень не в состоянии обеспечить синтез суточных норм желчных кислот (в норме печень синтезирует лишь 0,2–0,6 г желчных кислот в сутки, в то время как за счет ЭГЦ в желчь выделяется 25–30 г желчных кислот в сутки).
Далее по всей длине тонкой кишки происходит пассивное всасывание незначительного количества желчных кислот. Исключение представляет подвздошная кишка, где активно всасывается 80% желчных кислот. Невсосавшиеся желчные кислоты (около 16%) проходят ниже, в толстую кишку, и подвергаются процессу деконъюгации ферментами кишечной микробиоты. Незначительная часть деконъюгированных желчных кислот также всасывается, но большая их часть превращается в дегидрохолевую и литохолевую кислоты (вторичные желчные кислоты), которые также всасываются в толстой кишке (пассивно) и затем попадают в печень, чтобы снова повторить цикл энтерогепатической циркуляции (ЭГЦ). Потери желчных кислот с калом составляют 2–5%. В сутки выполняется 5–10 циклов ЭГЦ [20], обеспечивающих экономию количества желчных кислот в организме, так как печень не в состоянии обеспечить синтез суточных норм желчных кислот (в норме печень синтезирует лишь 0,2–0,6 г желчных кислот в сутки, в то время как за счет ЭГЦ в желчь выделяется 25–30 г желчных кислот в сутки). Следовательно, недостаточность желчных кислот может быть связана: а) с первичным уменьшением их синтеза (заболевания печени), б) с нарушением ЭГЦ, в) с нарушением механизмов обратной связи, регулирующих их синтез.
В норме при уменьшении уровня желчных кислот, участвующих в ЭГЦ, происходит активация их синтеза печенью до достижения нормального уровня. При изучении клинико-нутриционных параллелей установлено, что последствием обширных резекций кишечника является недостаточный синтез вторичных желчных кислот, то есть у таких больных не обеспечивается формирование полноценной энтерогепатической циркуляции и регуляции. Пул кишечной микробиоты оказывается также малоактивным вследствие укорочения кишечной поверхности [21–23].
По этой же причине несостоятельной оказывается и обратная связь, регулирующая синтез желчных кислот, так как структуры, участвующие в гормональной регуляции, также могут оказаться в зоне удаленного отрезка кишечника.
Учитывая приведенные выше сведения, мы провели исследование, в ходе которого пациентам для коррекции нутриционных нарушений в отдаленном периоде после перенесенной операции резекции кишечника в структуру нутриционной поддержки включали стимуляторы микробиоты (растительный препарат Подорожника семенная кожура (Plantaginis semenis deliciosa) по 5 г на прием, то есть по 1 саше 1–2 раза в сутки растворяли и вводили в составе принимаемого рациона) и заместительную коррекцию желчными кислотами (препарат урсодезоксихолевой кислоты Урсосан 250 мг в сутки растворяли в объеме суточного рациона).
Следовательно, недостаточность желчных кислот может быть связана: а) с первичным уменьшением их синтеза (заболевания печени), б) с нарушением ЭГЦ, в) с нарушением механизмов обратной связи, регулирующих их синтез.
В норме при уменьшении уровня желчных кислот, участвующих в ЭГЦ, происходит активация их синтеза печенью до достижения нормального уровня. При изучении клинико-нутриционных параллелей установлено, что последствием обширных резекций кишечника является недостаточный синтез вторичных желчных кислот, то есть у таких больных не обеспечивается формирование полноценной энтерогепатической циркуляции и регуляции. Пул кишечной микробиоты оказывается также малоактивным вследствие укорочения кишечной поверхности [21–23].
По этой же причине несостоятельной оказывается и обратная связь, регулирующая синтез желчных кислот, так как структуры, участвующие в гормональной регуляции, также могут оказаться в зоне удаленного отрезка кишечника.
Учитывая приведенные выше сведения, мы провели исследование, в ходе которого пациентам для коррекции нутриционных нарушений в отдаленном периоде после перенесенной операции резекции кишечника в структуру нутриционной поддержки включали стимуляторы микробиоты (растительный препарат Подорожника семенная кожура (Plantaginis semenis deliciosa) по 5 г на прием, то есть по 1 саше 1–2 раза в сутки растворяли и вводили в составе принимаемого рациона) и заместительную коррекцию желчными кислотами (препарат урсодезоксихолевой кислоты Урсосан 250 мг в сутки растворяли в объеме суточного рациона). Наш опыт применения модифицированной программы коррекции (введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и Урсосана) в сравнении с традиционной нутриционной коррекцией у пациентов с последствиями обширной резекции кишечника типа F, поступавших в стационар для коррекции нутриционных нарушений спустя 1–5 лет и свыше 5 лет после перенесенной колэктомии, представлен в табл. 2.
Как видно из данных табл. 2, отмечаются следующие преимущества модифицированной схемы: быстрее восстанавливались параметры общего белка, альбумина, наблюдалась тенденция к увеличению массы тела. При этом уровни глюкозы и холестерина оставались в пределах физиологических колебаний. Показательно и сохранение индекса литогенности желчи на близком к норме уровне (0,9–0,93) в течение первых 3 лет наблюдения у пациентов, длительно получавших модифицированную нутриционную коррекцию (наличие сладжа, неоднородности желчи верифицировались также по данным ультразвукового исследования).
Наш опыт применения модифицированной программы коррекции (введение в структуру нутриционной программы растительного препарата на основе подорожника блошиного и Урсосана) в сравнении с традиционной нутриционной коррекцией у пациентов с последствиями обширной резекции кишечника типа F, поступавших в стационар для коррекции нутриционных нарушений спустя 1–5 лет и свыше 5 лет после перенесенной колэктомии, представлен в табл. 2.
Как видно из данных табл. 2, отмечаются следующие преимущества модифицированной схемы: быстрее восстанавливались параметры общего белка, альбумина, наблюдалась тенденция к увеличению массы тела. При этом уровни глюкозы и холестерина оставались в пределах физиологических колебаний. Показательно и сохранение индекса литогенности желчи на близком к норме уровне (0,9–0,93) в течение первых 3 лет наблюдения у пациентов, длительно получавших модифицированную нутриционную коррекцию (наличие сладжа, неоднородности желчи верифицировались также по данным ультразвукового исследования).
Таким образом, при проведении нутриционной коррекции у больных, перенесших обширные резекции кишечника, в зависимости от уровня и объема вмешательства выделяются несколько характерных типов клинико-нутриционных (метаболических) нарушений (А–F типы) [10]. В результате развившихся последствий объемных операций на кишечнике нарушаются различные виды обмена, в том числе и обмен желчных кислот, связанный с выпадением функционально значимых отрезков кишечника. При проведении нутриционного лечения у таких больных целесообразно в его структуру вводить корректоры микробиоты и препараты урсодезоксихолевой кислоты (нами применялся препарат Урсосан в стандартных терапевтических дозировках – по 1 капсуле (250 мг) 1 раз в сутки). Такая схема терапии приводит к более полной утилизации липидов и в целом к более быстрому восстановлению нутриционного статуса даже в отдаленном периоде после перенесенной колэктомии.
дело темное, тонкое, извилистое и многоликое
Рак кишечника — это не одно, а сразу пять разных заболеваний
Колоректальный рак, или как его объединяют в обиходе сами пациенты, рак кишечника, имеет свои интересные особенности. Под этим названием скрывается не одно, а сразу пять разных заболеваний. По отдельности они вроде, как и статистического риска никакого не представляет, но если его правильно сосчитать, то картина будет устрашающая. Почему — объяснят:
Под этим названием скрывается не одно, а сразу пять разных заболеваний. По отдельности они вроде, как и статистического риска никакого не представляет, но если его правильно сосчитать, то картина будет устрашающая. Почему — объяснят:
• Алла Сергеевна Доможирова, зам.гл.врача ЧОКЦОиЯМ по ОМР
• Константин Владимирович Семикопов, врач онколог — абдоминальный хирург ЧОКЦОиЯМ
Статистика: Рак кишечника — это не одно, а сразу четыре разных заболеваний (коды МКБ С18-С21). По сути каждый код — это отдельная локализация. Колоректальный рак — толстый кишечник: ободочная, восходящая, нисходящая, поперечная кишка — это один код. Второй — сигмовидная кишка, третий — прямая кишка. Анальный выход — тоже отдельный код. Еще один (пятый) — это тонкий кишечник (мало и редко встречается). На долю каждого из них приходится очень небольшое количество случаев, и в лидеры по отдельности они ну никак не попадают. Но если сложить, что и делают европейские и российские онкологи, (поскольку этиопатогенез общий — одна кишечная трубка, один тип эпителия (за исключением анального выхода — бывает плоскоклеточный рак). То получается, что по заболеваемости колоректальный рак сопоставим с раком легких и занимает 10-11% от общей заболеваемости в общей структуре.
То получается, что по заболеваемости колоректальный рак сопоставим с раком легких и занимает 10-11% от общей заболеваемости в общей структуре.
Рост заболеваемости начинается в старшем возрасте, начиная с 55 лет, а пик приходится на пожилой возраст — 75-80 лет. И, конечно, чтобы выявить этот вид рака на ранней стадии, скрининг нужно проводить именно у этой категории граждан.
Константин Семикопов уверен, при своевременном обращении при раке кишечника прогноз будет благоприятным
Прогноз: За последние десять лет в Челябинской области наблюдается увеличение числа новых случаев примерно на 2,5%. При этом рост заболеваемости и смертности в регионе имеют практически одинаковый прирост: локализация плохо поддается управлению, это значит, что первой и второй стадии выявляется недостаточно. А запущенные случаи как раз и определяют летальность. Есть и прямая корреляция с социальными явлениями: как только люди перестают питаться хорошо, то в интервале в 5-10 лет наблюдается рост заболеваемости и смертности от рака желудка и кишечника. При этом специалисты обнадеживают, рак кишечника хорошо поддается лечению и имеет благоприятный долговременный прогноз, особенно если с визитом к врачу пациент не тянул.
При этом специалисты обнадеживают, рак кишечника хорошо поддается лечению и имеет благоприятный долговременный прогноз, особенно если с визитом к врачу пациент не тянул.
Факторы риска: Еще древние говорили: «Мы — то, что едим». В отношении рака кишечника эта прописная истина как никогда работает. Адекватность рациона питания — это основа профилактики заболеваний как желудка, так и кишечника. Бросаться из крайности в крайность — от вегетарианства и сыроядения до мясоедства — врачи категорически не советуют. Питание должно быть сбалансированным: не менее, чем на половину, должно содержать клетчатку, причем в ее основе должны быть зеленые овощи (мы уже говорили об этом в предыдущем материале), фрукты и молочные (молочно-кислые) продукты — обязательно, чтобы стул формировался ежедневный и мягкий.
Вопрос по поводу употребления красного мяса и риска развития рака — обсуждается, особенно по части тех белковых производных, очень токсичных, которые остаются в кишечнике после переработки и могут нести в себе риск. Однако для его возникновения мясо нужно есть ежедневно и много, что вряд ли возможно в нашей реальности. Список рисков выглядит так:
Однако для его возникновения мясо нужно есть ежедневно и много, что вряд ли возможно в нашей реальности. Список рисков выглядит так:
• Питание
• курение, алкоголь
• малоподвижный образ жизни
• нарушения микрофлоры кишечника — одинаково плохо, когда опорожнение кишечника происходит от случая к случаю (запоры), так и постоянная диарея (понос) ничего хорошего не дает
• предраковые, или фоновые заболевания — неспецифический язвенные колиты, полипоз кишечника. Такие пациенты диспансерной группы должны наблюдаться у врачей регулярно и проходить лечение. В основе своей может иметь генетическую или наследственную предрасположенность, встречаются крайне редко, единичные случаи.
Симптомы: Нужно обращать внимание на любые примеси в кале, будь то слизь или кровянистые выделения. Это первый, и самый явный признак, который должен насторожить и отправить к врачу. Такая неудобная патология, как геморрой, тоже служит плохую службу. Пациенты долго не обращают на нее внимания, стесняются и думают, что кровит именно из-за этого.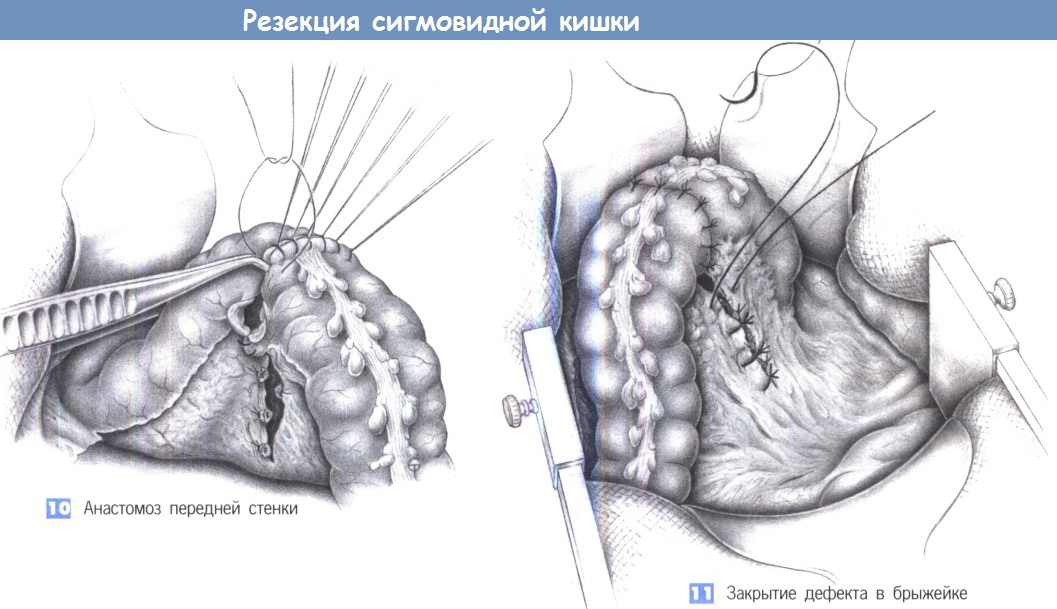 Мол, покапает и перестанет. Опасное заблуждение! Конечно, «мазать» может и трещина в анальном проходе, и другие проявления геморроя могут дать о себе знать. Но под той же маской может скрываться и рак прямой кишки или рак толстой кишки. (Спровоцировать усиленное развитие онкозаболевания может травматизация имеющихся полипов и язв твердым калом).
Мол, покапает и перестанет. Опасное заблуждение! Конечно, «мазать» может и трещина в анальном проходе, и другие проявления геморроя могут дать о себе знать. Но под той же маской может скрываться и рак прямой кишки или рак толстой кишки. (Спровоцировать усиленное развитие онкозаболевания может травматизация имеющихся полипов и язв твердым калом).
Хирургическое лечение является решающим при раке кишечника
Второе, на что нужно обращать внимание — любые болевые симптомы, особенно если они продолжаются в течение 3-6 месяцев. Даже если они связаны с геморроидальными узлами, с трещинами заднего прохода, то их можно и нужно лечить.
Третье — как правило, все «наши» пациенты попадают с жалобами на слабость, недомогание, анемию, немотивированную потерю веса, скачки температуры. Сначала — к терапевту, который назначает им разные исследования и анализы. И потом как случайную находку в самую последнюю очередь, поскольку колоноскопию «просто так» ради праздного интереса не назначают, обнаруживается опухоль в каком-то из отделов кишечника. Сама по себе колоноскопия очень информативна, и на сегодняшний день дает максимально возможные и наиболее полные данные о состоянии всех отделов кишечника. Это единственный способ взять биопсию и расставить все точки над i. Но, к сожалению, процедура не комфортна, не входит в программу скрининга для условно здоровых людей и рекомендована при диспансеризации только по показаниям людям старше 48 лет.
Сама по себе колоноскопия очень информативна, и на сегодняшний день дает максимально возможные и наиболее полные данные о состоянии всех отделов кишечника. Это единственный способ взять биопсию и расставить все точки над i. Но, к сожалению, процедура не комфортна, не входит в программу скрининга для условно здоровых людей и рекомендована при диспансеризации только по показаниям людям старше 48 лет.
Ранняя диагностика: Метод первичного скрининга «немых» заболеваний — это анализ кала на скрытую кровь. Но надо понимать, что все опухоли проходят одинаковые условные стадии развития — пятно, объем (нарост), язва. И «что-то» появится в кале только вот на этой язвенной стадии. Получается, что методов «предпредранней» диагностики для людей, которые считают себя здоровыми, поскольку их ничего не беспокоит, но при этом процесс развития опухоли уже идет — не существует. Поэтому, когда пациенты обращаются только тогда, когда их уже что-то беспокоит, то процесс, скорей всего, уже будет распространенным. Болезнь удается поймать на ранней стадии, если человек сдает анализ сразу, не откладывая все в долгий ящик. Сам анализ бывает нескольких видов, но для онкологов важно рассмотреть гаптоглобин и гемоглобин в совокупности — тогда обе фракции крови будут оценены и проанализированы в полном объеме.
Болезнь удается поймать на ранней стадии, если человек сдает анализ сразу, не откладывая все в долгий ящик. Сам анализ бывает нескольких видов, но для онкологов важно рассмотреть гаптоглобин и гемоглобин в совокупности — тогда обе фракции крови будут оценены и проанализированы в полном объеме.
Есть одна тонкость: сдавать анализ нужно просто потому, что «так надо». Не нужно ждать, когда потекут «красные реки крови», и их станет «видно». Это лабораторная диагностика, которая направлена как раз на то, что обычному глазу не видно, а в микроскоп разглядеть уже можно.
Применение химиотерапии — это, как правило, уже второй этап лечения рака кишечника
Основной метод инструментальной диагностики — эндоскопический (колоноскопия, реже — ректоскопия (прямая кишка). Он позволяет увидеть «глазом» и взять материал на биопсию.
Лечение: Применяется та же триада методов, что и при других локализациях, только в своих пропорциях. Подходы в лечении разных локализаций тоже будут разные. По современным стандартам прежде, чем приступить к лечению, специалисты проводят стадирование заболевания. Операция в лечении рака кишечника играет принципиальную роль. Ободочную (все отделы — слепая, восходящая, поперечно ободочная, нисходящая, сигмовидная) кишку при I-II стадии первым этапом всегда оперируют и удаляют опухоль. При III — IV стадии после операции добавляется химиотерапия. Лучевая терапия используется только при раке прямой кишки перед операцией.
По современным стандартам прежде, чем приступить к лечению, специалисты проводят стадирование заболевания. Операция в лечении рака кишечника играет принципиальную роль. Ободочную (все отделы — слепая, восходящая, поперечно ободочная, нисходящая, сигмовидная) кишку при I-II стадии первым этапом всегда оперируют и удаляют опухоль. При III — IV стадии после операции добавляется химиотерапия. Лучевая терапия используется только при раке прямой кишки перед операцией.
Есть своя сложность лечения, особенно прямой кишки. Если ободочную кишку еще можно увидеть как при открытой, так и при лапароскопической операции. То прямая кишка расположена в малом тазу и закрыта костным кольцом. Технически это очень сложные операции, которые проводят только очень опытные хирурги. Учится этому и нарабатывать мануальный опыт приходится долго. И прямую кишку, и ободочную можно оперировать лапароскопически, и хирурги онкоцентра это умеют отлично делать. Этот способ хирургические вмешательства менее травматичен для пациента, восстановление происходит быстрее, кровопотеря и послеоперационный болевой синдром минимальны. Навык требует наработки и практики, а также дорогостоящего высококлассного оборудования. Однако у лапароскопических операций есть свои противопоказания:
Навык требует наработки и практики, а также дорогостоящего высококлассного оборудования. Однако у лапароскопических операций есть свои противопоказания:
• выраженный спаечный процесс, когда в брюшной полости есть много рубцов и спаек
• выраженные сердечно-сосудистые заболевания и дыхательные расстройства. Во время проведения лапароскопической операции пространство внутри живота нужно немножко раздвинуть, чтобы освободить место для инструмента. Для этого используется специальный газ, которым человека надувают, как воздушный шарик. В результате диафрагма поднимается, и человеку становиться тяжело дышать.
• местно распространенный процесс, когда опухоль проросла сразу в несколько органов, к которым подобраться вслепую очень сложно.
Контрольный снимок МРТ малого таза позволяет точно спланировать объем вмешательства
Третий этап — окончательное стадирование процесса происходит только после операции на основе гистологического исследования операционного материала, после которого принимается решение о проведении противоопухолевой лекарственной химиотерапии.
По сравнению с другими локализациями колоректальный рак считается благоприятным и поддается лечению. Метастазирование происходит медленно, и пациенты даже с метастазами живут гораздо дольше, чем при других локализациях. Онкологи научились справляться с этими процессами тоже — метастазы удаляются (чаще всего, они появляются в печени, реже легкие, кости) или продолжается курс химиотерапии, и пациент живет дольше.
Наибольшие опасения вызывают местно распространеный процесс, когда опухоль задела уже соседние органы и ткани. Тогда приходится удалять очень большой объем (эвисцерация органов малого таза) и накладывать пациенту колостому. По счастью такие крайне запущенные случаи в практике встречаются редко.
Малые формы рака — рак в полипе кишечника, когда в новообразовании появляются только первые раковые клетки, а о самом заболевании речь еще не идет. Это так называемая форма рака in situ. В этом случае можно обойтись мукозальной или субмукозальной резекцией — удаляется часть слизистой стенки с новообразованиями. Это эндоскопическое вмешательство происходит в рамках стационара с помощью специального оборудования и через естественные отверстия без разрезов под общим наркозом. Прекрасная технология, благодаря которой в последнее время мы отмечаем и рост обращений, и вмешательств. Так что бояться не стоит!
Это эндоскопическое вмешательство происходит в рамках стационара с помощью специального оборудования и через естественные отверстия без разрезов под общим наркозом. Прекрасная технология, благодаря которой в последнее время мы отмечаем и рост обращений, и вмешательств. Так что бояться не стоит!
ЧИТАЙТЕ ТАКЖЕ
Онкосреда. Просто пощупать: рак молочной железы первыми чаще всего обнаруживают мужчины
Как находить и как лечить, статистика и прогнозы, мифы и реальность, методы лечения и диагностики. (подробности)
Онкосреда. Рак легкого: коварен, прожорлив и смертельно опасен
Что нужно знать об этом заболевании. (подробности)
Онкосреда. Рак кожи: не красный, не чешется и не болит
Почему южное солнце южноуральцам «не светит». (подробности)
Онкосреда. Рак желудка: ранняя диагностика — в руках самого пациента
Расскажем, как зеленые овощи помогают избежать, а соль наоборот — «заработать», страшный недуг. (подробности)
(подробности)
Хроническая диарея у взрослых: общие рекомендации по диагностике 2018 г.
Резюме. Британского общества гастроэнтерологии (BSG)
Хроническая диарея является довольно распространенной проблемой, требующей четкого руководства для клиницистов. В 2018 г. рабочая группа BSG по заказу Комитета клинических услуг и стандартов (Clinical Services and Standards Committee), Великобритания, обновила рекомендации по диагностике причин хронической диареи. Оценка качества доказательств и уровня рекомендаций соответствует системе GRADE. Рекомендации предназначены для клинической оценки в рамках оказания первичной и вторичной специализированной медицинской помощи пациентам с диареей, дифференциальной диагностики рака или воспалительных состояний и прочих распространенных заболеваний, таких как хологенная диарея, микроскопический колит, мальабсорбция лактозы, диарея после радиационного облучения, а также более редких причин.
Определение диареи
Диарея определяется, исходя из частоты, объема, массы стула и его консистенции, причем последний признак наиболее часто ассоциируется с понятием диареи. Однако в клинике задача классификации требует использования определенных инструментов, таких как Бристольская шкала, в которой диареей считается тип оформленности кала от 5-го и выше. Установленные в прошлом нормы массы стула (≥200 г/сут) неактуальны в текущее время, учитывая количество людей, диета которых отличается от превалировавшего ранее западного типа, и не может быть рекомендована в качестве критерия определения диареи. Сложность в первичной оценке может возникать по причине несоответствия между медицинским и непрофессиональным (бытовым) пониманием диареи. В частности, недержание кала иногда ошибочно расценивается как диарея, в то же время симптомы, указывающие на функциональное заболевание кишечника трудно отличить от таковых при органической патологии, основываясь на одном лишь анамнезе.
Однако в клинике задача классификации требует использования определенных инструментов, таких как Бристольская шкала, в которой диареей считается тип оформленности кала от 5-го и выше. Установленные в прошлом нормы массы стула (≥200 г/сут) неактуальны в текущее время, учитывая количество людей, диета которых отличается от превалировавшего ранее западного типа, и не может быть рекомендована в качестве критерия определения диареи. Сложность в первичной оценке может возникать по причине несоответствия между медицинским и непрофессиональным (бытовым) пониманием диареи. В частности, недержание кала иногда ошибочно расценивается как диарея, в то же время симптомы, указывающие на функциональное заболевание кишечника трудно отличить от таковых при органической патологии, основываясь на одном лишь анамнезе.
В вопросе продолжительности симптомов, определяющей отличие между хронической и острой формой диареи, все еще не достигнут консенсус. В текущее время большинство исследовательских групп, включая BSG, признают, что симптомы, сохраняющиеся дольше 4 нед, указывают на неинфекционную этиологию, что требует более пристального исследования. Повышенная частота дефекации, наравне с измененной консистенцией каловых масс, чаще свидетельствует об органической этиологии диареи. Таким образом, прагматический подход в определении хронической диареи требует одновременной оценки по Бристольской шкале (от 5-го типа и выше) и продолжительности симптомов (до 4 нед).
Повышенная частота дефекации, наравне с измененной консистенцией каловых масс, чаще свидетельствует об органической этиологии диареи. Таким образом, прагматический подход в определении хронической диареи требует одновременной оценки по Бристольской шкале (от 5-го типа и выше) и продолжительности симптомов (до 4 нед).
Хроническая диарея в практике семейного врача
В большинстве случаев начальную консультацию при диарее проводят врачи первичной медико-санитарной помощи, в практике которых около 10% всех обращений касаются гастроэнтерологических проблем. Большинство диарей являются самоограничивающимися или функциональными нарушениями, и лишь незначительная часть приходится на долю хронических состояний. Не выходя за рамки предложенного определения, при наличии частого (≥3/сут) жидкого стула в течение более 4 нед и распространенности 3–5%, врач первичной медико-санитарной помощи при средних объемах нагрузки (1700 пациентов) может зарегистрировать 50–85 случаев хронической диареи в год. При этом лишь часть пациентов в решении данной проблемы обратятся за помощью к семейному врачу. Поскольку нет достаточного объема данных пациентов с хронической диареей на уровне вторичной медицинской помощи, позволительно предположить, что количество таких пациентов невелико.
При этом лишь часть пациентов в решении данной проблемы обратятся за помощью к семейному врачу. Поскольку нет достаточного объема данных пациентов с хронической диареей на уровне вторичной медицинской помощи, позволительно предположить, что количество таких пациентов невелико.
Изменение частоты и формы стула характерно также для синдрома раздраженного кишечника. Основой диагностики этого состояния является симптоматика, тогда как масса стула не увеличивается. В остальном наблюдается значительное перекрытие симптомов с истинной диареей. Поскольку синдром раздраженного кишечника возможен у 10–13% популяции, очевидна высокая вероятность неадекватных диагнозов. Однако важно помнить, что диареей могут проявляться начальные стадии серьезных органических заболеваний, таких как неоплазия толстой кишки. Кроме того, диарея может быть результатом воспалительных заболеваний, мальабсорбции, экзокринной недостаточности поджелудочной железы и нарушения моторики кишечника. Широкий диагностический диапазон, обусловленный схожестью симптомов, и разнообразие условий, приводящих к диарее, затрудняют разработку конкретных рекомендаций. Решение о назначении определенного вида исследований по-прежнему в большей степени зависит от клинического мышления, однако распространенность и потенциальная опасность некоторых состояний (например неоплазия толстой кишки) требуют их определения на ранней стадии исследований пациента.
Решение о назначении определенного вида исследований по-прежнему в большей степени зависит от клинического мышления, однако распространенность и потенциальная опасность некоторых состояний (например неоплазия толстой кишки) требуют их определения на ранней стадии исследований пациента.
Хроническая диарея на вторичном уровне медицинской помощи
Подробная история болезни при хронической диарее дает возможность оценить вероятность наличия органического нарушения на основе «признаков тревоги», — необъяснимых изменений в частоте и характере стула, постоянном присутствии крови в каловых массах и непроизвольной потере массы тела (подобные изменения являются достаточным основанием для направления пациента на вторичный уровень медицинской помощи), отличить мальабсорбцию от диареи и конкретизировать ее причины. Симптомы органического заболевания включают диарею продолжительностью <3 мес, преимущественно ночную или непрерывную при значительной потере массы тела. Отсутствие указанных признаков в сочетании с положительными симптомами, подобными описанным в Римских критериях IV, и нормальными результатами физикального исследования свидетельствуют о функциональном нарушении работы кишечника со специфичностью около 52–74%. К сожалению, эти критерии не позволяют достоверно исключить воспалительное заболевание кишечника и микроскопический колит.
К сожалению, эти критерии не позволяют достоверно исключить воспалительное заболевание кишечника и микроскопический колит.
Признаки органических нарушений
При мальабсорбции часто наблюдается стеаторрея с выделением большого объема зловонных каловых масс бледного цвета. Мягкие формы этого заболевания могут вообще не проявляться никакими аномалиями стула. Толстокишечная, воспалительная или секреторная формы диареи обычно характеризуются жидким стулом с кровью или слизистым отделяемым. Конкретные факторы риска, повышающие вероятность органической причины диареи, или указывающие на необходимость проведения соответствующего исследования, включают:
- семейную историю, особенно случаи неоплазии, воспалительных заболеваний кишечника или целиакии;
- предшествующие операции, такие как обширная резекция подвздошной кишки и восходящей ободочной кишки, которые приводят к диарее из-за недостатка абсорбирующей поверхности и, следовательно, мальабсорбции жира и углеводов, уменьшения времени транзита или изменений метаболизма желчных кислот.
 В таких случаях частой проблемой оказывается избыточный бактериальный рост, особенно после шунтирующих операций, таких как еюноилеальный байпас или вертикальная гастропластика, производимых с целью устранения ожирения. Менее обширные резекции терминального отдела подвздошной кишки могут приводить к хологенной диарее, которая появляется типично после еды и обычно связана ответной реакцией с голоданием и применением секвестрантов желчных кислот. Хроническая диарея может развиваться у 10% пациентов после холецистэктомии по причине ускоренного кишечного транзита, хологенной диареи и повышенной энтерогепатической циркуляции желчных кислот;
В таких случаях частой проблемой оказывается избыточный бактериальный рост, особенно после шунтирующих операций, таких как еюноилеальный байпас или вертикальная гастропластика, производимых с целью устранения ожирения. Менее обширные резекции терминального отдела подвздошной кишки могут приводить к хологенной диарее, которая появляется типично после еды и обычно связана ответной реакцией с голоданием и применением секвестрантов желчных кислот. Хроническая диарея может развиваться у 10% пациентов после холецистэктомии по причине ускоренного кишечного транзита, хологенной диареи и повышенной энтерогепатической циркуляции желчных кислот; - предшествующие заболевания поджелудочной железы;
- системные состояния, такие как тиреотоксикоз и гипопаратиреоз, сахарный диабет, заболевания надпочечников или системный склероз. Все из перечисленных состояний могут повышать предрасположенность к диарее различными путями, включая эндогенные эффекты, вегетативную дисфункцию, избыточный рост микробиоты, сопутствующую фармакотерапию;
- злоупотребление алкоголем, который оказывает прямое токсическое воздействие на кишечный эпителий, способствует ускорению кишечного транзита, снижает активность кишечных дисахаридаз и функцию поджелудочной железы;
- диету с чрезмерным употреблением кофеина, молока при дефиците лактазы, пищевых добавок (например сорбитола), фруктозы и других FODMAPs;
- применение лекарственных средств, с которым связано около 4% всех случаев хронической диареи, в частности с препаратами магния, антигипертензивными средствами (например ингибиторами ангиотензинпревращающего фермента), нестероидными противовоспалительными препаратами, новейшими классами глиптинов (ингибиторами дипептидилпептидазы-4), теофиллинами, антибиотиками, антиаритмическими препаратами и противоопухолевыми средствами;
- недавние зарубежные поездки и прочие предположительные причины инфицирования желудочно-кишечного тракта;
- недавнюю антибактериальную терапию и инфекцию Clostridium difficile.

Скрининг при хронической диарее
Анализ крови
Аномальные результаты анализа крови, такие как повышенная скорость оседания эритроцитов, анемия или сниженные уровни альбумина, являются высокоспецифичными признаками органического заболевания. Железодефицит является чувствительным показателем энтеропатии тонкого кишечника, особенно целиакии, но не является специфическим тестом. Базовое исследование для выявления мальабсорбции должно включать развернутый анализ крови, оценку электролитного состава, печеночные пробы, измерение уровня мочевины, витамина В12, фолатов, кальция, С-реактивного белка и скорости оседания эритроцитов. На этом этапе также выполняется оценка функционального состояния щитовидной железы, при этом пониженный уровень тиреотропного гормона является лучшим предиктором гипертиреоза.
Серологические тесты на целиакию
Целиакия определяется как состояние повышенной иммунологической реактивности на глютен у генетически восприимчивых индивидуумов.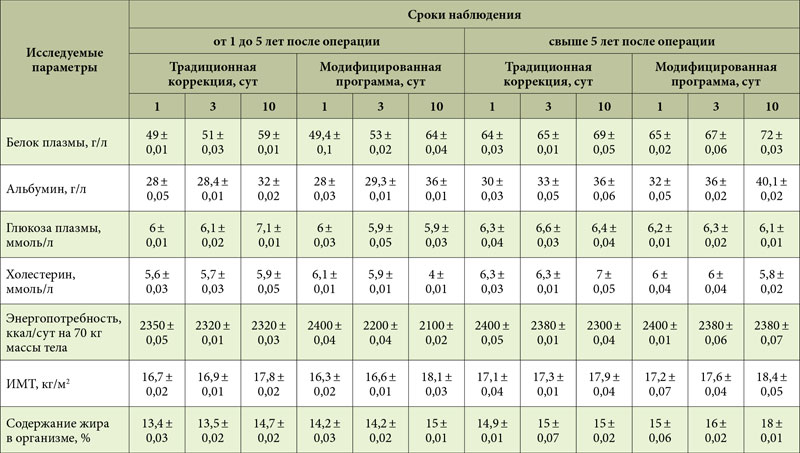 Распространенность целиакии в западных странах составляет 0,5–1% и, по имеющимся свидетельствам, постоянно повышается. Несмотря на глобальный характер этого заболевания, его диагностика довольно часто задерживается. Разработка высокоточных серологических тестов и проведение крупных эпидемиологических исследований последних лет способствовали более глубокому пониманию целиакии. В текущее время общепризнано, что у большинства пациентов могут быть слабовыраженные симптомы, что распространенность целиакии выше среди взрослых пациентов, чем среди детей, и существует состояние предцелиакии. Структура заболеваемости подобна айсбергу, верхушку над ватерлинией которого составляют пациенты с типичной симптоматикой непереносимости глютена, такими как диарея и потеря массы тела. Все остальные пациенты имеют атипичные симптомы, такие как вздутие живота или железодефицитная анемия, остеопороз и стабильно аномальные результаты печеночных проб. Распространенность целиакии выше среди пациентов с сахарным диабетом 1-го типа, аутоиммунным заболеванием щитовидной железы и семейной историей целиакии.
Распространенность целиакии в западных странах составляет 0,5–1% и, по имеющимся свидетельствам, постоянно повышается. Несмотря на глобальный характер этого заболевания, его диагностика довольно часто задерживается. Разработка высокоточных серологических тестов и проведение крупных эпидемиологических исследований последних лет способствовали более глубокому пониманию целиакии. В текущее время общепризнано, что у большинства пациентов могут быть слабовыраженные симптомы, что распространенность целиакии выше среди взрослых пациентов, чем среди детей, и существует состояние предцелиакии. Структура заболеваемости подобна айсбергу, верхушку над ватерлинией которого составляют пациенты с типичной симптоматикой непереносимости глютена, такими как диарея и потеря массы тела. Все остальные пациенты имеют атипичные симптомы, такие как вздутие живота или железодефицитная анемия, остеопороз и стабильно аномальные результаты печеночных проб. Распространенность целиакии выше среди пациентов с сахарным диабетом 1-го типа, аутоиммунным заболеванием щитовидной железы и семейной историей целиакии.
Диарею выявляют у 43–85% пациентов с недавно диагностированной целиакией. Напротив, ее распространенность у пациентов вторичного уровня медицинской помощи с хронической диареей не превышает 3–10%. С учетом задержки в диагностике и доступности серологических тестов рекомендуется выполнять исследование на целиакию у пациентов с хронической диареей в обязательном порядке. В отдельных ситуациях диагностическая ценность серологического тестирования резко снижается, однако, чтобы устранить имеющиеся сомнения в отношении диагноза, целесообразно дополнительно выполнить биопсию слизистой оболочки двенадцатиперстной кишки, учитывая, что серонегативный подтип целиакии отмечают у 6,4–7% общего числа пациентов с непереносимостью глютена.
Иммунодефицитное состояние и инфекция
Хроническая диарея вследствие инфицирования у пациентов со здоровым иммунитетом — нетипичное явление. Напротив, иммунодефицитные состояния (например при ВИЧ-инфекции) характеризуются хронической диареей на ранней стадии выявления. Клиницисту необходимо учитывать эпидемиологическую ситуацию по ВИЧ в своем регионе и предлагать соответствующее тестирование. После выявления иммунодефицита рекомендуется исследовать пациента на наличие хронических инфекций такими патогенами, как Cryptosporidia или норовирус. Довольно часто причиной хронической инфекции является лямблиоз и амебиаз, диагностика которых основывается на повторном анализе свежих образцов кала (достоверность выявления яиц и кист составляет 60–90%). Выявление инфекции Giardia значительно облегчилось с использованием теста ELISA (чувствительность — 92%, специфичность — 98% ), который наряду с тестом непрямой гемагглютинации может быть полезным дополнением в случаях амебного абсцесса печени, особенно в эндемичных районах. Эффективными для протозойных инфекций признаны краткие курсы фармакотерапии метронидазола или тинидазола. Клиницистам рекомендуется периодически консультироваться со специалистами по микробиологии для своевременного перехода к новым диагностическим тестам на основе ELISA с большей чувствительностью и специфичностью.
Клиницисту необходимо учитывать эпидемиологическую ситуацию по ВИЧ в своем регионе и предлагать соответствующее тестирование. После выявления иммунодефицита рекомендуется исследовать пациента на наличие хронических инфекций такими патогенами, как Cryptosporidia или норовирус. Довольно часто причиной хронической инфекции является лямблиоз и амебиаз, диагностика которых основывается на повторном анализе свежих образцов кала (достоверность выявления яиц и кист составляет 60–90%). Выявление инфекции Giardia значительно облегчилось с использованием теста ELISA (чувствительность — 92%, специфичность — 98% ), который наряду с тестом непрямой гемагглютинации может быть полезным дополнением в случаях амебного абсцесса печени, особенно в эндемичных районах. Эффективными для протозойных инфекций признаны краткие курсы фармакотерапии метронидазола или тинидазола. Клиницистам рекомендуется периодически консультироваться со специалистами по микробиологии для своевременного перехода к новым диагностическим тестам на основе ELISA с большей чувствительностью и специфичностью.
Диагностика инфекции Clostridium difficile является исключением из общего алгоритма и требует вначале выявить наличие самого микроорганизма методом EIA (glutamate dehydrogenase enzyme immunoassay), амплификации нуклеиновых кислот или полимеразной цепной реакции (ПЦР), а затем отследить активное производство токсичных веществ возбудителя. Такая комбинация чувствительного, а затем специфичного теста при их согласованности дает высокие прогностические значения и определяет необходимость лечения. Клиницистам важно избегать чрезмерной антибиотикотерапии, основанной лишь на результатах ПЦР-тестирования и отсутствии конкретных данных о производстве токсинов, поскольку в случае с Clostridium difficile это может привести к постинфекционному синдрому раздраженного кишечника.
Рак или воспаление
Фекальный кальпротектин
Во время воспаления кальпротектин находится в просвете кишечника в достаточно стабильном состоянии, позволяющем выполнять необходимую диагностическую оценку. NICE (The National Institute for Health and Care Excellence), Великобритания, рекомендует использовать фекальный кальпротектин в качестве показателя при дифференциальной диагностике синдрома раздраженного кишечника и воспалительного заболевания кишечника у взрослых пациентов с недавними симптомами в нижних отделах желудочно-кишечного тракта при отсутствии предполагаемого онкозаболевания. Низкий уровень кальпротектина соответствует низкой вероятности воспалительного заболевания кишечника. По данным NICE, уровень кальпротектина, выше которого наличие воспалительного заболевания кишечника можно предположить с большей вероятностью, соответствует 50 мг/г фекалий. При этом следует помнить, что другие причины его повышения включают колоректальный рак, инфекционный гастроэнтерит и последствия применения нестероидных противовоспалительных препаратов.
Анализ на скрытую кровь/фекальный иммунохимический метод
Многие годы анализ на скрытую кровь в фекалиях использовали при диагностике колоректального рака. Относительно новый, иммунохимический метод, позволяет выявлять гемоглобин в каловых массах и обладает высоким прогностическим значением (0,99) с оптимальным граничным значением (7–10 мг/г фекалий). При надлежащем качестве исследования и клинического суждения использования фекального иммунохимического метода позволяет снизить необходимость в колоноскопии.
Эндоскопическая и гистологическая оценка
Большинство случаев хронической диареей требуют той или иной формы дополнительного эндоскопического исследования. Диагноз «синдром раздраженного кишечника» у пациентов молодого возраста (младше 40 лет) с диареей и прочей типичной симптоматикой функционального расстройства кишечника при отрицательных результатах начального исследования может быть установлен в условиях первичного уровня медико-санитарной помощи. Так, при колоноскопии в ходе скрининга выявляют аденому толстой кишки у бессимптомных пациентов в 14,4–37,5% случаев, в 7–31% — воспалительные заболевания кишечника и микроскопического колита. Илеоскопия еще больше повышает результативность эндоскопического исследования (до 18%), а в комплексе с биопсией позволяет выявить терминальный илеит. Фибросигмоскопия — еще один эндоскопический метод, используемый в основном при выявлении микроскопического колита, болезни Крона и язвенного колита. При хронической диарее неясной этиологии многие источники указывают на целесообразность выполнения полномасштабной колоноскопии. Эндоскопическое исследование верхних отделов желудочно-кишечного тракта бывает необходимо при диарее, обусловленной мальабсорбцией.
Визуализирующее исследование тонкого кишечника
Благодаря неинвазивности и доступности в качестве визуализирующего метода в последние десятилетия используют ультразвуковое исследование тонкого кишечника. Этот метод обладает высокой чувствительностью при выявлении терминального илеита, уступая в информативности только компьютерной и магнитно-резонансной томографии. Недостатки ультразвукового исследования включают трудность обзора всего пищеварительного тракта и высокую зависимость метода от оператора. Поэтому все чаще предпочтение отдается магнитно-резонансному и компьютерно-томографическому сканированию, в рамках которого разработаны специализированные процедуры визуализации тонкой кишки, такие как энтерография и энтероклизис. Выполнение обеих требует дополнительного контрастирования. Анализ фактических данных указывает на то, что в текущее время магнитно-резонансная и компьютерно-томографическая энтерография — наиболее эффективные методы диагностики малых кишечных аномалий у пациентов с хронической диареей, причем магнитно-резонансное сканирование оказывает меньшее лучевое воздействие на организм пациента, чем компьютерно-томографическая визуализация.
Капсульная эндоскопия
Капсульная эндоскопия рассматривается либо как метод для выявления малых аномалий в тонком кишечнике, либо дополнительной диагностики после нерезультативного радиологического исследования (магнитно-резонансного или компьютерно-томографического). Однако с учетом неинвазивного характера, хорошей переносимости и одобрения со стороны пациентов данный тип эндоскопии в некоторых клиниках используют в числе первых. Капсульная эндоскопия не рекомендована при сероположительном результате теста на целиакию, поскольку для верификации диагноза необходимо выполнить биопсию двенадцатиперстной кишки. Однако у пациентов, которые не могут или не желают проходить фиброгастроскопию, этот метод поможет выявить атрофию ворсинчатого эпителия.
Энтероскопия
Энтероскопия рассматривается как дополнительный метод (помимо капсульной эндоскопии и пассажа бариевой взвеси) выявления малых аномалий тонкого кишечника, либо оценки состояния тонкого кишечника после нерезультативного радиологического исследования. Ключевой особенностью энтероскопии при оценке воспаления или кровотечении неясной этиологии является неизменно высокая частота ложноотрицательных результатов предшествующей эндоскопии верхних и нижних отделов кишечника, что подтверждает важность адекватной визуализации и биопсии двенадцатиперстной и подвздошной кишки. Активная энтероскопия имеет определенную ценность для получения биопсийного материала в тощей кишке при определении редких причин диареи, например циклоспориазе, стронгилоидозе, повышении уровня IgA к тканевой трансглутаминазе.
Хологенная диарея
В текущее время известно, что ⅓ всех пациентов с синдромом раздраженного кишечника, где преобладающим симптомом является диарея, на самом деле имеют хологенную диарею по результатам SeHCAT-тестирования. Этот тип диареи отмечают также при болезни Крона, после холецистэктомии или инфицирования. При отсутствии позитивного ответа на лечение следует искать дополнительные причины (например избыточный бактериальный рост, панкреатическую недостаточность или микроскопический колит), даже если результат SeHCAT-тестирования был отрицательным. Хологенная диарея также распространена (>50%) в группе пациентов с онкозаболеваниями, перенесшими химио- и лучевую терапию тазовой области.
Микроскопический колит
Микроскопический колит, включающий две формы заболевания — коллагенозный и лимфоцитарный колит, обычно сопровождается хронической водянистой диареей без кровянистого отделяемого при незначительных (или отсутствии) эндоскопических аномалиях. Гистологические признаки этого заболевания отличают его от неспецифического язвенного колита и болезни Крона, но на макроскопическом уровне эти отличия не заметны. Микроскопическое исследование выявляет увеличение числа внутриэпителиальных и ламинальных лимфоцитов (>20/100 клеток) при обеих формах заболевания и утолщение субэпителиального коллагенового слоя (>10 мкм) при коллагенозном колите.
Общая распространенность микроскопического колита колеблется от 50 до 200 на 100 тыс. населения, причем обе его формы типичны для женщин (коллагенозного — 77%, лимфоцитарного — 68%), а средний возраст начала заболевания — около 60 лет. У пациентов молодого возраста (младше 45 лет) микроскопический колит отмечают в приблизительно 25% случаев. Нередко заболевание сопровождается ночной диареей и недержанием кала; также возможны прочие функциональные расстройства кишечника, включая синдром раздраженного кишечника смешанного типа или с преобладанием запоров. С микроскопическим колитом ассоциированы такие заболевания, как ревматизм, аутоиммунный тиреоидит и целиакия (около 5–7%). Хологенная диарея (диагностированная на основе SeHCAT) распространена как при коллагенозном (в среднем 41% (37–45%)), так и при лимфоцитарном типе (в среднем 29% (24–34%)) микроскопического колита. Улучшению симптомов может способствовать отмена текущей терапии нестероидными противовоспалительными препаратами и ингибиторами протонной помпы.
Диагноз микроскопического колита устанавливают на основе гистологического исследования слизистой оболочки толстой кишки, для чего обычно необходимо выполнить ряд биопсий. При этом макроскопические результаты колоноскопии могут быть нормальными. Надежного биомаркера для определения микроскопического колита не существует, однако может быть выявлено повышение уровня кальпротектина, предполагающее необходимость дальнейшего колоноскопического исследования. Наличие эффективного лечения (будесонидом) при микроскопическом колите ставит в обязанность задачу его диагностики у пациентов с хронической диареей.
Мальдигестия фруктозы, лактозы и многоатомных спиртов
Мальдигестия ферментируемых олиго-, ди-, моносахаридов и многоатомных спиртов является причиной диареи у пациентов с синдромом раздраженного кишечника и других групп пациентов (например с воспалительным заболеванием кишечника в ремиссии). Диета современного человека довольно часто содержит избыточное количество свободной фруктозы и глюкозы, превышающее абсорбционную способность тонкого кишечника (например безалкогольные напитки, подслащенные кукурузным сиропом). Таким образом, неусвоенная фруктоза переходит в толстую кишку и ферментируется тем же способом, что и лактоза у пациентов с дефицитом лактазы. Фруктоза, представляющая собой гексозный моносахарид, содержится в пищевых продуктах в двух основных формах — в виде дисахарида с глюкозообразующей сахарозой и в виде длинноцепочечных полимеров — фруктанов. Последние в высокой концентрации присутствуют в продуктах из пшеницы (хлеб, макаронные изделия). Ферментация фруктанов бактериями толстого кишечника является причиной «непереносимости пшеницы» у многих пациентов без целиакии. Аналогично сорбитол и другие неусваиваемые полиолы, используемые в качестве искусственных подсластителей, проходят неизмененными в толстый кишечник и при употреблении в больших количествах способны вызывать диарею.
Распространенность обусловленной генетически первичной лактазной недостаточности среди населения Северной Европы составляет 2–15%. Однако мальабсорбция фруктозы или фруктанов не имеет подобного генетического субстрата. У здоровых пациентов употребление 25 г фруктозы может повысить показатель выдыхаемого водорода до 40%, но при этом не будет связано с появлением симптомов. Этот факт вынуждает интерпретировать результаты водородного дыхательного теста с большой осторожностью, а углеводные нагрузки целесообразно использовать в целях идентификации причины симптомов и прогнозирования результатов лечения. По итогам ряда исследований в настоящее время диагностическая роль водородных дыхательных тестов для оценки непереносимости фруктозы не нашла достаточного обоснования.
Диарея после радиационного облучения
В последние годы наблюдается трехкратное повышение выживаемости пациентов, перенесших радиотерапию при онкозаболеваниях. Соответствующим образом возросло число пациентов с диареей после радиационного облучения. В целом исследование этих пациентов не отличается от такового при других типах диареи, за исключением узких диагностических рекомендаций для оценки поздних эффектов лучевой терапии.
Ускоренный кишечный транзит
Оценка нарушения моторики при ускоренном кишечном транзите усложняется тем, что:
а) это состояние имеет многофакторную этиологию;
б) используемые тесты ограничены в способности идентифицировать причину симптомов;
в) широкая вариабельность индивидуальной реакции исключает возможность определения окончательного диагноза во всех случаях, кроме особо тяжелых.
Детализировать изменения подвижности можно с помощью манометрии кишечника, особенно с использованием технологии высокого разрешения, позволяющей отчетливо визуализировать пропульсивные и ретроградные сокращения, препятствующие и способствующие кишечному транзиту. Аномальные результаты манометрии наблюдают при обструкции и тяжелой нервно-мышечной дисфункции, но они, как правило, не коррелируют с данными патоморфологического исследования биопсийного материала тонкого кишечника. Пациенты с синдромом раздраженного кишечника плохо переносят подобные вмешательства, а их результаты чаще всего не выявляют никаких аномалий. Поэтому данные методы исследований показаны в случае невозможности установить диагноз по итогам обширного традиционного комплекса оценки и отсутствия ответа на фармакотерапию. В будущем манометрия кишечника может быть заменена неинвазивной магнитно-резонансной томографией.
Оценка мальабсорбции
Мальабсорбция может возникать в результате недостаточности желчных кислот, снижения ферментативной активности, нарушения эпителиального транспорта при заболеваниях слизистой оболочки или структурных изменениях (фистулах, хирургической резекции). Как правило, дефицит абсорбции жиров, углеводов, белков, витаминов и минералов при этом состоянии сосуществует, однако эффекты одного из них могут преобладать. К примеру, экзокринная недостаточность поджелудочной железы является наиболее частой причиной тяжелой стеатореи, при которой экскреция фекального жира превышает 13 г/сут (47 ммоль/сут). Данная ситуация редко наблюдается при поражении слизистой оболочки или структурных заболеваниях кишечника, хотя более мягкая форма стеатореи является общим симптомом при мальабсорбции. Диагностические подходы включают либо выявление соответствующих соединений в фекалиях, либо определение уровня абсорбции веществ по анализу крови, мочи и других источников. Вариантом последнего является дыхательный тест, основанный на расщеплении и бактериальной ферментации искомого вещества.
Жировая мальабсорбция у взрослых обычно является следствием хронического панкреатита, панкреокарциномы или оперативного вмешательства на поджелудочной железе. Мальдигестия жира при этом может привести к стеаторее и потере массы тела, но может и не иметь клинически очевидных проявлений. Симптомы экзокринной недостаточности поджелудочной железы обычно развиваются спустя 10–15 лет после первых проявлений хронического панкреатита и характеризуются снижением секреции липазы и других ферментов до <10% нормы. Диагноз прогрессирующего хронического панкреатита у пациентов с диареей часто обосновывается клинической историей и подтверждается при исследовании (ультразвук, функциональные тесты), однако методы диагностики хронического панкреатита в начальной стадии или его легкой формы в настоящее время не разработаны.
Фекальная эластаза
Эластаза, наряду с химотрипсином и трипсином, относится к семейству пищеварительных ферментов, сериновых протеаз, и обладает уникальными свойством к деградации эластина. Определение уровня эластазы стало предпочтительным методом определения функции поджелудочной железы и в значительной степени заменило прочие инвазивные и непрямые тесты. Нормальное содержание фекальной эластазы составляет 200–500 мкг/г; значение 100–200 мкг/г соответствует умеренной недостаточности и <100 мкг/г — тяжелой недостаточности экзокринной функции поджелудочной железы. На результаты теста не влияют одновременное проведение ферментотерапии или диеты, а для его выполнения достаточно единоразового забора материала в объеме 100 мг. Однако следует помнить, что данный метод малопригоден для определения легких форм недостаточности поджелудочной железы и не дает возможности отличить ее от мальабсорбции, не связанной с панкреатической функцией.
Визуализирующие методы исследования
поджелудочной железы
Прогрессирующий воспалительный процесс, отмечаемый при хроническом панкреатите, приводит к значительным изменениям в структуре поджелудочной железы. Фокальная сегментарная или диффузная деструкция паренхимы происходит на ранних стадиях, в то время как структурные изменения, дилатация протока и кальцификация, как правило, происходят на поздних стадиях заболевания. Диагностика на стадии развития значительных морфологических изменений, а также оценка злокачественности выполняются предпочтительно с помощью компьютерной томографии. Чувствительность этого метода на ранних стадиях заболевания уступает магнитно-резонансной холангиопанкреатографии и эндоскопическому ультразвуковому исследованию. Последний метод, в частности, способен выявить умеренные изменения протоков и паренхиматозные аномалии, не наблюдаемые при компьютерно-томографическом исследовании. К тому же эндоскопическое исследование поджелудочной железы имеет эквивалентную диагностическую точность при выявлении хронического панкреатита на ранней и поздней стадии с тестами прямой секреторной функции поджелудочной железы.
Избыточный бактериальный рост в тонком кишечнике
По сравнению с толстым кишечником, в здоровом состоянии уровень бактериальной колонизации тонкого кишечника не столь высок (порядка 104 КОЕ/мл по сравнению с 109–1020 КОЕ/мл соответственно). Ряд исследователей сообщают, что анатомические или функциональные причины аномального ороцекального транзита повышают риск диареи и/или мальабсорбции. К таким предрасполагающим факторам относятся сахарный диабет, склеродермия, псевдообструкция кишечника, предшествующие хирургические вмешательства (например терминальная резекция подвздошной кишки), дивертикулез или стриктуры тонкой кишки. Также есть свидетельства о высокой распространенности избыточного бактериального роста в тонком кишечнике, связанного с ахлоргидрией у пациентов старческого возраста или в результате применения ингибиторов протонной помпы.
Одним из золотых стандартов выявления избыточного бактериального роста в тонком кишечнике является посев содержимого тонкой кишки. Положительным считается результат присутствия >106 КОЕ/мл в анаэробных или аэробных условиях, хотя возможны более низкие пороговые значения. Однако иногда избыточный рост энтерококков и колиформных бактерий возможен у явно здоровых людей, не имеющих признаков мальабсорбции.
Фекальное недержание
При фекальном недержании целесообразно направить пациента к специалисту хирургического профиля в том случае, если диарея не является основным тревожащим симптомом. Такие пациенты могут иметь недостаточность сфинктерного комплекса, который проявляется при диарее. Зачастую это люди с когнитивными или поведенческими нарушениями, трудностями в обучении или неврологическими и спинальными заболеваниями. Основной осмотр включает исследование аноректальной реактивности для выявления возможного пролапса прямой кишки.
Постоперационная диарея
Этиология постоперационной диареи обусловлена пилорической дисфункцией, мальабсорбцией желчных кислот, избыточным бактериальным ростом и байпас-редукцией, уменьшающей поглотительную способность кишечника. Операции на верхних отделах пищеварительного тракта могут привести к повреждению или делению блуждающего нерва, сопровождающегося снижением функции желудка. В результате быстрое опорожнение желудка может привести к осмотической диарее и связанному с ней демпинг-синдрому. Такие хирургические вмешательства, как операции по Бильрот-ІІ или гепатикоеюностомия по Ру, могут предрасполагать к застою и чрезмерному бактериальному росту из-за аномальной перистальтики и неэффективного расщепления задерживающейся пищи и ферментов. Такому же риску подвержены пациенты, которым выполнено еюноилеальное шунтирование, терминолатеральный энтероэнтеральный анастомоз или создание дистального подвздошного мешка Коха. Подобным образом к застою и избыточному бактериальному росту могут приводить стриктуры тонкого кишечника. Иногда похожие нарушения сопровождают болезнь Крона, возникают после лучевой терапии и как вторичные проявления лекарственной терапии.
Малые и обширные резекции кишечника явно снижают его поглотительную способность. В крайних случаях это приводит к развитию синдрома короткого кишечника, который клинически характеризуется хронической диареей, обезвоживанием, аномалиями электролитного баланса и потерей массы тела. Отдельную группу составляют структурные изменения, не связанные с хирургическим вмешательством, такие как фистулы при болезни Крона. Дивертикулы тонкого кишечника, отмечаемые у 1–6% населения, также могут быть причиной избыточного бактериального роста.
Редкие причины хронической диареи
Нейроэндокринные опухоли
Гормональные секретирующие опухоли относятся к одной из наиболее редких причин хронической диареи, развитие которой во многом зависит от типа опухоли (функциональная панкреатическая, гастринома, глюкагонома). Подтверждение диагноза в каждом отдельном случает требует выявления повышенной концентрации соответствующего гормона в сыворотке крови. Поскольку уровень гормона колеблется, анализ необходимо проводить во время эпизода диареи. Следует учесть, что повышению уровня гормонов могут способствовать сопутствующие заболевания, такие как сахарный диабет, почечная недостаточность, ревматоидный артрит, пернициозная анемия, атрофический гастрит и массивная терапия ингибиторами протонной помпы. Диарея также является характерным симптомом (до 50% случаев) при карциноидном синдроме, на долю которого приходится 20% нейроэндокринных опухолей средней кишки.
Ложная диарея
Ложная диарея, обусловленная злоупотреблением слабительными средствами, умышленным или неумышленным добавлением в каловые массы воды или мочи, признана относительно распространенным явлением (до 20%). В таких случаях может быть целесообразным проведение повторных анализов, поскольку прием слабительных может быть не постоянным. Установить вероятность злоупотребления слабительными средствами можно с помощью выявления антрахинонов, бисакодила и фенолфталеина в моче, определения уровня магния и фосфатов в кале.
Заключение
Первоначальная оценка пациентов с хронической диареей прежде всего должна направить усилия клинициста на определение необходимости дальнейшего исследования, сосредоточенного на конкретной области — тонком, толстом кишечнике или поджелудочной железе. Этот комплекс диагностических процедур целесообразно выполнить на уровне первичной медико-санитарной помощи. Поскольку большинство случаев хронической диареи обусловлены нарушениями в толстом кишечнике, ее исследование должно быть стратифицировано по возрасту, риску неоплазии и воспаления с учетом высокой распространенности хологенной диареи наряду с целиакией. Нормальные результаты базовых исследований у пациентов с хронической диареей свидетельствуют в пользу благоприятного прогноза заболевания, носящего идиопатический, самоограничивающийся характер, или являющегося ложным. Для данной группы пациентов может быть назначено симптоматическое лечение, а дальнейшие исследования не оправданы.
Подписывайтесь на наш Telegram-канал, Viber-сообщество, Instagram, страничку Facebook, а также Twitter, чтобы первыми получать самые свежие и актуальные новости из мира медицины.
- Arasaradnam R.P., Brown S., Forbes A. et al. (2018) Guidelines for the investigation of chronic diarrhoea in adults: British Society of Gastroenterology, 3rd ed., Gut, 67: 1380–1399.
Александр Гузий
Рак кишечника. С какими симптомами нужно срочно бежать к врачу | ЗДОРОВЬЕ
В последние десятилетия заболеваемость колоректальным раком выросла в разы. Если сравнивать ситуацию с 60-ми гг. прошлого века, то рак прямой кишки тогда составлял 1,2 % от всех злокачественных опухолей, рак ободочной кишки – 1,8 %. В 2017 г. статистика выглядит уже так: 5,2 % и 7,3 %, соответственно.
На днях в Пермском краевом онкологическом диспансере 74-летней пациентке сделали лапароскопическую операцию по удалению большой правосторонней опухоли кишечника. На хирургическое вмешательство, которое транслировали на экране в 3D-изображении, пригласили не только врачей-онкологов, но и журналистов.
После успешного завершения операции зам. главного врача пермского краевого онкодиспансера, доктор медицинских наук, профессор Олег Орлов рассказал о причинах, симптомах и диагностике опасного заболевания. Подробнее об этом читайте в материале «АиФ-Прикамье».
Где чаще болеют?
«Заболеваемость колоректальным раком растёт в богатых индустриально развитых странах, к которым можно отнести и Россию, – объясняет Олег Орлов. – Связано это, прежде всего, с изменением структуры питания. Люди нередко позволяют себе деликатесы: икру, осетрину, красную рыбу, копчёные колбасы. А подобная пища не позволяет кишечнику активно работать. Для хорошей перистальтики ему необходима грубая клетчатка и волокнистая ткань, которую содержат овощи и фрукты».
Результат питания деликатесами – это частые запоры. И лечение недуга – одна из проблем современного здравоохранения. Это становится настолько актуальным, что в странах, где хорошо развит туризм, уже учитывают этот факт. В отелях гостям на завтрак обязательно предлагают распаренный чернослив, курагу, инжир.
Факторы риска
Запоры являются основным из факторов риска онкологических заболеваний. Если кишечник опорожняется ежедневно и своевременно, то канцерогенные газы и каловые массы не успевают активно воздействовать на его слизистую оболочку. А в случае запоров концентрация и время воздействия шлаков на слизистую толстой и прямой кишки увеличивается.
Ещё один фактор риска рака кишечника – хронические колиты, когда воспалительный процесс проявляется сменой запоров и поносов. Человек испытывает дискомфорт и болевые ощущения в животе, у него нередки вздутия и бурления. Есть случаи, когда повышается температура.
«Массированная реклама лекарственных средств, которая идёт по ТВ, часто наносит пациенту большой вред. Чтобы снять симптомы, человек занимается самолечением, принимает рекламируемые препараты, сам толком не понимая, что у него в организме происходит. В итоге процесс обращения к врачу затягивается на годы. Необходимо запомнить следующее правило: если у вас есть проблемы со здоровьем, необходимо пойти к врачу-терапевту общего профиля. Он уже будет решать, обследовать вас или направлять к узкому специалисту», – говорит Олег Алексеевич.
Эндоскопические (через прокол) операции по удалению рака прямой кишки – более щадящие. Фото: АиФ/ Алёна ОвчинниковаЕщё к группе риска относятся те, у кого есть наследственное заболевание – семейный полипоз. Ведь злокачественная опухоль может развиться и из полипа. Если у кого-то из родных заболевание было, нелишним будет обратиться к врачу и пройти плановое обследование.
Мужская или женская проблема?
Исходя из опыта, злокачественная опухоль кишечника чаще встречается у женщин, чем у мужчин. Несмотря на то что женщины внимательнее следят за здоровьем, обнаружить рак прямой и ободочной кишки на ранних стадиях удаётся нечасто. И это общая проблема выявления онкологических заболеваний: на ранних стадиях они протекают бессимптомно. Поэтому многие пациенты приходят к врачам в лучшем случае на второй, а иногда и на третьей стадии рака.
Немалый процент заболевших обращается лишь тогда, когда у них обнаруживают четвёртую стадию болезни. Человек идёт к медикам по другой проблеме. Его беспокоят сильные боли в печени или непрекращающийся кашель, а обследование обнаруживает у него метастазы в лёгких и печени.
Врачи начинают искать первопричину и нередко обнаруживают рак толстой и прямой кишки. Когда начинают подробно расспрашивать пациента о самочувствии, выясняют, что проблемы были давным-давно, но с обращением к доктору он тянул до последнего.
«Вылечить четвёртую стадию невозможно, и об этом обязательно нужно знать! Конечно, можно сделать операцию, но она будет чисто паллиативной, для того чтобы продлить жизнь больному», – предупреждает доктор.
Вылечить четвёртую стадию рака невоможно. Можно сделать операцию, но она будет чисто паллиативной, для того чтобы продлить жизнь больному. Фото: АиФ/ Алёна ОвчинниковаВыявить рак на ранних стадиях, говорят медики, нередко можно в ходе обычной диспансеризации в поликлинике, ведь в общий осмотр обязательно входит пальцевое обследование прямой кишки. Другое дело, что пациенты сами нередко отказываются от проведения такой диагностики.
Какие симптомы должны насторожить?
Признаков колоректального рака немного, но если они есть, то стоит своевременно записаться к врачу.
Что должно насторожить? Для рака правой половины ободочной кишки характерно необоснованное повышение температуры. Она может подняться и держаться несколько дней, потом становится нормальной, а через какое-то время ситуация снова повторяется.
Далее – головокружения, связанные с анемией. Поскольку даже маленькая раковая опухоль всегда кровоточит, постепенно у человека возникает анемия. Стоит насторожиться, если заметили наличие тёмной крови и большое количество слизи в кале.Следующие симптомы – это ложные позывы, когда после опорожнения кишечника нет ощущения, что он пустой. Также пациента могут беспокоить точечные боли в правой половине живота. Это проявление развившегося воспаления на фоне злокачественной опухоли. Бывает, что опухоль справа иногда может прощупать и сам пациент, и врач.
При раке правой стороны кишечника не бывает непроходимости, пациента беспокоят ноющие боли, а при раке левой стороны, к сожалению, может развиться острая кишечная непроходимость. С резкой острой приступообразной болью люди попадают в экстренные хирургические отделения, и уже на операции у них обнаруживают опухоль.
Что делает врач?
Прежде всего узкий специалист-онколог проведёт пальцевое исследование прямой кишки. Это исключит геморрой и наличие полипов. Дальше он сам будет выстраивать методику обследования и лечения. Чаще, чтобы подтвердить диагноз, назначают обычное для таких заболеваний обследование – ректоскопию и колоноскопию.
Многих волнует вопрос: как быстро развивается рак прямой кишки? По мнению врачей-онкологов, все злокачественные опухоли развиваются от трёх до десяти лет до начала клинических проявлений. Поэтому любому заболеванию, когда его выявят, будет минимум три года. А вот за сколько времени процесс разовьётся от первой до четвёртой стадии, вам не скажет ни один врач. В этом вопросе всё индивидуально и зависит от уровня злокачественности опухоли, иммунитета человека и от множества других показателей.
Как проводят операцию?
Эндоскопические (через прокол) операции по удалению рака прямой кишки – более щадящие. Они позволяют пациенту быстрее покинуть хирургическое отделение и начать лечение, которое назначил врач. Однако эндоскопические операции делают в Пермском крае не так часто, как полостные.
Эндоскопические операции делают в Пермском крае не так часто, как полостные. Фото: АиФ/ Алёна ОвчинниковаВ ряде случаев у прооперированных пациентов случаются рецидивы. Пусковым механизмом проявления метастазов могут стать стрессовые ситуации, которые происходят с человеком: тяжело заболел гриппом, потерял близкого человека, уволили с работы, ограбили. В такой период у человека снижается уровень иммунного ответа и иммунной защиты, и раковые клетки начинают быстрее размножаться и проявляться как отдалённые метастазы.
От 50 до 60 % прооперированных больных колоректальным раком первой-третьей стадии переживают пятилетний рубеж. Статистика такова: если рак прямой кишки удалили на первой стадии – то более 80 % пациентов живут дольше пяти лет, на второй – 70 %, на третьей – 50 % и ниже.
Если говорить о профилактике рака, то всем кажется: не ешь одного, не пей другого, и будет тебе счастье. Однако первичной профилактики в онкологии не существует. Тем более от рака нельзя поставить прививку, как, например, от гриппа или кори. Однако прислушаться к организму и своевременно обратиться к врачам при перечисленных выше симптомах вам обязательно стоит!
Терапия послеоперационной тошноты и рвоты у пациентов, перенесших гастроэнтерологическую операцию
Актуальность
Послеоперационная тошнота и рвота являются самыми частыми осложнениями после хирургического вмешательства и встречаются более, чем у 30% пациентов.
Высокий риск развития постоперациооных тошноты и рвоты отмечается у лиц, перенесших лапароскопическую операцию и после продолжительной операции, согласно результатам мета-анализов. Во многих исследованиях говорится о высоким риске тошноты и рвоты после перенесены урологических и билиарных вмешательств. В одном из недавних исследований говорится о 35% частоте тошноты и рвоты после резекции кишки.
У пациентов с послеоперационной тошнотой и рвотой отмечается снижение аппетита в послеоперационном периоде, что может приводить к более длительному пребыванию в стационаре.
Целью исследования было определись снижает ли риск тошноты и рвоты предоперационное назначение дексаметазона у пациентов, у которых планируется вмешательство на кишечнике.
Дизайн исследования
Проведено рандомизированное исследование с двумя параллельными группами сравнения в 45 медицинских центрах Великобритании.
В анализ были включены 1350 пациентов в возрасте 18 лет и старше, которым проводилась плановая открытая или лапароскопическая операция на кишечнике по поводу доброкачественной или злокачественной патологии.
Пациентам вводили внутривенно 8 мг дексаметазона перед началом введения анестетиков или проводили стандартную терапию.
В качестве первичной конечной точки было выбрано развитие рвоты в течение 24 часов после операции. В качестве вторичных конечных точек были выбраны: рвота в течение 72 и 120 часов, репортируемые пациентом или врачом, частота послеоперационной тошноты и рвоты в течение 24, 72 и 120 часов, усталость и качество жизни через 120 часов и через 30 дней, время возвращения к приему пищи, длительность госпитализации и частота нежелательных явлений.
Результаты
Из 1350 пациентов 674 были включены в группу дексаметазона и 676 в группу стандартной терапии.
- Рвота в течение 24 часов после операционного вмешательства имела место у 172 участников, получавших дексаметазон (25.5%) по сравнению с 223 из контрольной группы (33.0%), P=0.003. Число пациентов, которое необходимо пролечить, чтобы предотвратить рвоту у одного больного (NNT) составило 13.
- Антиеметические препараты были назначены по требованию 285 лицам из группы дексаметазона (39.3%) и 351 пациенту из группы контроля (51.9%). Показатель NNT составил 8 (95% CI, 5-11; P<0.001). В течение 72 часов сниженная потребность в назначении препаратов сохранялась. Не было отмечено повышения частоты осложнений.
Заключение
Добавление внутривенно однократно дексаметазона в дозе 8 мг в начале анестететической терапии ассоциировано с достоверным снижением риска послеоперационной тошноты и рвоты в течение 24 часов и уменьшением потребности в введении антиеметических препаратов в течение 72 часов у больных, которым проводится операция на кишечнике.
Источник: DREAMS Trial Collaborators and West Midlands Research Collaborative. BMJ 2017;357:j1455.
Диарея после операции: причины, риски и лечение
Диарея — распространенное состояние, характеризующееся жидким водянистым стулом. Существует множество потенциальных причин диареи, включая инфекции, лекарства и нарушения пищеварения.
В некоторых случаях диарея может возникнуть и после операции.
В этой статье мы объясним, почему диарея может возникнуть после операции, а также факторы риска и варианты лечения.
Возможно, вы знаете, что тошнота и рвота могут быть частыми побочными эффектами операции.Однако иногда может возникнуть острая или хроническая диарея.
Острая диарея обычно проходит через день или два. Хроническая диарея — это диарея, которая длится не менее 4 недель.
Некоторые виды операций имеют более высокий риск хронической диареи. К ним относятся операции, в которых участвует:
Так почему же именно некоторые люди после операции испытывают хроническую диарею? Есть несколько возможных объяснений:
- избыточный бактериальный рост вокруг операционного поля
- более быстрое опорожнение желудка, чаще всего в результате операции на желудке
- плохое всасывание питательных веществ в кишечнике, особенно при удалении части кишечника
- увеличение желчи, которая может служить слабительным средством; это чаще всего происходит при операциях на желчном пузыре или печени
Вот несколько вещей, которые вы можете сделать дома, чтобы облегчить симптомы диареи:
- Поддерживайте водный баланс, выпивая большое количество жидкости, например воды, соков или бульонов.
- Выбирайте продукты, которые легче перевариваются, например тосты, рис и картофельное пюре.
- Избегайте продуктов с высоким содержанием клетчатки, жиров или молочных продуктов. Также старайтесь избегать кислых, острых или очень сладких продуктов.
- Избегайте напитков, содержащих алкоголь, кофеин или газированных напитков.
- Расслабьтесь в теплой ванне, чтобы уменьшить дискомфорт в животе или прямой кишке.
- Попробуйте принимать пробиотики, чтобы повысить уровень полезных бактерий в пищеварительном тракте.
- С осторожностью используйте безрецептурные препараты.В некоторых случаях такие лекарства, как субсалицилат висмута (пепто-бисмол) или лоперамид (имодиум), могут помочь уменьшить симптомы. Однако, если ваши симптомы вызывает инфекция, эти лекарства не помогут и могут быть потенциально опасными.
Если ваша диарея длится более двух дней или у вас есть ребенок, который страдает диареей более 24 часов, немедленно обратитесь за медицинской помощью.
Острый случай диареи обычно проходит сам по себе через пару дней домашнего ухода.С другой стороны, хроническая диарея может длиться несколько недель.
Но что такое диарея в норме? Хотя диарея определяется как три или более водянистых испражнения в день, важно обратиться к врачу, если вы испытываете шесть или более случаев в день.
Риски
Диарея связана с некоторыми потенциально серьезными рисками для здоровья. Эти состояния могут быстро стать серьезными или даже опасными для жизни.
Обезвоживание
Из-за потери жидкости и электролитов диарея может быстро привести к обезвоживанию.Симптомы могут отличаться у взрослых и детей.
Некоторые симптомы, на которые следует обратить внимание у взрослых, включают:
- повышенная жажда
- сухость во рту
- очень мало или совсем нет мочи
- темная моча
- слабость или утомляемость
- ощущение легкомысленности или головокружения
- запавшие глаза или щеки
Помимо жажды, сухости во рту, запавших глаз и щек, обезвоживание у детей может также иметь следующие симптомы:
- плач, но не слезы
- отсутствие мокрых подгузников в течение 3 часов или более
- сонливость или невосприимчивость
- повышенная раздражительность
Плохое усвоение питательных веществ
Если у вас диарея, возможно, вы не сможете эффективно усваивать питательные вещества из продуктов, которые вы едите.Это может привести к дефициту питательных веществ. Некоторые признаки, которые могут указывать на то, что ваш пищеварительный тракт плохо усваивает питательные вещества, включают:
Если у вас диарея, важно немедленно обратиться за медицинской помощью, если у вас есть какие-либо из следующих симптомов:
Продолжительность времени, в течение которого симптомы сохраняются тоже имеет значение. Обратитесь к врачу, если диарея продолжается более двух дней. Обязательно обратитесь к педиатру, если у ребенка диарея более 24 часов.
Если вы обратитесь за медицинской помощью в связи с серьезным приступом диареи, первое, что сделает ваш врач, — это изучит вашу историю болезни и проведет медицинский осмотр.
Ваш врач спросит вас о ваших симптомах и о том, как долго они у вас есть. Обычно они также спрашивают о недавних операциях и основных заболеваниях.
В дополнение к медицинскому осмотру ваш врач может назначить определенные анализы, чтобы попытаться определить причину диареи. Это может включать анализы кала, крови, компьютерную томографию или, возможно, эндоскопию.
Ниже приведены некоторые способы лечения вашего состояния:
- Регидратация. Диарея может вызвать потерю жидкости и электролитов, поэтому часть плана лечения, вероятно, будет сосредоточена на их восполнении. Если вы не можете удерживать жидкость, вы можете получить ее внутривенно.
- Антибиотики. Если бактерии вызывают инфекцию, вызывающую диарею, вам могут назначить антибиотики для лечения инфекции.
- Корректирующие лекарства. Некоторые лекарства могут вызывать диарею. Если вы принимаете одно из них, врач может скорректировать дозировку или переключить вас на другое лекарство.
- Лечение основного заболевания. Если симптомы вызывают основное заболевание, могут быть рекомендованы определенные лекарства или, возможно, операция.
Лечение хронической диареи
Если у вас хроническая диарея после операции, ваш врач может начать с прописывания лекарств и рекомендаций по изменению диеты, направленных на контроль симптомов до тех пор, пока ваше тело не адаптируется.
Как только ваше тело достигнет нового баланса, можно будет прекратить прием лекарств и избавиться от диареи.
В других случаях вам может потребоваться постоянное или даже пожизненное использование лекарств для контроля или минимизации эпизодов диареи.
Иногда облегчение может принести повторная первичная операция. Однако это сложное решение, которое вам нужно будет обсудить со своим хирургом.
Хотя диарея может иметь множество причин, она также может быть побочным эффектом хирургического вмешательства, особенно операций на брюшной полости. Это может быть связано с множеством факторов, включая чрезмерный рост бактерий или плохое усвоение питательных веществ.
При правильном уходе за собой диарея часто проходит сама по себе. Однако, если у вас диарея более двух дней или если у ребенка диарея более 24 часов, обязательно получите немедленную медицинскую помощь.
Колэктомия — UTMC
Колэктомия — это хирургическая процедура по удалению всего или части толстой или толстой кишки. При частичной колэктомии хирург удаляет только часть толстой кишки. Затем кишечник повторно соединяется, или на брюшной стенке создается отверстие кишечника (стома), позволяющее содержимому кишечника выходить из организма.Колэктомия может потребоваться для лечения рака толстой кишки.
Диета после колэктомии
После удаления части толстой кишки могут возникнуть проблемы с кишечником. Наиболее частыми проблемами являются диарея, запор, избыточное газообразование и обезвоживание. Эти симптомы возникают из-за того, что нормальные функции толстой кишки, такие как поглощение жидкости, еще не вернулись к норме. Эти проблемы можно решить, если внимательно следить за диетой и потреблением жидкости. Будьте терпеливы и медленно прогрессируйте.Небольшие порции производят меньше газа. Лучше всего принимать пищу через равные промежутки времени, по крайней мере, 3 раза в день.
Следующие продукты легко усваиваются и могут уменьшить количество и частоту диареи:
- Яблочное пюре
- арахисовое масло
- бананов
- картофель
- Рис белый вареный
- крендели
- хлеб или тосты
- злаки без сахара (Cheerios, Total, кукурузные хлопья)
- сыр
- крем рисовый
- тапиока
- манная крупа
- слабых чаев
- пищевые добавки с клетчаткой (волокнистые вафли лучше всего подходят для объемного стула)
- йогурт
- зефир
- макаронные изделия
Следующие продукты могут вызвать жидкий стул или диарею:
- Печеные бобы
- горячие напитки или супы
- пиво
- лакричник
- брокколи
- капуста цветная
- Брюссельская капуста
- Кале
- капуста
- сливовый сок
- шоколад
- красное вино
- фасоль сушеная
- шпинат
- не более 2 чашек кофе / день
- очень обильные обеды
- Сильно пряные продукты
Следующие продукты могут выделять чрезмерное количество газа:
- яблоки
- цитрусовые
- абрикосы
- Баклажан
- рогалики
- пончики
- салат
- зародыши пшеницы
- молоко и молочные продукты
- фасоль сушеная
- лук
- сельдерей
- выпечка
- Брюссельская капуста
- капуста
- морковь
- сливовый сок
Обезвоживание
Первым признаком обезвоживания является чувство жажды, за которым следуют симптомы усталости, слабости и обморока.Важнейшим признаком является концентрация мочи и частота мочеиспусканий. Вы должны мочиться не менее 4 раз в день, цвет должен быть от прозрачного до светло-желтого. Мочеиспускание менее 4 раз в день или моча темно-желтого или оранжевого цвета является признаком обезвоживания. Обезвоживание после колэктомии чаще всего вызвано частым жидким стулом или диареей.
Как регидратировать
Пополните себя безалкогольными напитками без кофеина.Лучшая регидратирующая жидкость — это вода. Другие варианты: Gatorade, разбавленный апельсиновый сок, слабые чаи без кофеина, бульонный кубик в горячей воде.
Запор
После колэктомии запор может возникать после периодов диареи и быть довольно болезненным. Первый шаг — увеличить потребление воды, а затем увеличить ежедневные упражнения. Регулярные ежедневные упражнения значительно помогают регулировать нормальную работу кишечника. Затем медленно добавляйте в свой рацион клетчатку.Натуральные варианты включают отруби, цельнозерновые хлопья, свежие фрукты, овощи и цельнозерновой хлеб. Кроме того, без рецепта продаются волокнистые вафли, которые можно принимать ежедневно или дважды в день по мере необходимости.
Диарея
После колэктомии способность толстой кишки поглощать воду на какое-то время снижается. Со временем оставшаяся часть толстой кишки научится поглощать необходимую вам воду. В этот начальный период времени необходимо несколько стратегий, чтобы избежать обезвоживания.
Во-первых, пейте много воды и обращайте внимание на количество мочеиспусканий в день. Сосредоточьтесь на продуктах, которые помогут замедлить работу кишечника (см. Список продуктов), и избегайте продуктов, которые усугубят диарею. Медленно добавляйте клетчатку. Волокнистая вафля может помочь увеличить объем стула, чтобы он не был таким рыхлым.
Если опорожнение кишечника превышает четыре раза в день, то для замедления его опорожнения можно осторожно добавить без рецепта лоперамид. Начните с одной таблетки утром и вечером.Избегайте запоров, так как возникающие при этом симптомы могут быть довольно болезненными. Выносите 2–3 испражнения в день, даже если он свободен, пока толстая кишка не станет более регулируемой. Может пройти 3-4 месяца, прежде чем ваш кишечник нормализуется.
Источники
- Руководство Morrison Healthcare по клиническому питанию, 2014 г.
- www.nlm.nih.gov/medlineplus/ency/patientinstructions/000153.htm, по состоянию на 8 апреля 2014 г.
Разработано: апрель 2014 г.
Хроническая диарея после операции по поводу рака толстой кишки — частота, причины и варианты лечения
Цель: Растущее число выживших после рака толстой кишки требует повышенного внимания к долгосрочным результатам хирургического лечения.Изменение анатомии кишечника после резекции нарушает нормальную функцию желудочно-кишечного тракта и может вызвать симптомы. Таким образом, многим пациентам, пережившим рак толстой кишки, приходится всю оставшуюся жизнь бороться с дисфункцией кишечника. Здесь мы стремимся предоставить обзор литературы по этой теме.
Методы: Мы рассматриваем отдаленные функциональные результаты хирургического лечения рака толстой кишки, лежащую в основе патологию и варианты лечения.
Результаты: Общие симптомы включают запор, позывы к дефекации и диарею. Причины диареи после операции по поводу рака толстой кишки изучены мало, но они, вероятно, включают мальабсорбцию желчных кислот, избыточный бактериальный рост в тонком кишечнике и нарушение подвздошного тормоза. Следует поставить конкретный диагноз, чтобы позволить индивидуальное лечение в зависимости от основной патологии.Исследований по лечению функциональных проблем после хирургического вмешательства по поводу рака толстой кишки крайне мало, но некоторые уроки можно извлечь из лечения других групп пациентов, перенесших операцию на толстой кишке.
Заключение: Диарея, вероятно, является распространенным долгосрочным осложнением после операции по поводу рака толстой кишки. Внимание к этому осложнению и конкретный диагноз помогут целенаправленно лечить пациентов, страдающих этим осложнением.
Ключевые слова: Мальабсорбция желчных кислот; Хирургия рака толстой кишки; Осложнения рака толстой кишки; Диарея.
Хроническая диарея у выживших после лечения колоректальным раком
Раннее обнаружение рака и новые химиотерапевтические препараты привели к увеличению выживаемости после диагностики колоректального рака. По оценкам Американского онкологического общества, в Соединенных Штатах проживает более 1 миллиона человек, переживших колоректальный рак.Текущие показатели 5-летней выживаемости для всех стадий рака толстой кишки и рака прямой кишки составляют 65% и 66% соответственно; поэтому наблюдение за пациентами на предмет долгосрочных последствий рака и его лечение является важной необходимостью [1]. Поскольку люди живут дольше, управление побочными эффектами для обеспечения хорошего качества жизни имеет первостепенное значение. В этой статье будет рассмотрено влияние хронической диареи на выживших после лечения колоректальным раком.
Обзор пациента
В марте 2008 года г-н К., 52-летний школьный учитель, обратился к своему терапевту с диареей и болями в животе, которые не прекращались в течение последнего месяца.Колоноскопия выявила поражение прямой кишки размером 3 см. Г-ну С. была проведена трансабдоминальная резекция с колостомией, и ему был поставлен диагноз: рак прямой кишки T2, N2, M0. Он был включен в клиническое испытание и получал схему, которая включала FOLFOX (5-FU, лейковорин, оксалиплатин [Eloxatin]) с последующей непрерывной инфузией 5-FU и лучевой терапией.
ТАБЛИЦА 1
Общие терминологические критерии диареи 3,0
В то время как г-н К. испытал диарею 1 степени во время лечения по схеме FOLFOX, проблема обострилась до 3 степени к концу лучевой терапии (таблица 1).Диарея уменьшилась на протяжении всего периода выздоровления, но по состоянию на март 2009 года он продолжает жаловаться на жидкий стул от четырех до шести в день. Г-н С. живет в сельской местности и наблюдает за своим лечащим врачом. На данный момент, однако, его диарея продолжается так долго, что он не хочет обсуждать ее. Пахучий понос возникает в течение часа после еды, и он сообщает, что это существенно мешает его преподавательской работе и общественной жизни.В то время как он и его жена любили ужинать с друзьями, он сообщает, что не хочет обедать вне дома. По выходным он сидел дома, и его жена обеспокоена его депрессией.
Социальная изоляция г-на К. побудила его жену позвонить навигатору по колоректальному раку, медсестре, с которой они познакомились, когда г-н К. проходил курс лечения рака в городском онкологическом центре. Навигатор по раку назначает встречу для пары, чтобы оценить и обсудить хроническую диарею мистера К.Путем всесторонней оценки навигатор определяет, что г-н С. страдает диареей 2 степени, которая влияет на его повседневную деятельность. История диеты показывает, что он выпивает двойной латте эспрессо каждое утро и двойной холодный кофе на обед каждый день. Его диета также бедна клетчаткой. Навигатор обсуждает влияние кофеина на перистальтику кишечника и рекомендует напитки без кофеина до исчезновения диареи. Она сообщает г-ну К., что молочные продукты также могут способствовать возникновению проблемы.Диета BRATTY (бананы, простой рис, яблочное пюре, тосты, чай и йогурт) рассматривается как краткосрочное вмешательство наряду с режимом приема низких доз лоперамида.
Г-н К. вернулся домой и попробовал диету BRATTY в течение 4 дней в сочетании с формовщиком массы с адекватной гидратацией и режимом низких доз лоперамида. Частота диареи снизилась до одного или двух раз в день. Постепенно он ввел в рацион другие продукты, но исключил из своего рациона кофеин и молоко. Год спустя он вернулся к преподаванию на полную ставку и сообщает о хорошем контроле над диареей.Он больше не принимает лоперамид, но продолжает соблюдать рекомендованное диетическое питание. Он и его жена снова проводят время с друзьями.
Определение проблемы
Диарея определяется как состояние частого и водянистого испражнения. [2] К сожалению, существует ограниченное количество исследований, посвященных изучению хронической диареи у выживших после рака. Частота хронической диареи колеблется от 14% до 49%, а эпизоды диареи могут сохраняться до 10 лет после лечения. [3] Выжившие после рака прямой кишки чаще сообщают о хронической диарее, чем выжившие после рака толстой кишки.
Некоторые препятствия могут помешать признанию этого вредного симптома и вниманию к нему. Во-первых, пациенты могут привыкнуть к диарее во время лечения и могут почувствовать, что это естественное последствие колоректального заболевания. Во-вторых, контрольные визиты могут продолжаться у поставщиков первичной медико-санитарной помощи, которые менее знакомы с такими долгосрочными токсическими эффектами, как диарея, и их лечением. [4]
Важность проблемы
Управление жизнью с хронической диареей может быть сложной задачей как в психосоциальном, так и в социальном плане, и выжившие после колоректального рака сообщают, что испытывают значительные страдания, связанные с тяжелой диареей.[4] Одно исследование отметило, что, когда респонденты упоминали проблемы с хронической диареей, они также имели тенденцию сообщать о более частых мыслях о смерти, ограничениях в своей деятельности и о большем дискомфорте, что, в свою очередь, оказывало влияние на качество жизни. [5] Пациенты, сообщавшие о симптомах, связанных с диареей, также сообщали о других проблемах, включая страх, плохой образ тела и проблемы с уверенностью в себе. [3] Кроме того, люди, получавшие лучевую терапию по поводу рака прямой кишки, подвергались более высокому риску диареи, и этот симптом оказывал влияние как на их социальное функционирование, так и на способность выполнять повседневную деятельность.Другое исследование показало, что у некоторых пациентов, перенесших лучевую терапию по поводу рака прямой кишки, развилась пояснично-крестцовая плексопатия, которая не только усугубляла боль, которую было трудно контролировать, но также вызывала дисфункцию кишечника, ведущую к опасению рецидива болезни.
Этиология
Проблема хронической диареи у выживших после колоректального рака является многофакторной. Наибольшие риски связаны с лучевой терапией и типом хирургического вмешательства. Во-первых, радиационные эффекты, такие как клеточное повреждение и рубцевание или фиброз, могут привести к проблемам с абсорбцией кишечника, что способствует диарее.[7] При лечении рака прямой кишки как предоперационная, так и послеоперационная радиация повышала риск хронических проблем с кишечником. [8] Эти проблемы включали учащение дефекации, недержание мочи, ношение прокладок и неспособность отложить опорожнение кишечника. Симптомы могут проявляться в течение 5 лет после лечения, при этом некоторые пациенты сообщают об аноректальной дисфункции даже через 10 лет после облучения. [9] Во-вторых, важно отметить тип хирургического вмешательства. Одно исследование показало, что пациенты, перенесшие переднюю резекцию, сообщали о более частых и неотложных позывах к диарее, а те, кому была установлена стома, также подвергались большему риску.[10] Чем выше расположена стома в желудочно-кишечном тракте, тем выше вероятность возникновения диареи. Сообщалось о трудностях с адаптацией к стоме для достижения регулярного кишечника и предотвращения пахнущей диареи. Обучение и предоставление ресурсов во время операции являются обязательными для пациентов, которые получают лучевую терапию или имеют переднюю резекцию или постоянную стому, поскольку они могут быть более склонны к частому жидкому стулу. [4]
Лечение диареи
Модификация диеты, лекарства и натуропатические альтернативы — это основные методы лечения, направленные на облегчение этой проблемы.Можно рекомендовать диету BRAT из бананов, простого риса, яблочного пюре и тостов, рекомендованную Национальным институтом рака, или диету BRATTY (BRAT плюс чай и йогурт) [11]. Обе диеты содержат много полезных питательных веществ и довольно переносимы. Бананы заменяют калий, потерянный в большом объеме стула, в то время как рис и тосты содержат полезные крахмалы и сахар, которые обычно образуются в стуле. Яблочное пюре содержит натуральный наполнитель пектин. Йогурт в диете BRATTY содержит как белок, так и активные культуры для поддержания естественной флоры толстой кишки, тем самым способствуя регулярному испражнению.Важно подтвердить, что потребляемый йогурт действительно содержит активные культуры и что он, по возможности, естественно подслащен, поскольку искусственные подсластители могут вызвать или усугубить диарею. Как для диет BRAT, так и для BRATTY, рис и тосты следует есть в чистом виде, потому что такие добавки, как масло и специи, могут фактически усугубить диарею. Пациентам следует пить чай без кофеина, а не чай с кофеином, поскольку кофеин может стимулировать работу кишечника и повысить вероятность диареи.
Ограничения в еде и соблюдение диеты могут быть трудными, особенно для тех, у кого будет постоянная стома.Медсестры должны оценить, какая часть кишечника остается, чтобы определить, как лучше всего информировать пациентов о том, какие продукты могут быть подходящими или привести к диарее. Кроме того, рекомендации по питанию должны быть сбалансированными и не приводить к дальнейшему истощению [12].
ТАБЛИЦА 2
Противодиарейные средства
Лекарства [13] и натуропатические альтернативы, такие как пробиотики [14–16], могут быть использованы для предотвращения диареи и восстановления нормальной функции кишечника. В то время как большинство противодиарейных препаратов не рекомендуются для длительного применения, лоперамид из-за его низкого профиля токсичности долгое время применялся в низких дозах.[17] Если люди используют противодиарейные средства, медсестры и врачи должны подчеркнуть этим пациентам, что им необходимо внимательно и регулярно проконсультироваться с врачом, чтобы изучить альтернативные решения их диареи. В таблице 2 выделены различные агенты, которые помогают предотвратить или контролировать диарею.
Уход за больными
Поскольку медсестры находятся на переднем крае ухода за пациентами, мы должны осознавать диарею как потенциальное долгосрочное осложнение у выживших после колоректального рака.Оценка диареи, обучение пациентов и психологическая поддержка являются основными обязанностями медсестры.
Во-первых, медсестры должны проводить всестороннюю оценку диареи у выживших после колоректального рака при каждом последующем посещении. Медсестры должны спрашивать не только о количестве стула в день, но и об объеме диареи, который испытывает пациент, и о ее влиянии на повседневную жизнь. Для определения степени тяжести диареи пациента часто используется шкала оценок, такая как Критерии общей терминологии для нежелательных явлений (CTCAE) (Таблица 1).[2]
ТАБЛИЦА 3
Диетические рекомендации при диарее
Во-вторых, медсестры должны информировать пациентов о необходимости сообщать о диарее на ранних этапах лечения колоректального рака. Без образования и поощрения сообщать о симптомах выжившие могут почувствовать, что проблема неизбежна, и не смогут решить свои проблемы во время последующих посещений. Кроме того, лечение и последующее наблюдение могут быть переданы от онколога к поставщику первичной медико-санитарной помощи, который может не полностью понимать побочные эффекты лечения.Это может создать барьер для выживших после рака, обращающихся за помощью при хроническом заболевании, таком как диарея. [3] Ресурсы, касающиеся лечения, изменения диеты и поддержки стомы, также необходимо предоставить при первоначальном диагнозе, чтобы помочь выжившим справиться с болезнью на протяжении всей траектории болезни. Диетическое руководство включено в Таблицу 3.
В-третьих, борьба с хронической диареей и многочисленные диетические и медицинские методы лечения для ее контроля могут потребовать много времени и очень трудно для выживших, что приведет к их отказу от нормальной повседневной деятельности и очередь, приводящая к социальной изоляции.Следовательно, медсестры играют основную роль в психосоциальной помощи, признавая симптомы, предлагая варианты лечения и поддержку. Хотя исследования долгосрочных побочных эффектов диареи у выживших после колоректального рака ограничены, существует стойкая отрицательная корреляция с качеством жизни тех, кто страдает этим хроническим осложнением [18].
В целом, поскольку все большее число пациентов после постановки диагноза колоректального рака живут дольше, важно, чтобы врачи и медсестры предприняли шаги, чтобы помочь им улучшить качество своей жизни.В случае выживших после колоректального рака этого часто можно добиться за счет оптимального лечения диареи.
Раскрытие финансовой информации: Авторы не имеют значительной финансовой заинтересованности или иных отношений с производителями каких-либо продуктов или поставщиками каких-либо услуг, упомянутых в этой статье.
Контроль диареи у пациентов с синдромом короткой кишки
Диарея — это трудная проблема, особенно для человека с короткой кишкой синдром (СБС).Причины диареи сильно различаются в зависимости от типа резекции. или степень утраченной функции кишечника. Признавая, что стратегия, которая работает для одного пациента SBS может не работать для другого, в этой статье рассматриваются некоторые из самые последние идеи диетического менеджмента, найденные в профессиональной литературе. Также включена информация Американского общества парентеральных и Клинический конгресс по энтеральному питанию (A.S.P.E.N.).
Как SBS приводит к диарее
Желудочно-кишечный тракт состоит из двух основных части — тонкий кишечник и толстый кишечник (также называемый толстой кишкой и прямая кишка).У взрослых тонкий кишечник составляет примерно 20 футов, а длина толстая кишка примерно 7 футов. Синдром короткой кишки (SBS) определяется в разными способами, но часто это относится к тонкой кишке, которая была резецирована или сокращается на 50 процентов или более. Выпадение тонкой кишки особенно проблематично, если это связано с потерей нижней подвздошной области и подвздошно-слепой кишки клапан.
Желудочно-кишечный тракт является основной транспортной системой питательных веществ к войти и использоваться телом.Пища и жидкости, принимаемые внутрь, должны быть переваривается или изменяется химически, так что питательные вещества могут быть поглощены и использованы для энергия, рост и поддержание жизни. В частности, тонкий кишечник переваривает и поглощает пищу, а толстый кишечник поглощает остатки соли, минералы и вода. У пациентов с короткой кишкой толстая кишка также сохраняет калорий. Оставшиеся неперевариваемые отходы ферментируются бактериями, смазываются и хранятся до тех пор, пока они не будут изгнаны с калом через прямую кишку.Любые значительное изменение в желудочно-кишечном тракте, например, потеря любой части тракта, может вызвать сбой в этом очень эффективном процессе. Эти изменения могут привести при быстром прохождении питательных веществ через желудочно-кишечный тракт или при диарее.
Любой, кто потерял большую часть толстой кишки, потеряет или диарейный стул, поскольку именно здесь происходит реабсорбция воды. В кишечник обычно поглощает от двух до трех литров принятой пищи и воды, а также от семи до девяти литров секретируемой жидкости в день.Пациенты без дистилляции малые кишечник, подвздошно-слепой клапан и толстая кишка могут терять от трех до пяти литров жидкости в день это не может быть поглощено. Даже без еды будет потеряна жидкость. Иногда пероральный прием действительно усугубляет проблему, увеличивая чистоту потеря жидкости у этих пациентов.
Рекомендации по питанию
Уильям Д. Хейзер, доктор медицины, из Северного университета Каролина, Чапел-Хилл, обсудила несколько стратегий лечения на недавней конференции ASPEN. Клинический конгресс.(Примечание , эти предложения не для немедленной публикации оперативная диета, но используются позже, после некоторой адаптации и регулярного продукты можно переносить.) Чтобы помочь контролировать диарею, он посоветовал людям с SBS питают себя богатых питательными веществами, плотных продуктов, таких как хлеб, крупы, мясо, птица, рыба и яйца. Рекомендуется от шести до восьми кормлений в день. В конце концов, человек SBS возможно, придется съесть в три раза больше обычных калорий, чтобы чтобы организм усвоил достаточно питательных веществ.
Кроме того, диета должна быть индивидуализирована с учетом переносимости человека. Рекомендации по питанию, приведенные в таблице, могут помочь вам избавиться от проблемные продукты. Например, многим пациентам с короткой кишкой следует избегать еды. содержащие лактозу, например молоко и молочные продукты.
Еще одно изменение диеты, которое может помочь уменьшить диарею у Пациентам с короткой кишкой следует пить жидкости комнатной температуры между приемы пищи, пациенты с SBS могут также захотеть попробовать наполнитель, такой как Metamucil, или увеличить потребление продуктов с высоким содержанием в растворимых волокнах (пектины / камеди), таких как овсянка, груши и картофель.Если При необходимости рацион можно дополнить жидкими или жевательными витаминами и минералы. Многие пациенты считают, что стандартные жидкие пищевые добавки удобные, насыщенные питательными веществами закуски; однако формула должна быть низкой осмолярность и без лактозы. Более дорогие элементарные или олигомерные продукты могут не принести больше пользы из-за их более высокой осмолярности.
Жирный спор
В течение многих лет стандартная терапия для пациентов с SBS в Западной страны придерживались высокобелковой диеты с ограниченным потреблением жиров (от 30 до 40 граммов в день), который частично дополнен триглицеридами со средней длиной цепи (MCT) масло.Большая часть калорий в этой диете поступает из сложных углеводов.
В отличие от своих западных аналогов, многие российские пациенты получали диеты с высоким содержанием жиров. Несколько исследований, посвященных этому пришли к выводу, что диета с высоким содержанием жиров хорошо переносится, если пациент отсутствует подвздошная область тонкой кишки и толстой кишки (где неабсорбируется жир вызывает активную секрецию соли и воды). Эти исследования также указывают на то, что диета с высоким содержанием жиров часто более вкусна.
Альтернативы лекарствам
Помимо диетических изменений, некоторые лекарства могут помочь контролировать понос. Например, блокаторы на ранних стадиях могут сократить 50% потерь короткого кишечника. Наркотики которые замедляют перистальтику кишечника, также могут уменьшить диарею, такие как Имодиум, Ломотил, дезодорированная настойка опия и жидкого кодеина. Кроме того, если толстая кишка В настоящее время низкие дозы холестирамина могут помочь связать некоторые из неабсорбированных соли кишечника и, таким образом, уменьшают выработку.
Оптимальная диета для человека с SBS будет варьироваться в зависимости от степень утраченной функции кишечника. Часто лучший способ определить успешный диета осуществляется методом проб и ошибок. Помните, все, что попадает в рот, имеет потенциал обеспечить питательными веществами и / или привести к диарее. По этой причине это необходимо внимательно следить за питанием и обращать пристальное внимание на реакцию дополнительного выхода жидкости с целью исключения проблемных продуктов. Пристальное внимание Также следует соблюдать лечебный режим, назначенный врачом.Если проблемы становятся серьезными, пациенту с SBS следует работать с врачом или зарегистрированный диетолог для контроля симптомов. Конечная цель диетической терапии заключается в уменьшении частоты и объема диареи при одновременном обеспечении пищевые потребности человека.
Рекомендации по питанию, которые могут помочь при диарее |
Продукты, которые могут усилить диарею
|
Продукты, которые могут контролировать диарею
|
Осложнения здоровья после резекции толстой кишки
Q1. Семь месяцев назад мне удалили ступню толстой кишки из-за рака. К счастью, 33 лимфатических узла были чистыми, и мне не потребовалась химиотерапия или лучевая терапия. После операции у меня частый понос. Является ли это обычным явлением после операции такого типа?
Да, диарея может быть следствием перенесенной вами операции.Со временем это должно улучшиться. Однако, если он не исчезнет, вам следует проконсультироваться с гастроэнтерологом для дальнейшей оценки и рассмотрения возможного лечения.
2 кв. За последние несколько месяцев я заметила кровь в стуле. Это длится день или два, затем проходит. Есть ли повод для беспокойства? Это симптом рака толстой кишки?
Не обязательно, но вам следует проверить это. Ярко-красная кровь в стуле может указывать на ряд вещей.Наиболее распространенным является незначительное кровотечение из геморроя, которое слегка сочится при дефекации. Хотя геморрой, как правило, не является серьезным заболеванием, вам все равно нужен ваш врач, чтобы поставить этот диагноз, а затем он или она может порекомендовать меры, которые вы можете предпринять, чтобы уменьшить вероятность кровотечения из геморроя.
Иногда ярко-красная кровь из прямой кишки указывает на гораздо более серьезную проблему — кровотечение изнутри кишечника (обычно толстого кишечника).Следует сразу же обратиться за советом к врачу, если количество крови, которое вы видите, представляет собой нечто большее, чем просто полосы, смешанные с нормальным стулом. Ваш врач определит, нужно ли вам делать процедуру для поиска источника кровотечения изнутри кишечника.
Скрытая (скрытая) кровь в стуле — другое дело. Врачи могут проверить нормальный внешний вид стула, нанеся небольшое количество стула на карточку и проверив его на наличие крови, не обнаруживаемой глазом. Присутствие скрытой крови может указывать на то, что что-то ненормальное в толстой кишке время от времени вызывает очень медленное кровотечение, а иногда это может быть признаком рака толстой кишки.Обнаружение скрытой крови в стуле обычно требует дополнительной оценки, например, осмотра кишечника, чтобы определить, присутствует ли рак толстой кишки.
3 кв. Моя мама борется с раком толстой кишки с конца 2005 года. В 2006 году ей сделали операцию, и ей удалили часть толстой кишки. Она также проходила разные виды химиотерапии. Недавно врачи сказали нам, что болезнь могла распространиться на лимфатические узлы в пояснице. Пару дней назад она попала в больницу из-за сильных болей в животе, которые у нее были довольно долгое время.Ей пришлось удалить желчный пузырь. Во время операции врач увидел несколько повреждений на слизистой оболочке живота, а также одну на печени. Он сделал биопсию, чтобы убедиться, но он уже сказал нам, что думает, что результаты будут положительными. Ее врач также считает, что рак находится в лимфатическом узле на ее шее по результатам недавних анализов. Каковы шансы того, что этот рак снова вернется в стадию ремиссии?
Обычно, когда рак распространился и является метастатическим, его невозможно вылечить. Однако может наступить ремиссия.В зависимости от типа химиотерапии, которую получает ваша мать, существует от 25 до 50 процентов вероятности того, что ее рак может перейти в ремиссию на какое-то время.
Если стандартные методы лечения исчерпаны, вам следует также рассмотреть возможность участия в клинических испытаниях. Они могут предоставить вашей матери возможность попробовать новые формы лечения, которые потенциально могут привести к ремиссии рака.
4 кв. У моего мужа был рак прямой кишки в 2004 году, он перенес операцию, лучевую терапию и химиотерапию.Он прекрасно себя чувствовал до недавнего времени, когда его рак вернулся в легкое. Они снова сделали операцию и удалили разрез. Теперь у него рак лимфатических узлов в груди (не в каком-либо органе). В настоящее время он проходит курс химиотерапии СРТ-11 (иринотекан). Возможно ли, чтобы после химиотерапии снова наступила ремиссия? Кроме того, я не понимаю разницы между лимфомой и раком лимфатических узлов в области груди. Онколог говорит, что ниже пояса ничего не видно. Любая информация будет мне полезна.Спасибо.
У вашего мужа IV стадия или метастатический рак прямой кишки, распространившийся на легкие. Похоже, что когда рак вернулся первоначально, он был локализован и, следовательно, поддается хирургическому вмешательству. Однако в этот момент болезнь распространилась на лимфатические узлы в легких. Хотя текущая химиотерапия позволяет ему достичь ремиссии, его болезнь неизлечима. Другими словами, поскольку в его теле циркулируют раковые клетки, есть вероятность, что в конечном итоге у него появится резистентность к химиотерапии, и опухоли появятся снова.Конечно, существуют дополнительные методы лечения, которые можно использовать, если это произойдет.
Лимфома — это отдельный и особый тип рака, который возникает в лимфатических узлах. Однако рак, который начинается в другом месте, например, рак прямой кишки, также может распространяться на лимфатические узлы. Вот что случилось с вашим мужем. Эти два типа рака очень разные и требуют разных методов лечения.
5 кв. Означает ли кровь в стуле рак толстой кишки?
Не обязательно.Кровь в стуле может быть по многим причинам, включая относительно легкие состояния, такие как геморрой или дивертикулез, или более серьезные проблемы, такие как воспалительное заболевание кишечника, язвы или, возможно, рак толстой кишки.
Хорошо беспокоиться о крови в стуле, потому что это ненормальное открытие и побудит вас посетить врача для полного обследования. Это может включать проверку анализа крови и, возможно, ректороманоскопию или колоноскопию. Только при дальнейшем исследовании можно определить причину появления крови в стуле.
Q6. У моей мамы был рак толстой кишки, когда ей было 93 года. Сейчас ей 96 лет, и иногда у нее случаются поносы. Каких продуктов ей следует избегать? Она принимает кумадин (варфарин), поэтому избегает зеленых овощей, и ей трудно переваривать салат. Это продукты, которые она любит. Кроме того, она не может есть яблоки или много других фруктов (вызывает понос). А как насчет жирности мяса? Любой совет? Спасибо.
В целом, лучший подход для онкологических больных и населения в целом — это сбалансированная диета, включающая углеводы, белки и жиры (в меньших количествах).Во время эпизода диареи лучше всего придерживаться мягких, безжирных продуктов с низким содержанием жира, таких как бананы, простой рис или макароны, сухие тосты и картофель.
Диарея может возникать по многим причинам — механические проблемы (например, проблемы с абсорбцией в кишечнике), основные воспалительные состояния или инфекции.
Если это повторяющаяся проблема, вашей матери следует обратиться за помощью к своему врачу, чтобы узнать, есть ли основное заболевание, которое нельзя вылечить одними только изменениями в питании.Учитывая ее ограничения в еде, она также могла бы обратиться за консультацией к диетологу, чтобы он помог сформировать хорошо сбалансированный план питания, включая зеленые овощи, которые она любит в умеренных количествах, а не полностью.
Q7. Я понимаю, что стандартное химиотерапевтическое лечение рака толстой кишки составляет шесть месяцев или 12 процедур. Для пациентов с раком прямой кишки, получивших облучение, я прочитал в Интернете, что некоторые получают 8 курсов лечения FOLFOX, а некоторые — 12. Есть ли «стандарт» для рака прямой кишки и как вы решаете, сколько химиотерапевтических процедур выбрать. ?
Лечение рака прямой кишки зависит от стадии рака на момент постановки диагноза.Каждый человек уникален, и рекомендации по лечению могут отличаться в зависимости от деталей каждого случая пациента.
В целом, для опухолей прямой кишки, которые больше и / или затрагивают регионарные лимфатические узлы, первоначальное лечение комбинацией химиотерапии и лучевой терапии с последующим хирургическим вмешательством было доказано в научных исследованиях лучше, чем только хирургическое вмешательство.
В тех случаях, когда опухоль велика и / или есть поражение лимфатических узлов, обычно рекомендуется, чтобы пациенты получали дополнительную химиотерапию после операции.Нет официальных данных, показывающих, что определенное количество процедур — 8 или 12 — является правильным количеством для каждого пациента. В общем, если пациент прошел химиотерапию с лучевой терапией перед операцией, я, как правило, провожу восемь сеансов FOLFOX, химиотерапевтического «коктейля», содержащего лейковорин, фторурацил (5-FU) и оксалиплатин (элоксатин).
Опять же, обратите внимание, что это не стандартная рекомендация, которую каждый врач будет давать каждому пациенту — вам нужно обсудить детали вашего собственного лечения со своим онкологом.
8 кв. У моего мужа четыре года назад был колоректальный рак, дважды рецидивы. За четыре года ремиссии составили 28 месяцев. Он страдал от ужасных побочных эффектов, особенно от диареи. Это обычное дело? Его рак метастазировал в лимфатические узлы, и он проходит третий курс лечения химиотерапией, камптозаром (иринотекан) и авастином (бевацизумаб). Пожалуйста помоги!
Диарея — это побочный эффект нескольких химиотерапевтических препаратов, используемых для лечения рака толстой кишки, включая капецитабин (Кселода), оксалиплатин (Элоксатин), фторурацил (5-ФУ) и иринотекан (Камптозар).Среди этих лекарств диарея чаще всего встречается при приеме иринотекана.
Для облегчения симптомов диареи можно использовать несколько лекарств, включая дифеноксилат и атропин (Ломотил и другие бренды) или лоперамид (Имодиум и другие бренды). В более тяжелых случаях можно использовать инъекционный препарат октреотид (Сандостатин).
Наконец, если эти поддерживающие лекарства не помогают, вы можете рассмотреть возможность снижения дозы химиотерапии. Вы должны проконсультироваться со своим врачом о лекарствах, подходящих для вашего мужа.
9 кв. Можно ли рассматривать операцию в случае, если рак был диагностирован в толстой кишке, но около прямой кишки? Можно ли было вырезать больное и снова прикрепить к верхнему кишечнику?
Резекция опухолей прямой кишки и анастомоз (повторное прикрепление) кишечника возможны в некоторых случаях рака прямой кишки, в зависимости от локализации опухоли. Прямая кишка относится к той части кишечника, которая расположена в тазу, и это пространство более ограничено, чем брюшная полость.Другие близлежащие органы в тазу — нижний отдел позвоночника, мочевой пузырь, простата для мужчин, матка и яичники для женщин — усложняют операцию.
Если опухоль находится очень низко и близко к анальному отверстию, повторное прикрепление может быть невозможно. В подобных случаях хирургу, возможно, придется удалить задний проход в дополнение к раковой части прямой кишки, установив постоянную колостому, чтобы отвести отходы в мешок за пределами тела.
Q10. Три года назад мне сделали илеостомию после операции по поводу рака прямой кишки.С тех пор, как через год его удалили, я часто испытывал потребность в устранении и немного понос. С момента обращения прошло два года, а мне все еще неудобно путешествовать или выезжать на длительные периоды времени. Есть ли у вас предложения по улучшению этой ситуации?
Я думаю, что в первую очередь вам следует пройти обследование у гастроэнтеролога, чтобы получить более четкое представление о степени вашей частой потребности в элиминации и диарее. В зависимости от типа диареи можно попробовать разные методы лечения.Лекарства, которые были полезны для облегчения таких симптомов, как ваш, включают лоперамид (Имодиум), кодеин, клонидин (Катапрес), октреотид (Сандостатин) или холестирамин (Квестран, Превилит, Лохолест). Однако я хочу повторить, что необходимо тщательное обследование, чтобы увидеть, какое лекарство лучше всего подходит для вашего состояния.
Узнайте больше в Центре рака толстой кишки Everyday Health.
Понимание изменений стула после операции
После операции вы можете заметить изменения в своем стуле через несколько дней и недель после операции.Изменения в привычках кишечника — это абсолютно нормально, особенно в первые несколько дней после операции, и большинство изменений не являются серьезными.
Операция часто вызывает серьезные изменения в вашем питании, уровне стресса и режиме приема лекарств. Все это может привести к изменению привычного образа жизни в ванной, которое обычно проходит по мере вашего выздоровления. Важно знать, что некоторые изменения стула могут быть признаком проблемы после операции.
Хилари Эллисон / VerywellДиарея
Под поносом понимается от четырех до шести жидких или жидких стулов в день.Это может быть вызвано изменением диеты до операции, изменением диеты после операции, лекарствами, предоставленными для операции, или даже увеличением объема жидкости, которую вы пьете или получаете через капельницу.
Диарея должна вызывать беспокойство, если она связана с умеренными или сильными спазмами, неприятным запахом стула, лихорадкой, рвотой или болью.
Clostridium difficile — это бактерия, которая обитает в пищеварительном тракте и может стать слишком многочисленной у людей, которые принимали или в настоящее время принимают антибиотики.Этот разрастание может быть серьезным заболеванием, которое приводит к неприятным запахам и часто болезненным спазмам.
По этой причине не следует игнорировать диарею после процедуры, так как большинство хирургических пациентов получают антибиотики. Посев кала может быть выполнен, чтобы увидеть, присутствует ли чрезмерный рост бактерий.
О диарее, продолжающейся более 24 часов в течение первых нескольких дней выздоровления, следует немедленно сообщать своему хирургу.
Запор
Обезболивающие, особенно опиоиды, такие как гидрокодон, оксикодон, морфин, дилаудид или фентанил, могут вызывать запор.Многие пациенты также меньше едят после операции или едят то, что выходит за рамки их обычного рациона.
Многие хирурги рекомендуют смягчитель стула, чтобы предотвратить запор после операции, и, если профилактика не помогает, мягкое слабительное средство для лечения запора. Увеличение количества пищевых волокон за счет употребления фруктов и овощей, увеличение потребления воды и повышение физической активности в виде ходьбы может помочь облегчить запор.
Сильный запор, который определяется как запор, вызывающий боль или менее двух дефекаций в неделю, может потребовать приема нескольких лекарств, чтобы найти облегчение.Не используйте клизму, если вам сделали операцию на прямой кишке, толстой кишке или пищеварительном тракте, не посоветовавшись с хирургом.
Позвоните своему хирургу, если у вас не было дефекации или газов в течение более пяти дней, несмотря на консервативное лечение. (Отхождение газов является признаком того, что ваш кишечник начинает возвращаться в норму.)
Нечастые стулья
Менее частый стул не обязательно означает запор. Если вам сказали воздержаться от еды до операции или вы очень мало едите после операции, вы можете рассчитывать на то, что будете ходить в туалет меньше, чем обычно.
Вам следует ожидать увеличения количества посещений туалета в неделю, если вы едите более регулярно, но вы также должны знать, что вы можете заметить первые признаки запора.
Черный или смолистый стул
Темный стул или стул черного цвета не является нормальным после операции и часто указывает на кровотечение в верхней части пищеварительного тракта. Жидкий, липкий на вид стул — тоже ненормально.
Оба этих типа стула могут указывать на кровь в стуле, и о них следует сообщить вашему хирургу, если вам не сказали ожидать этого после операции.Подавляющее большинство операций не приводят к появлению крови в стуле, и это , а не считается нормальным после процедуры.
Если у вас черный или дегтеобразный стул, необходимо обратиться за медицинской помощью, даже если у вас нет других симптомов.
Темный стул может быть вызван приемом лекарств, в частности добавок железа, древесного угля и пепто-бисмола. Черная еда, такая как лакрица, также может вызвать черный стул. Можно выполнить простой тест, называемый скрытым тестом стула, чтобы определить, присутствует ли кровь или вызвано ли изменение другой причиной.
Веривелл / Гэри ФерстерСтул цвета глины
Белый или глинистый стул часто является признаком серьезного заболевания печени или печеночной недостаточности. Об очень светлом стуле следует немедленно сообщить врачу, если только вы недавно не принимали барий в рамках теста для исследования пищеварительного тракта. Чрезмерное употребление антацидов и молочная диета (младенцы) также могут привести к белому стулу.
Позвоните своему хирургу, если у вас стул белого или глиняного цвета и нет четкого объяснения его отсутствия.
Зеленый табурет
Зеленый стул обычно вызывается употреблением в пищу зеленых продуктов, таких как шпинат, брокколи или капуста. Зеленые пищевые красители, такие как те, которые содержатся в ярко окрашенных продуктах, таких как Jell-O, часто являются причиной зеленого стула.
Стул очень темно-зеленого цвета, который трудно отличить от черного стула, по-прежнему считается нормальным. Если вы не уверены, имеет ли стул темно-зеленый цвет или черный, нанесите небольшое количество стула на лист бумаги, и это будет легче определить.
Быстрое транзитное время, то есть время от приема пищи до дефекации, в котором содержится эта еда, также может привести к зеленому стулу.
Красный табурет
Красный стул, не путать с темным или дегтеобразным стулом, чаще всего является результатом диеты. Свекла, клюква, помидоры и ярко окрашенные продукты, включая конфеты и желе, могут вызывать резкий красный стул, что на самом деле является совершенно нормальным явлением.
Если вы подозреваете, что изменения цвета стула могут быть связаны с ярко окрашенными продуктами или напитками, подумайте о переходе с красных продуктов и напитков на синие или зеленые.
Красный стул также может указывать на кровотечение в самом конце пищеварительного тракта, такое как кровотечение при геморрое. Этот тип кровотечения чаще отмечается на туалетной бумаге, а не на самом стуле, и его часто можно уменьшить с помощью смягчителя стула, чтобы предотвратить натуживание.
Позвоните своему хирургу, если вы испытываете боль в прямой кишке, ректальное кровотечение, головокружение, высокую температуру, тошноту или рвоту.
Табуреты других цветов
Как и многие другие необычные цвета стула, эти цвета обычно являются результатом пищевых красителей, содержащихся в ярко окрашенных продуктах или ярко окрашенных фруктах и овощах.В некоторых случаях желтый / оранжевый стул может указывать на высокое содержание жира в стуле и может указывать на то, что поджелудочная железа не в состоянии выполнять свою роль, помогая организму переваривать пищу.
Большинство изменений цвета стула не связаны со здоровьем. Цвета, которые могут указывать на серьезную проблему: красный, черный (и / или смолистый) и белый. Другие цвета, как правило, являются результатом диеты, но могут стать более выраженными, если у человека диарея или «быстрое время прохождения», что означает, что пища перемещается изо рта в организм очень быстро и не может полностью перевариваться.
Быстрое транзитное время часто наблюдается у больных детей и взрослых, страдающих диареей, поэтому люди с диареей с гораздо большей вероятностью увидят частично переваренные продукты и яркий стул необычной окраски.
Слово Verywell
Изменения цвета стула могут вызывать тревогу, но часто они являются результатом пищевых красителей, которые часто встречаются в обработанных пищевых продуктах.

 В таких случаях частой проблемой оказывается избыточный бактериальный рост, особенно после шунтирующих операций, таких как еюноилеальный байпас или вертикальная гастропластика, производимых с целью устранения ожирения. Менее обширные резекции терминального отдела подвздошной кишки могут приводить к хологенной диарее, которая появляется типично после еды и обычно связана ответной реакцией с голоданием и применением секвестрантов желчных кислот. Хроническая диарея может развиваться у 10% пациентов после холецистэктомии по причине ускоренного кишечного транзита, хологенной диареи и повышенной энтерогепатической циркуляции желчных кислот;
В таких случаях частой проблемой оказывается избыточный бактериальный рост, особенно после шунтирующих операций, таких как еюноилеальный байпас или вертикальная гастропластика, производимых с целью устранения ожирения. Менее обширные резекции терминального отдела подвздошной кишки могут приводить к хологенной диарее, которая появляется типично после еды и обычно связана ответной реакцией с голоданием и применением секвестрантов желчных кислот. Хроническая диарея может развиваться у 10% пациентов после холецистэктомии по причине ускоренного кишечного транзита, хологенной диареи и повышенной энтерогепатической циркуляции желчных кислот;