Глюкагон и инсулин: Функции инсулина и глюкагона
Обмен глюкозы и зачатие | Махмудов
Аннотация
Рождение полноценного жизнеспособного потомства находится в прямой зависимости от состояния материнского организма. Начиная с самых ранних периодов беременности многие факторы внешней и внутренней среды оказывают влияние на внутриутробное развитие плода. Успешное завершение беременности и рождение здорового потомства возможны при сбалансированности обмена веществ и удовлетворении всех потребностей материнского организма. В этом процессе большую роль играют углеводы, и в частности глюкоза, которая интенсивно используется внутриутробно развивающимся эмбрионом. Дефицит ее в организме матери может затормозить развитие и даже вызвать раннюю гибель потомства. Поэтому, учитывая важность глюкозы для развивающегося организма, в настоящем обзоре обсуждаются вопросы, связанные с ее обменом и регуляцией в процессе беременности.
Ключевые слова
глюкоза, инсулин, зачатие, эмбриогенез
Для цитирования:
Махмудов Э. С., Ходжиматов В.А. Обмен глюкозы и зачатие. Проблемы Эндокринологии. 1993;39(2):60-62. https://doi.org/10.14341/probl11980
С., Ходжиматов В.А. Обмен глюкозы и зачатие. Проблемы Эндокринологии. 1993;39(2):60-62. https://doi.org/10.14341/probl11980
For citation:
Makhmudov E.S., Khodzhimatov V.A. Glucose metabolism and conception. Problems of Endocrinology. 1993;39(2):60-62. (In Russ.) https://doi.org/10.14341/probl11980
Рождение полноценного жизнеспособного потомства находится в прямой зависимости от состояния материнского организма. Начиная с самых ранних периодов беременности многие факторы внешней и внутренней среды оказывают влияние на внутриутробное развитие плода. Успешное завершение беременности и рождение здорового потомства возможны при сбалансированности обмена веществ и удовлетворении всех потребностей материнского организма.
Глюкоза является одним из основных энергетических субстратов. В свободном виде она всегда присутствует в крови и тканевых жидкостях организма. Концентрация ее в периферической крови относится к константным показателям, у здорового человека в состоянии относительного покоя ее величина составляет 4,5—5,5 ммоль/л, а общее количество глюкозы в организме составляет приблизительно 20 г [11]. В процессе эволюции сформировалась сложная система регуляции глюкозы в крови [4].
Глюкоза, поступающая в организм с пищей, может резервироваться в виде гликогена или использоваться для быстрого образования энергии, необходимой клеткам и тканям. Окисление глюкозы в тканях высших организмов сопровождается освобождением химической энергии, аккумулированной в форме АТФ. В процессе анаэробного распада глюкозы образуются 2—3 молекулы, а при аэробном, наиболее выгодном пути окисления, 38—39 молекул АТФ [2]. Использование глюкозы в организме зависит от скорости ее накопления в виде гликогена в мышцах и печени [8]. Гликоген печени по мере надобности быстро распадается с высвобождением глюкозы. Обмен углеводов может изменяться не более чем на 30 % при различных функциональных напряжениях организма человека и животных [6, 8].
Окисление глюкозы в тканях высших организмов сопровождается освобождением химической энергии, аккумулированной в форме АТФ. В процессе анаэробного распада глюкозы образуются 2—3 молекулы, а при аэробном, наиболее выгодном пути окисления, 38—39 молекул АТФ [2]. Использование глюкозы в организме зависит от скорости ее накопления в виде гликогена в мышцах и печени [8]. Гликоген печени по мере надобности быстро распадается с высвобождением глюкозы. Обмен углеводов может изменяться не более чем на 30 % при различных функциональных напряжениях организма человека и животных [6, 8].
Это касается и беременности, в процессе которой наступает глубокая перестройка метаболических процессов в организме. Изменения, возникающие в организме матери, начиная с самых ранних сроков беременности, отражаются и на внутриутробно развивающемся потомстве, ибо между ними устанавливается тесная взаимосвязь [12, 13].
С наступлением беременности в крови животных нарастает уровень ряда гормонов (прогестерона, эстрадиола), усиливается кровоснабжение репродуктивных органов и существенно перестраивается обмен веществ в сторону накопления в организме матери жира [40].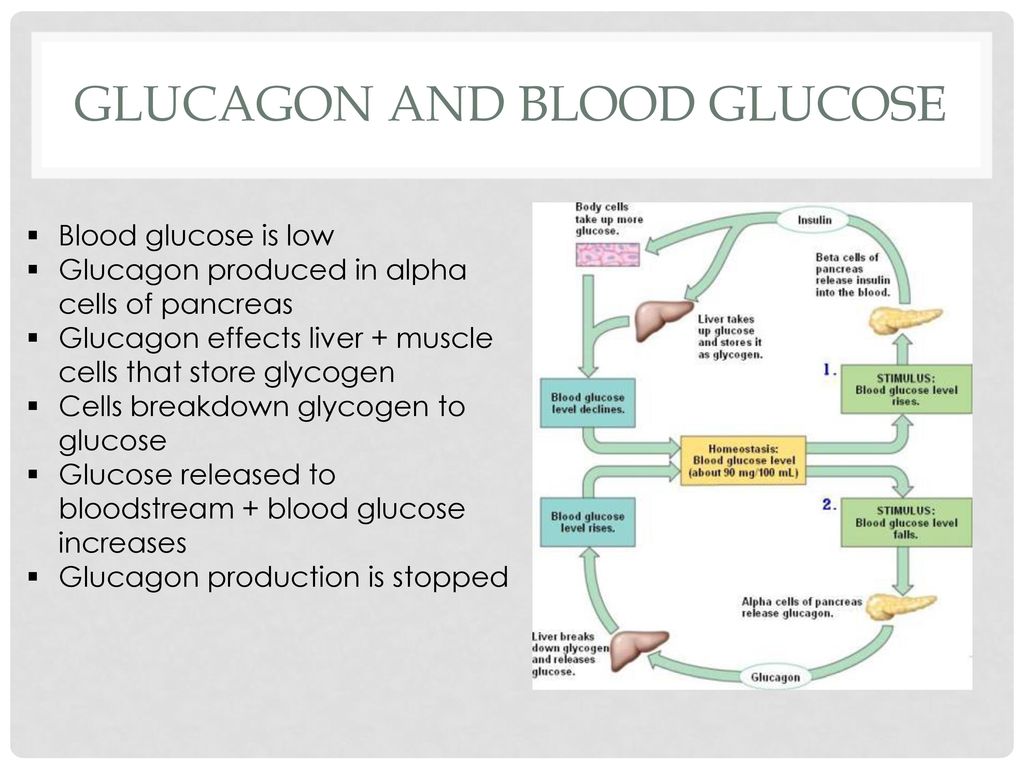 Одновременно активируется и обмен углеводов. Внутривенное введение беременным ‘’С-аланина, ‘ 4С-глицина или |4С-пирувата приводит к усиленному образованию нС-глюкозы в срезах печени [19]. О высокой интенсивности обмена глюкозы свидетельствуют и другие работы. Например, у крыс линии Rattus — Rattus во время беременности содержание гликогена в печени, скелетных мышцах и матке снижается, в то время как концентрация глюкозы в крови возрастает. Последняя используется для покрытия энергетических потребностей развивающихся эмбрионов [49]. Эксперименты, проведенные на беременных овцах, показали, что при нормогликемических состояниях скорость выработки глюкозы в 2 раза выше, чем у овец с гипогликемией. В матке крольчих утилизация глюкозы крови при беременности увеличивается [26].
Одновременно активируется и обмен углеводов. Внутривенное введение беременным ‘’С-аланина, ‘ 4С-глицина или |4С-пирувата приводит к усиленному образованию нС-глюкозы в срезах печени [19]. О высокой интенсивности обмена глюкозы свидетельствуют и другие работы. Например, у крыс линии Rattus — Rattus во время беременности содержание гликогена в печени, скелетных мышцах и матке снижается, в то время как концентрация глюкозы в крови возрастает. Последняя используется для покрытия энергетических потребностей развивающихся эмбрионов [49]. Эксперименты, проведенные на беременных овцах, показали, что при нормогликемических состояниях скорость выработки глюкозы в 2 раза выше, чем у овец с гипогликемией. В матке крольчих утилизация глюкозы крови при беременности увеличивается [26].
У человека и животных в период беременности содержание глюкозы в крови и гликогена в печени существенно снижается [26, 27, 54]. В одном из последних обзоров [41], посвященном метаболизму глюкозы, указывается, что у разных видов животных в поздние сроки беременности происходит снижение уровня глюкозы в крови при одновременном увеличении в ней .
Нами также проведено определение содержания глюкозы в крови крыс в разные периоды беременности в условиях относительного температурного комфорта и на фоне воздействия высокой окружающей температуры. Эксперименты показали, что, начиная с ранних сроков беременности, уровень глюкозы в крови снижается, но особенно резко после гипертермических воздействий на организм. В этих условиях скармливание глюкозы или ее внутривенное введение беременным животным улучшают углеводный обмен, повышают воспроизводительную функцию и жизнеспособность потомства [1, 9]. Эстрогены, введенные в ранние сроки беременности, стимулируют поступление глюкозы в полость матки и тем самым способствуют имплантации бластоцисты [45].
Имеются данные, что значительная часть глюкозы у эмбрионов свиньи до 8-й клеточной стадии развития обменивается по пентозофосфатному пути, а начиная с 8-й клеточной стадии до бластоцисты по гликолитическому пути [23]. В то же время на мышиных оплодотворенных яйцеклетках установлено, что глюкоза предпочтительно утилизируется в период имплантации и не используется до формирования бластоцисты. Однако на человеческих зародышах показано, что до стадии бластоцисты они используют глюкозу, другие эндогенные источники и возможно гликоген. Установлен факт влияния глюкозы на имплантацию у овец и крыс [1, 3].
В наших исследованиях также показано, что скармливание крысам в период имплантации глюкозы из расчета 1 г на 100 г массы сопровождается повышением рождаемости крыс на 20 % по сравнению с контрольными животными [10]. Аналогичную закономерность наблюдали и другие исследователи, вводившие в рацион беременных крыс нарастающие количества углеводов [37]. Положительное влияние избытка углеводов следует объяснить повышением их метаболизма в эндометрии матки, что создает благоприятные условия для имплантации бластоцисты, которая в свою очередь начинает активно утилизировать глюкозу [18].
Положительное влияние избытка углеводов следует объяснить повышением их метаболизма в эндометрии матки, что создает благоприятные условия для имплантации бластоцисты, которая в свою очередь начинает активно утилизировать глюкозу [18].
Интересно отметить, что на адгезивной стадии имплантации обнаруживаются изменения в продукции D-галактозы и N-ацетилгалактозы. Введение в просвет одного рога беременной матки мыши в предымплантационный период X-D-N-ацетилгалактозиламинидазы, р-галактозидазы или а-галактозидазы или лактальбумина предотвращает этот процесс у одних мышей и задерживает эмбриональное развитие у других. •
Следовательно, нарушение метаболизма О-галактозы мешает процессу имплантации и тормозит активность децидуальных клеток [21]. Также показано, что нарушение метаболизма углеводов, и в частности глюкозы, приводит к бесплодию. Из этого следует, что глюкоза в материнском организме является важным энергетическим субстратом, не только поддерживающим репродуктивную функцию, но и обеспечивающим метаболические потребности внутриутробно развивающегося эмбриона [41]. Использованию глюкозы способствует и ее свободное прохождение через плаценту путем облегченной диффузии [16]. Причем по мере внутриутробного развития потребность плода в энергетических субстратах возрастает, поэтому у беременных животных повышаются объем распределения глюкозы, ее ассимиляция и скорость распределения между легко- и труднообмени- ваемой фракциями [17]. О существенном значении глюкозы, содержащейся в крови матери, для роста и развития плода свидетельствуют эксперименты с перевязкой одного рога крысиной матки в период беременности. При этом уровень сахара в крови у матери не изменяется, в то время как у плода он достоверно снижается, а рост и развитие плода в перевязанном роге тормозятся [49]. Кроме глюкозы, зародыш или плод используют лактат, пируват и другие крмпоненты гликолиза и цикла лимонной кислоты. Кстати, в эмбриональной ткани активность ферментов анаэробного распада углеводов превалирует над активностью ферментов аэробного окисления. Этот путь превращения углеводов остается весьма активным во многих тканях новорожденного и ребенка 1-го месяца жизни [2].
Использованию глюкозы способствует и ее свободное прохождение через плаценту путем облегченной диффузии [16]. Причем по мере внутриутробного развития потребность плода в энергетических субстратах возрастает, поэтому у беременных животных повышаются объем распределения глюкозы, ее ассимиляция и скорость распределения между легко- и труднообмени- ваемой фракциями [17]. О существенном значении глюкозы, содержащейся в крови матери, для роста и развития плода свидетельствуют эксперименты с перевязкой одного рога крысиной матки в период беременности. При этом уровень сахара в крови у матери не изменяется, в то время как у плода он достоверно снижается, а рост и развитие плода в перевязанном роге тормозятся [49]. Кроме глюкозы, зародыш или плод используют лактат, пируват и другие крмпоненты гликолиза и цикла лимонной кислоты. Кстати, в эмбриональной ткани активность ферментов анаэробного распада углеводов превалирует над активностью ферментов аэробного окисления. Этот путь превращения углеводов остается весьма активным во многих тканях новорожденного и ребенка 1-го месяца жизни [2].
Исследования с меченой глюкозой показали, что значительная ее часть у плода окисляется в пентозофосфат — ном цикле. Глюкоза действует на специфический рецептор, активирующий аденилатциклазу, ведет к увеличению уровня аденозинмонофосфата, усиливает процессы трансформации энергии, аккумулированной в макроэргических связях. Образующаяся при этом энергия используется для нужд интенсивно растущего организма [15]. Начиная с 16-го дня внутриутробной жизни плод использует глюкозу и для синтеза гликогена [39]. Гепатоциты 18-дневных плодов способны интенсивно синтезировать гликоген, содержание которого при наличии следовых количеств инсулина повышается почти в 3 раза [42]. В этой связи представляется важным обсудить степень участия гормонов, в частности инсулина и глюкагона, в регуляции углеводного обмена в период беременности. Преобладающим числом исследований показано увеличение содержания инсулина в крови здоровых беременных женщин и животных [14, 27], что сопровождается снижением утилизации глюкозы инсулинчувствительными тканями матери, а ее использование развивающимся плодом постепенно увеличивается.
Уровень глюкозы в крови заметно нарастает сразу после еды и резко снижается у голодных животных. Нестабильность концентрации глюкозы в крови поддерживается плацентарным лактогеном и прогестероном, которые снижают чувствительность периферических тканей к инсулину и соответственно утилизацию в них углеводов [47, 51]. В адипоцитах беременных крыс снижаются поступление, превращение и окисление стимулируемой инсулином глюкозы [52]. В то же время инсулин и инсулиноподобные факторы роста повышают утилизацию глюкозы, образование лактата, СО? и накопление гликогена в тканях изолированной плаценты человека [49]. Считается, что гликогенсодержащие клетки выполняют защитную роль и дают возможность совместного существования клеток материнского и зародышевого происхождения внутри плаценты в течение беременности»]!)].
Помимо влияния на углеводный обмен, инсулин стимулирует образование инсулиноподобного ростового фактора 1 и оба гормона оказывают анаболическое действие на плод [30]. При этом циркулирующий в крови матери инсулин не проникает через плаценту, но от его секреции зависит содержание глюкозы в крови матери и поступление к плоду и, следовательно, состояние углеводного питания последнего, определяющего внутриутробное развитие [4, 16, 31, 48, 51]. В этом процессе ведущую роль также играют плацентарные гормоны — плацентарный лактоген и хорионический гонадотропин [2]. Плацентарный лактоген обладает широким спектром действия: соматотропным, лактогенным, лютеотроп- ным, а также потенцирует хорионический гонадотропин [35].
При этом циркулирующий в крови матери инсулин не проникает через плаценту, но от его секреции зависит содержание глюкозы в крови матери и поступление к плоду и, следовательно, состояние углеводного питания последнего, определяющего внутриутробное развитие [4, 16, 31, 48, 51]. В этом процессе ведущую роль также играют плацентарные гормоны — плацентарный лактоген и хорионический гонадотропин [2]. Плацентарный лактоген обладает широким спектром действия: соматотропным, лактогенным, лютеотроп- ным, а также потенцирует хорионический гонадотропин [35].
В то же время избыток инсулина может отрицательно влиять на развитие плода. Так, при введении инсулина крысам на 5—7-й день беременности двукратно в течение дня у 12-дневных эмбрионов, извлеченных методом кесарева сечения, обнаруживались пороки развития [20]. Повышение уровня инсулина в амниотической жидкости на ранних стадиях беременности может свидетельствовать о высокой степени риска аномалий развития плода [14].
В наших экспериментах введение крысам на 5—7-й день беременности возрастающих доз инсулина сопровождалось дозозависимым снижением числа родивших животных и количества особей в помете. Вскрытие 10 крыс с 10-дневной беременностью, которым на 5—7-й день после спаривания вводили инсулин из расчета 0,25 ЕД на 100 г массы, показало, что у 2 самок в матке развивалось по 4 эмбриона, а у всех остальных животных этот орган был увеличен и диффузно гиперемирован. В нем отсутствовали признаки имплантации. У 6 из 10 забитых контрольных беременных крыс в обоих рогах матки было обнаружено от 8 до 13 развивающихся эмбрионов, у 4 особей этот орган остался таким же, как у вергинных самок [10].
Вскрытие 10 крыс с 10-дневной беременностью, которым на 5—7-й день после спаривания вводили инсулин из расчета 0,25 ЕД на 100 г массы, показало, что у 2 самок в матке развивалось по 4 эмбриона, а у всех остальных животных этот орган был увеличен и диффузно гиперемирован. В нем отсутствовали признаки имплантации. У 6 из 10 забитых контрольных беременных крыс в обоих рогах матки было обнаружено от 8 до 13 развивающихся эмбрионов, у 4 особей этот орган остался таким же, как у вергинных самок [10].
Следовательно, инсулин, введенный животным в ранние сроки беременности, вызывая гипогликемию, тормозит метаболические процессы в эндометрии матки, играет роль антагониста эстрадиола и прогестерона, которые в ранний внутриутробный период оказывают трофическое влияние на зародыш [4].
Позднее, после образования плаценты, инсулин свое влияние на плод, как отмечалось выше, опосредует через изменения содержания питательных веществ, главным образом глюкозы, в крови матери [33, 43]. Глюкагон, так же как инсулин, включается в регуляцию углеводного обмена. Его секреция активируется при понижении уровня глюкозы в крови. Этот гормон стимулирует фосфорилазу печени, способствует распаду гликогена в ней и выходу глюкозы в кровь. Сведения о его регулирующем влиянии в периоды беременности и внутриутробного развития плода немногочисленны. Установлено, что в развивающейся поджелудочной железе плода глюкагон появляется на 12,5-й день внутриутробного развития [40] и, видимо, играет определенную регуляторную роль уже пренатально. В то же время глюкагон матери не проникает в плод, о чем свидетельствуют опыты на беременных овцах [46]. К концу беременности в крови женщин повышается уровень глюкагона на фоне низких концентраций инсулина и гормона роста [29]. При длительном введении глюкозы самкам крыс в последние дни беременности содержание глюкагона в крови у них снижается при некотором нарастании уровня инсулина |38|. Введение глюкагона извне поздним зародышам вызывает увеличение глюкозо-6-фосфатазной активности и снижение гликогена в печени [25]. Кроме того, показано, что глюкагон, вводимый зародышам крысы, активирует у них ключевой фермент глюконеогенеза — фосфоенолпируваткарбоксикиназу, а также превращение в глюкозу лактата и некоторых аминокислот [28, 34].
Его секреция активируется при понижении уровня глюкозы в крови. Этот гормон стимулирует фосфорилазу печени, способствует распаду гликогена в ней и выходу глюкозы в кровь. Сведения о его регулирующем влиянии в периоды беременности и внутриутробного развития плода немногочисленны. Установлено, что в развивающейся поджелудочной железе плода глюкагон появляется на 12,5-й день внутриутробного развития [40] и, видимо, играет определенную регуляторную роль уже пренатально. В то же время глюкагон матери не проникает в плод, о чем свидетельствуют опыты на беременных овцах [46]. К концу беременности в крови женщин повышается уровень глюкагона на фоне низких концентраций инсулина и гормона роста [29]. При длительном введении глюкозы самкам крыс в последние дни беременности содержание глюкагона в крови у них снижается при некотором нарастании уровня инсулина |38|. Введение глюкагона извне поздним зародышам вызывает увеличение глюкозо-6-фосфатазной активности и снижение гликогена в печени [25]. Кроме того, показано, что глюкагон, вводимый зародышам крысы, активирует у них ключевой фермент глюконеогенеза — фосфоенолпируваткарбоксикиназу, а также превращение в глюкозу лактата и некоторых аминокислот [28, 34]. В поздний зародышевый период повышается отношение инсулин/глюкагон, которое находится в соответствии с гликемическим гомеостазом плода, поддерживаемым за счет поступления глюкозы из материнского организма [54].
В поздний зародышевый период повышается отношение инсулин/глюкагон, которое находится в соответствии с гликемическим гомеостазом плода, поддерживаемым за счет поступления глюкозы из материнского организма [54].
Исследования на млекопитающих животных показали, что одной из функций глюкагона в пренатальном периоде развития является индукция синтеза ферментов печени, в том числе глюкозо-6-фосфатазы, которые участвуют в регуляции обмена глюкозы в период беременности |4].
Таким образом, изложенные выше факты свидетельствуют о серьезных изменениях углеводного обмена, возникающих у животных в период беременности. В самом начале этого периода глюкоза стимулирует процесс имплантации. По мере увеличения сроков беременности в материнском организме усиливается синтез углеводов, но их окисление тканями снижается. Уровень глюкозы в крови беременных животных становится нестабильным и колеблется в широком диапазоне в ответ на различные воздействия. Введенные в полость беременной матки препараты, блокирующие обмен углеводов, а также нарушение кровоснабжения одного из рогов этого органа предотвращают процесс имплантации или развитие эмбрионов.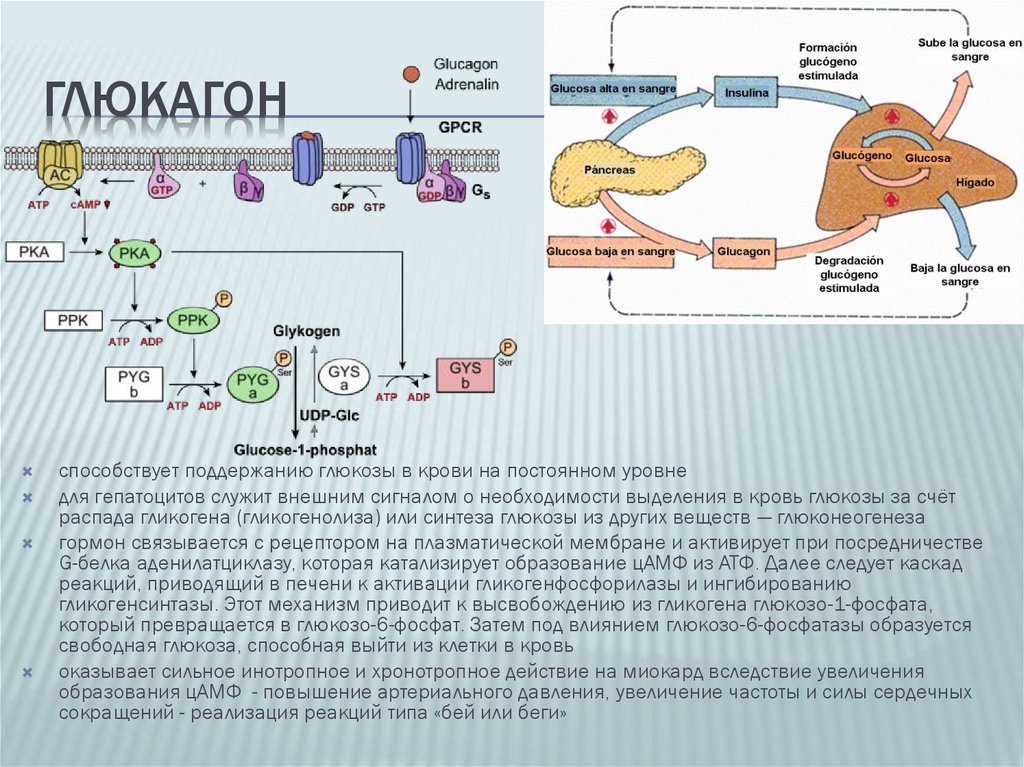 Повышение концентрации глюкозы в крови беременных самок способствует увеличению числа особей в помете и улучшению их жизнеспособности.
Повышение концентрации глюкозы в крови беременных самок способствует увеличению числа особей в помете и улучшению их жизнеспособности.
Согласно данным литературы, после оплодотворения в местах предполагаемой имплантации зародыша повышается потребление кислорода, поэтому вероятней всего глюкоза, сукцинат, пируват, лактат, ацетат повышают в эндометрии матки энергетические проценты и тем самым увеличивают число мест имплантаций и последующее развитие эмбриона [32, 36, 40, 53].
Этот процесс является довольно сложным и до конца не исследованным. Регуляция обмена глюкозы в материн ском организме и стимуляция ростовых процессов плода осуществляются инсулином, инсулиноподобным ростовым фактором I и другими ростовыми факторами. Инсулиноподобный ростовый фактор I стимулирует утилизацию глюкозы, образование лактата, СОг и накопление гликогена в ткани изолированной плаценты человека [22, 54]. В то же время большие дозы инсулина, введенные в ранние сроки беременности, блокируют имплантацию, а позже нарушают процесс внутриутробного развития. Глюкагон также участвует в обмене углеводов у беременной матери и плода. В плане дальнейшего изучения физиологических механизмов обмена углеводов перспективными могут быть исследования, направленные на изучение следующих вопросов:
Глюкагон также участвует в обмене углеводов у беременной матери и плода. В плане дальнейшего изучения физиологических механизмов обмена углеводов перспективными могут быть исследования, направленные на изучение следующих вопросов:
а) молекулярные механизмы действия глюкозы на плод и децидуальную оболочку матки в ранние сроки беременности;
б) механизмы отрицательного действия инсулина в период эмбриогенеза на развивающийся эмбрион;
в) участие глюкагона в регуляции обмена глюкозы в процессе беременности;
г) механизмы взаимоотношения инсулина с основными гормонами беременности (прогестероном и эстрогенами).
1. Алимухамедов А. А. // Съезд физиологов Узбекистана, 4-й: Тезисы науч, сообщений.— Ташкент, 1988.— С. 39.
2. Вельтищев Ю. Е., Ермолаев М. В., Аноненко В. А., Князев Ю. А. Обмен веществ у детей.— М., 1983.
3. Воробьев Н. Н. // Изв. АН СССР. Сер. биол.— 1985,— № 1,— С. 61—70.
4. Држевецкая И. А. Эндокринная система растущего организма. — М., 1987.
— М., 1987.
5. Зыбина Т. Г. // Цитология.— 1983.— Т. 30, № 10.— С. 1180.
6. Каминский Ю. Г., Косенко Е. А. Парадоксы углеводного обмена.— Пущино, 1988.
7. Колесников С. И., Морозова Л. М. Генетико—физиологические взаимоотношения матери и плода.— Новосибирск, 1985.
8. Косенко Е. А., Каминский Ю. Г. Углеводный обмен, печень и алкоголь.— Пущино; 1988.
9. Махмудов Э. С., Алимухамедов А. А., Рахимов К. Р., Садыков Б. А. Рекомендации по снижению яловости коров и сохранению молодняка крупного рогатого скота в условиях Узбекистана. Информ, сообщение № 442.— Ташкент, 1988.
10. Махмудов Э. С., Ахмеров Р. Н., Алимухамедов А. А., Бабаева Р. Н. Реакция беременной самки и ее потомства на введение глюкозы и инсулина. Депонир. в ВИНИТИ 29.03.91 № В 82 — В 71.
11. Рахимов К. Р., Демидова А. И. Углеводы и механизмы их усвоения.— Ташкент, 1986.
12. Репин В. С. // Успехи соврем, биол.— 1976.— Т. 81,— С. 106—125.
13. Репин В. С. Критические факторы химической регуляции развития. — М., 1980.
— М., 1980.
14. Шевченко Т. К., Абдуллаев Н. X., Шамирзаев Н. X. Беременность и сахарный диабет.— Ташкент, 1988.
15. Юдаев М. А., Афиногенова С. А., Булатов А. А. и др. Цит. по Воробьеву Н. Н. // Изв. АН СССР. Сер. биол.— 1985,— № 1,— С. 61—70.
16. Anand R. S., Languli S., Sperling М. А. // Amer. J. Physiol.— 1980,— Vol. 238, N 6,— Р. 524—532.
17. Barz S., Jeige A., Mitzkat H. J. // Med. Klin.— 1985.— Bd 80, N 18.— S. 483—487.
18. Britta A., Mattson J. V., Rosenblum R. M. et al. .// Diabetes.— 1988,— Vol. 37, N 5,— P. 585—589.
19. Buch L., Hornes P. J., Kuhl C. // Acta endocr. (Kbh.).— 1986,— Vol. 112, N 2 — P. 263—266.
20. Buchanan T. A., Schemmer J. K., Frelnker N. // J. clin. Invest.— 1986,— Vol. 78, N 3.— P. 643—649.
21. Chovez D. J. // Europ. J. Cell Biol.— 1986.— Vol. 42, Suppl. 15.— P. 69.
22. Dieguez C., Page M. D., Peters T. R., Seaulon M. F. // J. roy. Coll. Phycns bond.— 1988.— Vol. 22, N 2,— P. 84—91.
23. Flood M. R„ Wiebold J. L. // J. Reprod. Fertil.—, 1988,— Vol. 84, N 1.— P. 7—12.
L. // J. Reprod. Fertil.—, 1988,— Vol. 84, N 1.— P. 7—12.
24. Galt A. L., Hardy K., Winston R. M. Z., Leess H. I. // Hum. Reprod.— 1990.— Vol. 5, N I.— P. 104—108.
25. Greengard O., Dowey H. K. // J. biol. Chem.— 1967.— Vol. 242,— P. 2968—2991.
26. Gilbert M., Hauguel S., Bouisset M. // Amer. J. Physiol.— 1981 — Vol. 247, N 5,— P. 574—580.
27. Gilbert M., Sparks 1. W., Girard J., Battaglia J. C. // Biol. Neonat.— 1985,— Vol. 48, N 2.— P. 90—99.
28. Girard J. R., Guillet J., Marty J. et al. // Diabetologia.— 1976,— Vol. 12, N 4,— P. 327—337.
29. Gonzalez- Willamer G., Argota-Espinosa R., Niz-Rames J. // Arch, invest. Med.— 1982,— Vol. 13, N 4,— P. 239— 244.
30. Hainz E. T., Nguyen V. V., Fussgahet R. D. // Biol. Neonate.—1982.— Vol. 41, N 5—6.— P. 240—245.
31. Hay W. W., Sparks J. W., Wilkening R. B. et al. // Amer. J. Physiol.— 1983,— Vol. 245, N 4,— P. E347—E350.
32. Horst C. J. G. // Cytobios.— 1986,— Vol. 45, N 181,— P. 85—95.
33. Itskovitz J., Hodgen G. D. // Psychoneuroendocrino— logy.— 1988,— N 1—2,— P. 155—170.
Itskovitz J., Hodgen G. D. // Psychoneuroendocrino— logy.— 1988,— N 1—2,— P. 155—170.
34. Jeung D., Oliver J. T. // Biochem. J.—1968.— Vol. 108, N 2,— P. 325—327.
35. Josimovich J. B. // Comparative Aspects of Reproductive Failure.— Berlin, 1967.— P. 176—185.
36. Khurana N. K., Wales R. G. // Aust. J. biol. Sci.— 1987 — Vol. 40, N 4,— P. 389—395.
37. Koski K. G„ Hill F. W., Harley L. S. // J. Nutr.— 1986,— Vol. 116, N 10,— P. 1922—1937.
38. Ktorra A., Nurjhan N., Girard J. R., Picon L. // Reprod. Nutr. Develop.— 1983.— Vol. 32, N 2.— P. 332—339.
39. Kozaric Z., Peternal P., Labunzija M. // Vet. Arch.— 1988 —Vol. 58, N 1,—P. 33—39.
40. Leturgue A., Hauguel S., Ferra P., Girard J. // Biol. Neonat.— 1987.— Vol. 51, N 2,— P. 64—69.
41. Leturgue A., Revelli J. P., Hauguel S. et al. // Amer. J. Physiol.— 1987,— Vol. 253, N 6,— Pt 1,— P. 616—620.
42. Manuelle P., Вис H. A., Plas Ch. // Biochim. biophys. Acta. Molec. Cell Res.— 1987,— Vol. 298, N 3,— P. 332—340.
332—340.
43. Milner R. D., Hill D. I. // Clin. Endocr.— 1984.— Vol. 21, N 4,— P. 415—433.
44. Naismith D. J., Richardson D. P., Pritchard A. E. // Brit. J. Nutr.— 1982,— Vol. 48.— P. 433—441.
45. Nilsson В. O., Ostensson C. G., Eide S., Hellestrom С. // Endocrinology.— 1980.— Vol. 76, N 1,— P. 82—93.
46. Nitzan M. // Isr. J. med. Sci.— 1981.— Vol. 17, N 5.— P. 378—380.
47. Pinget M., Gander R., Jacques C. et al. // Path Biol.— 1982,— Vol. 30, N 1.— P. 43—48.
48. Rancin J. H. G., Sadarski G., Shanchan M. R. // J. Develop. Physiol.— 1986,— Vol. 8, N 4,— P. 247—253.
49. Singh V. H., Sabnis J. H. // Physiol, and Ecol.— 1986.— Vol. II, N 2,— P. 95—97.
50. Sitianou K., Henrichs J., Teller W. A. // Acta endocr. (Kbh.).— 1988,— Vol. 117, Suppl. 287,— P. 55—56.
51. Sutter-Dub M. T., Dozey B., Vergnaud M. Th., Modes A. M. // Horm. Metab. Res.— 1984.— Vol. 13, N 3.— P. 181 — 184.
52. Toyoda N., Murata K., Sugiama J. // Endocrinology.— 1982 — Vol. 116, N 3,— P. 998—1002.
116, N 3,— P. 998—1002.
53. Vilar R. C., Hicke Z. R. // Arch, invest. Med.— 1988,— Vol. 19, N 3.— P. 283—289.
54. Young A. A., Bogardus E., Stone K., Molt D. M. // Amer. J. Physiol.— 1988,— Vol. 254, N 2,— Pt I.— P. 231—236.
55. Zorzano A., Josuncion M. A., Herrera E. // Metabolism.— 1983 — Vol. 35, N 4,— P. 297—303.
Об авторах
Э. С. Махмудов
Институт физиологии АН Узбекистана
Узбекистан
В. А. Ходжиматов
Институт физиологии АН Узбекистана
Узбекистан
Содержание 3-гидроксимасляной кислоты, свободного инсулина и глюкагона у больных панкреатическим диабетом | Тэруо
Известно, что у больных инсулинзависимым сахарным диабетом (ИЗСД) имеется нарушение выделения инсулина. При прекращении лечения инсулином или при воздействии стресса у них может быстро развиться диабетический кетоацидоз. Причиной этого является уменьшение содержания свободного инсулина в крови.
Причиной этого является уменьшение содержания свободного инсулина в крови.
У больных панкреатическим диабетом (ПД) (по классификации ВОЗ: диабет, связанный с заболеванием поджелудочной железы) также имеется эндогенное нарушение выделения инсулина 13]. Однако у них диабетический кетоацидоз проявляется реже |4]. Из 92 пациентов с хроническим панкреатитом и ПД у 11 (12%) больных в анамнезе хотя бы раз была положительная реакция на кетоновые тела, а кетоацидоз был только у 3 пациентов.
При изучении выделения С-пептида с мочой выяснилось, что его содержание не определялось или было очень незначительным как у больных- ПД, так и больных ИЗСД [3]. Следовательно, происхождение кетоацидоза нельзя связывать лишь со способностью поджелудочной железы к выделению инсулина.
Мы изучали механизмы возникновения кетоацидоза у больных ПД и ИЗСД. В качестве показателя определяли активность 3-гидроксимасля- ной кислоты (3-ГМК) в крови [2]. Одновременно измеряли содержание свободного инсулина и глюкагона.
Материалы и методы
Обследованы 25 больных Г1Д и диабетом, в том числе 16
- с калькулезным хроническим панкреатитом (с кальцинозом поджелудочной железы; 14 — находились на инсулиноте- рапии, 2 — на диетотерапии), 6 больных диабетом без каль- кулезного хронического панкреатита (в соответствии с критериями хронического панкреатита Японского общества по изучению поджелудочной железы), все больные находились на инсулинотерапии, 3 больных диабетом, возникшим после резекции поджелудочной железы, получали инсулин.
Кроме того, обследовано 20 бальных ИЗСД и 52 больных инсулиннезависимым сахарным диабетом (ИНЗСД), в том числе 18 находились на лечении лишь диетой (ИНЗСД-Д), 8
- получали пероральные сахаропонижающие (ПСС) средства (ИНЗСД-ПСС), 26 — инсулин (ИНЗСД-И).
У больных брали кровь натощак и определяли содержание сахара (“Диагурка”), свободных жирных кислот — СЖК (“Яторон”), молочной кислоты, НВА| и НВА1с, 3-ГМК (“Санва”). Антитела к инсулину и свободный инсулин определяли по методу Накагава, глюкагон — при помощи ра- диоиммунологического анализа.
Результаты и их обсуждение
Как видно из таблицы, содержание сахара в крови натощак у больных ИНЗСД-Д было значительно ниже (127,2 мг%) по сравнению с другими группами, у больных ИНЗСД-ПСС,
Изучаемые показатели у больных ИНЗСД, ИЗСД и ИД
Показатель | Больные ИНЗСД | Больные ИЗСД | Больные ПД | ||
диета | пгс | | инсулин | |||
Сахар в крови натощак, мг% | 127,2 ± 2,4* | 179,8 ± 53,3* | 175,3 ± 52,1*-** | 259,3 ± 97,4*’** | 180,0 ± 97,9* |
(л = 18) | (л = 8) | (л = 26) | (л = 20) | (л = 25) | |
СЖК, ммоль/л | 0,48 ± 0,20* | 0,57 + 0,39 | 0,63 ± 0,37 | 0,79 + 0,35*-** | 0,52 + 0,37** |
(л = 14) | (л = 4) | (л = 20) | (л = 15) | (л = 20) | |
Свободный инсулин, мкЕД/мл | 13,0 ± 5,3** | 13,3 ± 9,6 | 12,8 + 6,2** | 9,4 ± 4,6** | 13,0 ± 5. |
(л = 19) | (л=8) | (л = 25) | (л = 20) | (л = 25) | |
Глюкагон, пг/мл | 125,1 ± 49,5* | 112.4 ± 30,0 | 92,8 ± 27,7 | 98,2 ± 47.3* | 76,2 ± 32,2* |
(л = 19) | (л = 8) | (л = 26) | (л = 20) | (л = 25) | |
Молочная кислота, мг% | 15,1 ± 5,1 | 16,8 ± 3.1 | 13,0 ± 4,7 | 11,8 ± 4,0 | 11,6 ± 4,4 |
(п = 13) | (л = 8) | (« = 21) | (л = 17) | (л = 22) | |
НВА), % | 8,4 ± 0,9* | 11,1 ± 1,9* | 10,5 ± 2,2*-** | 12,3 ± 2,7*-** | 10,7 ± 2,2* •** |
(л = 18) | (л = 8) | (п = 23) | (л = 20) | (л = 22) | |
Антитела к инсулину, % | 6,3 ± 1,2 | 17,7 ± 15,9 | 18,2 ± 12,7 | 22,9 ± 22,3 | |
(л = 4) | (л = 21) | (л = 19) | (л = 22) | ||
Примечание. В скобках — число больных. Достоверность различий: одна звездочка — р < 0,001, две звездочки — р < 0,05.
В скобках — число больных. Достоверность различий: одна звездочка — р < 0,001, две звездочки — р < 0,05.
ИНЗСД-И и ПД оно не различалось (179,8, 175,3, 180 мг% соответственно).
У больных ИЗСД содержание сахара в крови натощак было значительно выше (259,3 мг%) по сравнению с другими группами.
Концентрация СЖК у больных ИЗСД (0,79 ммоль/л) была значительно выше, чем у больных ИНЗСД-Д и ПД. У больных ПД она составляла 0,52 ммоль/л, что аналогично ее значению у больных ИНЗСД.
Содержание молочной кислоты в крови во всех группах существенно не различалось. У больных ПД оно составляло 11,6 мг%, у больных ИЗСД — 11,8 мг%.
Содержание НВА, коррелировало с концентрацией сахара в крови натощак. Самый хоро-
Соотношение концентрации 3-ГМК с величиной Г/И у пациентов с ПД (темный кружок; п = 25) и ИЗСД (светлый кружок; п = 20).
ший контроль (8,4%) был у больных ИНЗСД-Д, самый плохой (12,3%) — у больных ИЗСД. Уровень контроля был аналогичен у больных ПД таковому у больных ИНЗСД-ПСС и ИНЗСД-И.
Не выявлено значительной разницы между группами по уровню антител к инсулину. У больных ИНЗСД-Д, получающих инсулин, он составлял 17,7%, у больных ИЗСД — 18,2%, у больных ПД — 22,9%.
Концентрация свободного инсулина была самой низкой у больных ИЗСД — 9.4 мкЕД/мл. что существенно ниже по сравнению с больными ПД (13,0 мкЕД/мл). У больных ИНЗСД-Д. ИНЗСД-ПСС и ИНЗСД-И она составляла 13,0, 13,3 и 12,8 мкЕД/мл соответственно и нс отличалась от концентрации у больных ПД.
Концентрация глюкагона была самой низкой (76,2 пг/мл) у больных ПД. Выявлена существенная разница между концентрацией гормона у больных ИНЗСД-Д (125,1 пг/мл) и ИНЗСД- ПСС (112,4 пг/мл). У 7 (28%) больных ПД концентрация глюкагона была ниже 50 пг/мл. В группе больных ИЗСД был всего 1 (5%) больной с подобным показателем. Можно предполагать, что при ПД, кроме нарушения функции бета- клетки, имеет место нарушение функции и альфа-клетки.
Как видно на рисунке, глюкагон и инсулин оказывают противоположное влияние на содержание сахара и кетоновых тел. Мы проанализировали отношение глюкагон/инсулин (Г/И). У 3 групп больных ИНЗСД отношение Г/И было равно 9,1-9,7, у больных ИЗСД оно было выше (12,3), а у больных ПД было ниже (6,5).
Мы проанализировали отношение глюкагон/инсулин (Г/И). У 3 групп больных ИНЗСД отношение Г/И было равно 9,1-9,7, у больных ИЗСД оно было выше (12,3), а у больных ПД было ниже (6,5).
Можно думать о том, что у больных ПД содержание свободного инсулина в крови высокое, а значение глюкагона низкое по сравнению с больными ИЗСД, что нашло выражение в низкой величине отношения Г/И.
Концентрация 3-ГМК в крови составляла у больных ИНЗСД-Д 39,3 мкмоль/л, у больных ИНЗСД-ПСС — 68,9 мкмоль/л, у больных ИНЗСД-И — 77,0 мкмоль/л. Как видно, значительной разницы между 3 группами нет. У больных ПД содержание 3-ГМК (92,1 мкмоль/л) было почти такое же, как и у больных ИНЗСД. А у больных ИЗСД оно было значительно выше (431,1 мкмоль/л) в сравнении с показателями в указанных выше группах.
У больных ИЗСД содержание сахара в крови натощак было значительно выше по сравнению с таковым в других 4 группах, поэтому мы рассмотрели отношение 3-ГМК/сахар в крови. .
Во всех группах, кроме больных ИЗСД, отношение 3-ГМК/сахар в крови было в среднем меньше 1. В группе больных ПД только у 1 (5,3%) пациента, а в группе больных ИЗСД у 7 (35%) отношение 3-ГМК/сахар в крови было выше 3.
В группе больных ПД только у 1 (5,3%) пациента, а в группе больных ИЗСД у 7 (35%) отношение 3-ГМК/сахар в крови было выше 3.
В группе больных ИЗСД среди больных с кетоацидозом у 7 человек значения отношения 3- ГМК/сахар в крови были выше 3. Причем самое высокое значение составляло 20,1. С другой стороны, у больного ПД с содержанием сахара в крови 707 мг% уровень 3-ГМК равнялся 1623 мкмоль/л, а отношение 3-ГМК/сахар в крови составляло только 2,3.
Значительная корреляция концентрации 3- ГМК выявлена с отношением Г/И (г = 0,510, р < 0,01) и содержанием СЖК (г = 0,651, р < 0,01). Можно предположить, что СЖК имеют значение в качестве субстрата для образования кетоновых тел; величина Г/И отражает соотношение процессов кетогснеза.
В обмене кетоновых тел можно предположить наличие следующих этапов [6]: 1) увеличение количества СЖК в печени (увеличение количества так называемого субстрата кетоновых тел) [7|; 2) уменьшение содержания ацил-КоА, эстсрифи- цирующегося в качестве нейтрального жира или фосфорного липида [ 8 ]; 3) увеличение содержания карнитина или увеличение уровня ацил-КоА с увеличением активации карнитин-ацилтран- сферазы I; 4) нарушение цикла трикарбоновых кислот или уменьшение употребления ацетил- КоА в результате синтеза жирной кислоты [10].
У больных ИЗСД при прекращении введения экзогенного инсулина наблюдается постепенное увеличение содержания сахара в крови, тогда как концентрация 3-ГМК быстро увеличивается до 3000 мкмоль/л [11]. Инсулин оказывает выраженное действие на ингибирование липолиза и имеет важное значение в качестве показателя для контроля диабета [2|.
Наши результаты показывают значительное увеличение концентрации 3-ГМК наряду е увеличением содержания сахара в крови натощак у больных ИЗСД.
Мы также изучили отношение 3-ГМК/сахар в крови. Показано, что отношение 3-ГМК/сахар в крови может быть использовано в качестве показателя для дифференцирования ПД и ИЗСД, т.е. если отношение 3-ГМК/сахар в крови выше 3, то можно предположить наличие ИЗСД (отношение 3-ГМК/сахар в крови больше 3 отмечается у 1/3 больных ИЗСД).
Показано наличие отрицательной корреляции концентрации 3-ГМК с содержанием свободного инсулина и отношения 3-ГМК/сахар в крови с содержанием свободного инсулина. На основании этого можно думать, что концентрация свободного инсулина в крови — один из факторов, определяющих содержание кетоновых тел. На самом деле, многие авторы подчеркивают, что снижение концентрации свободного инсулина тесно связано с увеличением количества кетоновых тел у больных ИЗСД. Можно предположить, что глюкагон является другим фактором, способствующим увеличению количества кетоновых тел в крови [12-141. Глюкагон влияет на процессы гликогенолиза и кетогснеза в печени [15-18].
На самом деле, многие авторы подчеркивают, что снижение концентрации свободного инсулина тесно связано с увеличением количества кетоновых тел у больных ИЗСД. Можно предположить, что глюкагон является другим фактором, способствующим увеличению количества кетоновых тел в крови [12-141. Глюкагон влияет на процессы гликогенолиза и кетогснеза в печени [15-18].
Наши результаты показывают, что отношение Г/И имеет важное значение в качестве показателя увеличения количества 3-ГМК, т.е. показателя диабетического кетоацидоза.
- Matsui и соавт. 119] показали, что у крыс е аллоксановым диабетом концентрация 3-ГМК и СЖК в крови значительно выше, чем у крыс с трифениловым диабетом. Это можно объяснить тем, что у крыс с аллоксановым диабетом было повышено количество глюкагона (отношение Г/И высокое) наряду е недостаточностью инсулина, тогда как у крыс с трифениловым диабетом содержание глюкагона повышено не было (отношение Г/И низкое).
Основываясь на приведенных фактах, можно предположить, что если отношение Г/И повышается (ИЗСД) за счет уменьшения количества инсулина, то снижается ингибирование липолиза и увеличивается количество СЖК в крови. ваниа кетоновых тел целесообразно определять в качестве одного из показателей отношение Г/И.
ваниа кетоновых тел целесообразно определять в качестве одного из показателей отношение Г/И.
Инсулин, глюкагон и регуляция уровня глюкозы в крови
Человеческому организму необходимо поддерживать уровень глюкозы в крови (сахар в крови) в очень узком диапазоне. Инсулин и глюкагон являются гормонами, которые делают это возможным.
И инсулин, и глюкагон секретируются поджелудочной железой, поэтому их называют эндокринными гормонами поджелудочной железы. На рисунке справа показана тесная связь инсулина и глюкагона друг с другом.
Обратите внимание, что поджелудочная железа играет центральную роль в этой схеме. Именно выработка инсулина и глюкагона поджелудочной железой в конечном итоге определяет наличие у пациента диабета, гипогликемии или какой-либо другой проблемы с сахаром.
Уровни инсулина и глюкозы в крови
Инсулин и глюкагон являются гормонами, секретируемыми островковыми клетками поджелудочной железы. Они оба секретируются в ответ на уровень сахара в крови, но противоположным образом.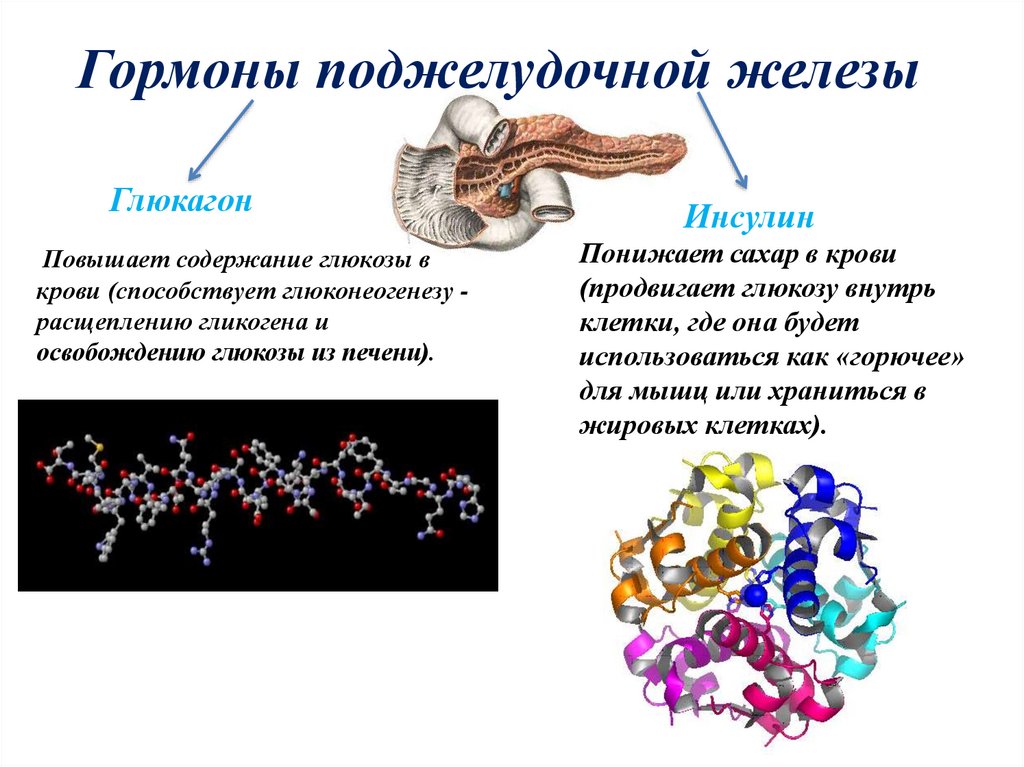
В норме инсулин секретируется бета-клетками (разновидностью островковых клеток) поджелудочной железы. Стимулом для секреции инсулина является высокий уровень глюкозы в крови — это так просто. Хотя уровень инсулина, секретируемого поджелудочной железой, всегда низкий, его количество, секретируемое в кровь, увеличивается по мере повышения уровня глюкозы в крови. Точно так же, когда уровень глюкозы в крови падает, количество инсулина, секретируемого островками поджелудочной железы, снижается.
Инсулин воздействует на ряд клеток, включая мышцы, красную кровь и жир. В ответ на инсулин эти клетки поглощают глюкозу из крови, в результате чего высокий уровень глюкозы в крови снижается до нормального уровня.
Как рецептурный инсулин контролирует уровень глюкозы в крови При диабете 1 типа поджелудочная железа не вырабатывает инсулин. В этом случае необходимо принимать инсулин, отпускаемый по рецепту, для контроля уровня глюкозы в крови. Людям с диабетом 2 типа также может потребоваться прием инсулина или пероральных лекарств от диабета для контроля уровня глюкозы в крови.
Инсулин нельзя принимать внутрь, так как он плохо всасывается во рту. Кроме того, инсулин быстро расщепляется желудочной кислотой. Поэтому инсулин необходимо вводить под кожу или вдыхать, и его можно вводить несколькими путями: шприцами, ручками, инсулиновыми помпами и ингаляторами.
Инсулин, вводимый через шприц, поставляется во флаконе. Вы должны набрать дозу в шприц, чтобы принять предписанную дозу. Инсулиновые шприц-ручки, одноразовые или многоразовые, предварительно заполнены инсулином. Для каждой дозы на шприц-ручку навинчивается новый колпачок.
Инсулиновая помпа — это небольшое устройство, которое вводит инсулин через трубку, вставленную в кожу. Помпа имитирует функцию поджелудочной железы, доставляя небольшое количество инсулина в течение 24 часов в сутки. Вы также можете настроить доставку дозы инсулина во время еды.
Как это ни звучит, ингаляционный инсулин вдыхают через ингалятор. Ингаляционный инсулин принимают до начала приема пищи.
Инсулин, отпускаемый по рецепту, можно полностью настроить в соответствии с вашими потребностями. Существует не только несколько способов введения инсулина, но и различные типы инсулина на выбор. Инсулин классифицируется по началу, пику и продолжительности действия. Начало — это когда инсулин начинает работать в организме. Пик действия инсулина наступает, когда он наиболее эффективен и имеет наибольшую силу. Продолжительность — это то, как долго инсулин будет способствовать снижению уровня глюкозы.
Существует не только несколько способов введения инсулина, но и различные типы инсулина на выбор. Инсулин классифицируется по началу, пику и продолжительности действия. Начало — это когда инсулин начинает работать в организме. Пик действия инсулина наступает, когда он наиболее эффективен и имеет наибольшую силу. Продолжительность — это то, как долго инсулин будет способствовать снижению уровня глюкозы.
Болюсный инсулин представляет собой инсулин короткого или короткого действия, который принимается перед едой для контроля уровня глюкозы. Болюсный инсулин имеет быстрое начало действия, достигая пика в период от 10 минут до трех часов после его приема, и, кроме того, он действует в среднем от двух до шести часов. Инсулин быстрого или короткого действия также можно принимать для коррекции высокого уровня глюкозы в крови.
Для контроля уровня глюкозы на ночь или между приемами пищи назначают базальный инсулин. Базальный инсулин представляет собой инсулин средней продолжительности действия или инсулин длительного действия. Обычно используется инсулиновая схема, включающая как базальный, так и болюсный инсулин, особенно у людей с диабетом 1 типа.
Обычно используется инсулиновая схема, включающая как базальный, так и болюсный инсулин, особенно у людей с диабетом 1 типа.
Инсулин не просто снижает уровень глюкозы в крови. Инсулин — это запасной гормон, который способствует выработке жира и препятствует его расщеплению. В печени инсулин позволяет глюкозе превращаться в гликоген. Гликоген – это запасенная глюкоза, которая расщепляется, когда организм нуждается в энергии. Инсулин также предотвращает выработку глюкозы из других питательных веществ.
В мышцах инсулин способствует образованию гликогена и белка, не давая организму расщеплять белок. Инсулин регулирует уровень глюкозы и тесно связан с глюкагоном.
Глюкагон и контроль уровня глюкозы в крови
Глюкагон секретируется альфа-клетками островков поджелудочной железы почти так же, как инсулин, но в обратном направлении. Если уровень глюкозы в крови высокий, то глюкагон не секретируется.
Однако, когда уровень глюкозы в крови падает (например, между приемами пищи и во время физических упражнений), секретируется все больше и больше глюкагона.
Подобно инсулину, глюкагон оказывает влияние на многие клетки организма, но особенно на печень.
Эффект глюкагона заключается в том, чтобы заставить печень высвобождать глюкозу, хранящуюся в ее клетках, в кровоток, что приводит к повышению уровня глюкозы в крови. Глюкагон также побуждает печень (и некоторые другие клетки, такие как мышцы) производить глюкозу из строительных блоков, полученных из других питательных веществ, содержащихся в организме, таких как белок.
Как действует рецепт ГлюкагонГлюкагон назначают для лечения случаев тяжелой гипогликемии или низкого уровня глюкозы в крови. Его часто назначают, если вы принимаете лекарства, снижающие уровень глюкозы, такие как инсулин или сульфонилмочевина. Глюкагон быстро повышает уровень глюкозы в крови.
Глюкагон, отпускаемый по рецепту, доступен в нескольких формах, и его можно держать под рукой на случай чрезвычайной ситуации. Устройство для назального глюкагона доставляет порошкообразный глюкагон в кровь через нос. Ручка с глюкагоном предварительно заполнена смешанным раствором глюкагона и готова к немедленной инъекции. Если назальный или предварительно заполненный глюкагон не подходит, есть набор глюкагона, который можно быстро смешать и приготовить.
Ручка с глюкагоном предварительно заполнена смешанным раствором глюкагона и готова к немедленной инъекции. Если назальный или предварительно заполненный глюкагон не подходит, есть набор глюкагона, который можно быстро смешать и приготовить.
Глюкагон часто используется, когда вы не можете есть источник углеводов для повышения уровня глюкозы. Членам семьи, друзьям, школьному персоналу или коллегам рекомендуется знать, как использовать глюкагон на случай, если вы недостаточно рассудительны, чтобы сделать это самостоятельно. Если человек без сознания, его следует положить на бок, чтобы он не задохнулся. Кроме того, когда глюкагон начинает действовать, человек должен есть углеводы (фрукты, фруктовые соки, таблетки с глюкозой и т. д.), чтобы еще больше повысить уровень глюкозы.
Что еще делает глюкагон в организме Помимо повышения уровня глюкозы, глюкагон играет в организме и другие функции. В жировой ткани глюкагон помогает стимулировать расщепление жира, обеспечивая организм энергией при низком уровне глюкозы. Другие эффекты глюкагона включают увеличение частоты сердечных сокращений и замедление пищеварения.
Другие эффекты глюкагона включают увеличение частоты сердечных сокращений и замедление пищеварения.
На что может указывать уровень глюкозы в крови
Наше тело хочет, чтобы уровень глюкозы в крови поддерживался на уровне от 70 мг/дл до 110 мг/дл (мг/дл означает миллиграммы глюкозы в 100 миллилитрах крови). Ниже 70 называется гипогликемией. Выше 110 может быть нормальным, если вы ели в последние 2-3 часа. Вот почему ваш врач хочет измерить уровень глюкозы в крови во время голодания, когда уровень должен быть между 70 и 110.
Однако даже после того, как вы поели, уровень глюкозы должен быть ниже 180. Выше 180 называется гипергликемией (что переводится как «слишком много глюкозы в крови»). Если уровень сахара в крови выше 200 после употребления воды с сахаром (тест на толерантность к глюкозе), то у вас диагностирован диабет.
Четыре способа приема инсулина: https://www.cdc.gov/diabetes/basics/type-1-4-ways-to-take-insulin.html
Комитет профессиональной практики Американской диабетической ассоциации, Draznin B, Aroda В. Р., Бакрис Г., Бенсон Г., Браун Ф.М., Фриман Р., Грин Дж., Хуан Э., Исаакс Д., Кахан С., Леон Дж., Лайонс С.К., Питерс А.Л., Прахалад П., Ройш ДЖЕБ, Янг-Хайман Д. 9. Фармакологические подходы к лечению гликемии: стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S125-S143. дои: 10.2337/dc22-S009. PMID: 34964831.
Р., Бакрис Г., Бенсон Г., Браун Ф.М., Фриман Р., Грин Дж., Хуан Э., Исаакс Д., Кахан С., Леон Дж., Лайонс С.К., Питерс А.Л., Прахалад П., Ройш ДЖЕБ, Янг-Хайман Д. 9. Фармакологические подходы к лечению гликемии: стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S125-S143. дои: 10.2337/dc22-S009. PMID: 34964831.
Глюкагон и другие экстренные препараты глюкозы: https://diabetes.org/healthy-living/medication-treatments/glucagon-other-emergency-glucose-products
Комитет по профессиональной практике Американской диабетической ассоциации, Draznin B, Aroda VR, Bakris G, Benson G, Brown FM, Freeman R, Green J, Huang E, Isaacs D, Kahan S, Leon J, Lyons SK, Peters AL, Prahalad P, Reusch JEB, Young-Hyman D. 6. Гликемический индекс Цели: Стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S83-S96. дои: 10.2337/dc22-S006. PMID: 34964868.
Глюкагон: https://www. ncbi.nlm.nih.gov/books/NBK559195/
ncbi.nlm.nih.gov/books/NBK559195/
Zeigerer A, Sekar R, Kleinert M, et al. Метаболическое действие глюкагона в норме и при болезнях. Комплексная физиология. 2021;11(2):1759-1783. doi:10.1002/cphy.c200013
Al-Massadi O, Fernø J, Diéguez C, et al. Глюкагон контролирует потребление пищи и энергетический баланс. Международный журнал молекулярных наук. 2019;20(16):3905. doi:10.3390/ijms20163905
Iqbal J, Wu H, Hu N, et al. Влияние агонистов рецептора глюкагоноподобного пептида-1 на массу тела у взрослых с ожирением без сахарного диабета — систематический обзор и метаанализ рандомизированных контролируемых исследований. Обзоры ожирения. 2022;23(6). doi:10.1111/obr.13435
Примечания: эта статья была первоначально опубликована 29 марта 2009 г. и последний раз обновлялась 24 января 2023 г.0106 Клиника паращитовидной железы Нормана
Джеймс Норман, доктор медицины, FACS, FACE, признан одним из ведущих мировых экспертов по заболеваниям паращитовидной железы и самым опытным хирургом щитовидной железы/паращитовидной железы в мире. Он сертифицирован как в хирургии, так и в эндокринологии, а также является членом Американского колледжа хирургов (FACS) и Американского колледжа эндокринологии (FACE). Он признан изобретателем минимально инвазивной хирургии паращитовидной железы в середине 1990-х годов, и ему приписывают радикальное изменение способа проведения операции на паращитовидной железе.
Он сертифицирован как в хирургии, так и в эндокринологии, а также является членом Американского колледжа хирургов (FACS) и Американского колледжа эндокринологии (FACE). Он признан изобретателем минимально инвазивной хирургии паращитовидной железы в середине 1990-х годов, и ему приписывают радикальное изменение способа проведения операции на паращитовидной железе.
Инсулин, глюкагон и регулирование уровня глюкозы в крови
Человеческому организму необходимо поддерживать уровень глюкозы в крови (сахар в крови) в очень узком диапазоне. Инсулин и глюкагон являются гормонами, которые делают это возможным.
И инсулин, и глюкагон секретируются поджелудочной железой, поэтому их называют эндокринными гормонами поджелудочной железы. На рисунке справа показана тесная связь инсулина и глюкагона друг с другом.
Обратите внимание, что поджелудочная железа играет центральную роль в этой схеме. Именно выработка инсулина и глюкагона поджелудочной железой в конечном итоге определяет наличие у пациента диабета, гипогликемии или какой-либо другой проблемы с сахаром.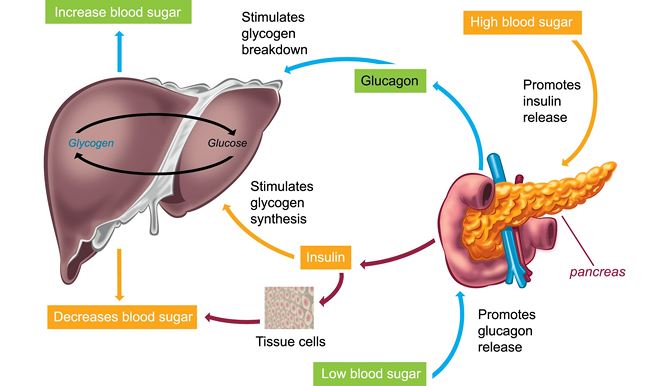
Уровни инсулина и глюкозы в крови
Инсулин и глюкагон являются гормонами, секретируемыми островковыми клетками поджелудочной железы. Они оба секретируются в ответ на уровень сахара в крови, но противоположным образом.
В норме инсулин секретируется бета-клетками (разновидностью островковых клеток) поджелудочной железы. Стимулом для секреции инсулина является высокий уровень глюкозы в крови — это так просто. Хотя уровень инсулина, секретируемого поджелудочной железой, всегда низкий, его количество, секретируемое в кровь, увеличивается по мере повышения уровня глюкозы в крови. Точно так же, когда уровень глюкозы в крови падает, количество инсулина, секретируемого островками поджелудочной железы, снижается.
Инсулин воздействует на ряд клеток, включая мышцы, красную кровь и жир. В ответ на инсулин эти клетки поглощают глюкозу из крови, в результате чего высокий уровень глюкозы в крови снижается до нормального уровня.
Как рецептурный инсулин контролирует уровень глюкозы в крови При диабете 1 типа поджелудочная железа не вырабатывает инсулин. В этом случае необходимо принимать инсулин, отпускаемый по рецепту, для контроля уровня глюкозы в крови. Людям с диабетом 2 типа также может потребоваться прием инсулина или пероральных лекарств от диабета для контроля уровня глюкозы в крови.
В этом случае необходимо принимать инсулин, отпускаемый по рецепту, для контроля уровня глюкозы в крови. Людям с диабетом 2 типа также может потребоваться прием инсулина или пероральных лекарств от диабета для контроля уровня глюкозы в крови.
Инсулин нельзя принимать внутрь, так как он плохо всасывается во рту. Кроме того, инсулин быстро расщепляется желудочной кислотой. Поэтому инсулин необходимо вводить под кожу или вдыхать, и его можно вводить несколькими путями: шприцами, ручками, инсулиновыми помпами и ингаляторами.
Инсулин, вводимый через шприц, поставляется во флаконе. Вы должны набрать дозу в шприц, чтобы принять предписанную дозу. Инсулиновые шприц-ручки, одноразовые или многоразовые, предварительно заполнены инсулином. Для каждой дозы на шприц-ручку навинчивается новый колпачок.
Инсулиновая помпа — это небольшое устройство, которое вводит инсулин через трубку, вставленную в кожу. Помпа имитирует функцию поджелудочной железы, доставляя небольшое количество инсулина в течение 24 часов в сутки.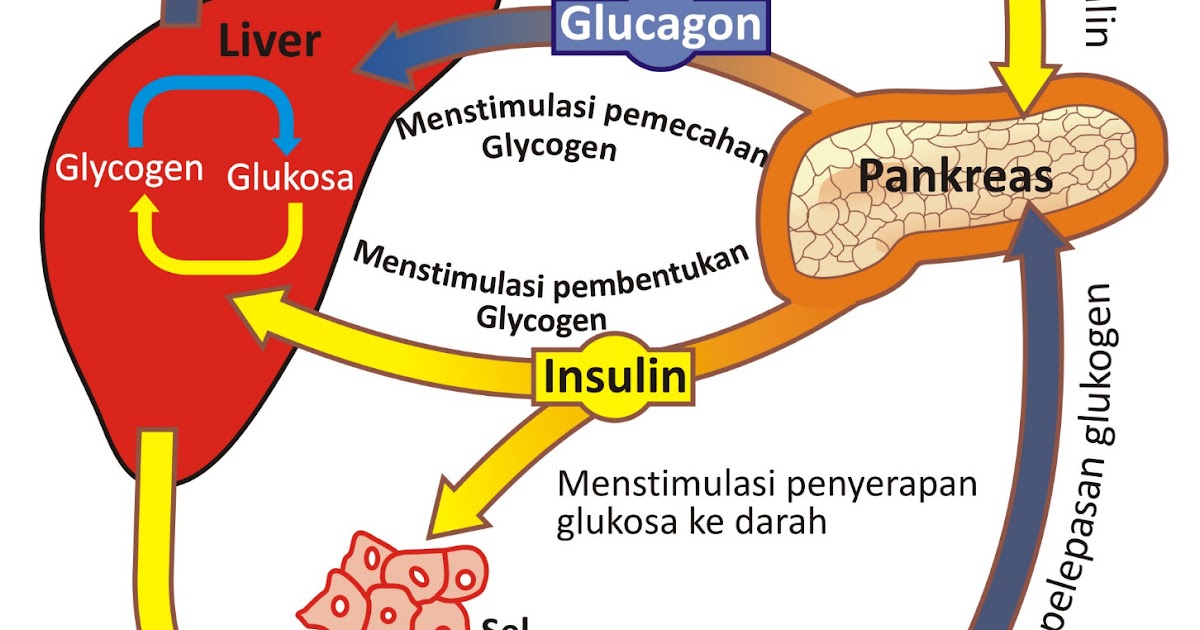 Вы также можете настроить доставку дозы инсулина во время еды.
Вы также можете настроить доставку дозы инсулина во время еды.
Как это ни звучит, ингаляционный инсулин вдыхают через ингалятор. Ингаляционный инсулин принимают до начала приема пищи.
Инсулин, отпускаемый по рецепту, можно полностью настроить в соответствии с вашими потребностями. Существует не только несколько способов введения инсулина, но и различные типы инсулина на выбор. Инсулин классифицируется по началу, пику и продолжительности действия. Начало — это когда инсулин начинает работать в организме. Пик действия инсулина наступает, когда он наиболее эффективен и имеет наибольшую силу. Продолжительность — это то, как долго инсулин будет способствовать снижению уровня глюкозы.
Болюсный инсулин представляет собой инсулин короткого или короткого действия, который принимается перед едой для контроля уровня глюкозы. Болюсный инсулин имеет быстрое начало действия, достигая пика в период от 10 минут до трех часов после его приема, и, кроме того, он действует в среднем от двух до шести часов.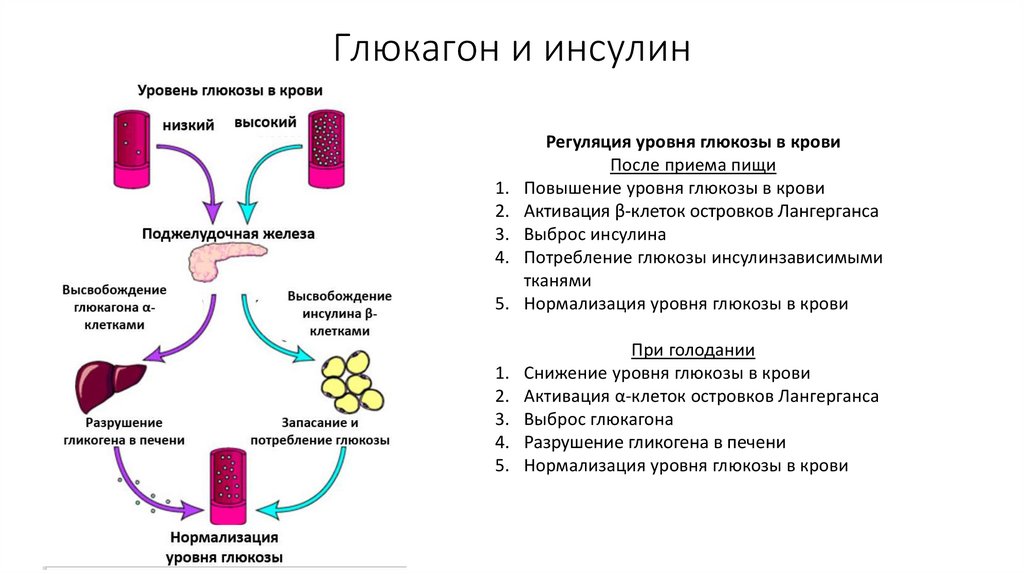 Инсулин быстрого или короткого действия также можно принимать для коррекции высокого уровня глюкозы в крови.
Инсулин быстрого или короткого действия также можно принимать для коррекции высокого уровня глюкозы в крови.
Для контроля уровня глюкозы на ночь или между приемами пищи назначают базальный инсулин. Базальный инсулин представляет собой инсулин средней продолжительности действия или инсулин длительного действия. Обычно используется инсулиновая схема, включающая как базальный, так и болюсный инсулин, особенно у людей с диабетом 1 типа.
Что еще делает инсулин в организмеИнсулин не просто снижает уровень глюкозы в крови. Инсулин — это запасной гормон, который способствует выработке жира и препятствует его расщеплению. В печени инсулин позволяет глюкозе превращаться в гликоген. Гликоген – это запасенная глюкоза, которая расщепляется, когда организм нуждается в энергии. Инсулин также предотвращает выработку глюкозы из других питательных веществ.
В мышцах инсулин способствует образованию гликогена и белка, не давая организму расщеплять белок. Инсулин регулирует уровень глюкозы и тесно связан с глюкагоном.
Глюкагон и контроль уровня глюкозы в крови
Глюкагон секретируется альфа-клетками островков поджелудочной железы почти так же, как инсулин, но в обратном направлении. Если уровень глюкозы в крови высокий, то глюкагон не секретируется.
Однако, когда уровень глюкозы в крови падает (например, между приемами пищи и во время физических упражнений), секретируется все больше и больше глюкагона.
Подобно инсулину, глюкагон оказывает влияние на многие клетки организма, но особенно на печень.
Эффект глюкагона заключается в том, чтобы заставить печень высвобождать глюкозу, хранящуюся в ее клетках, в кровоток, что приводит к повышению уровня глюкозы в крови. Глюкагон также побуждает печень (и некоторые другие клетки, такие как мышцы) производить глюкозу из строительных блоков, полученных из других питательных веществ, содержащихся в организме, таких как белок.
Как действует рецепт Глюкагон Глюкагон назначают для лечения случаев тяжелой гипогликемии или низкого уровня глюкозы в крови.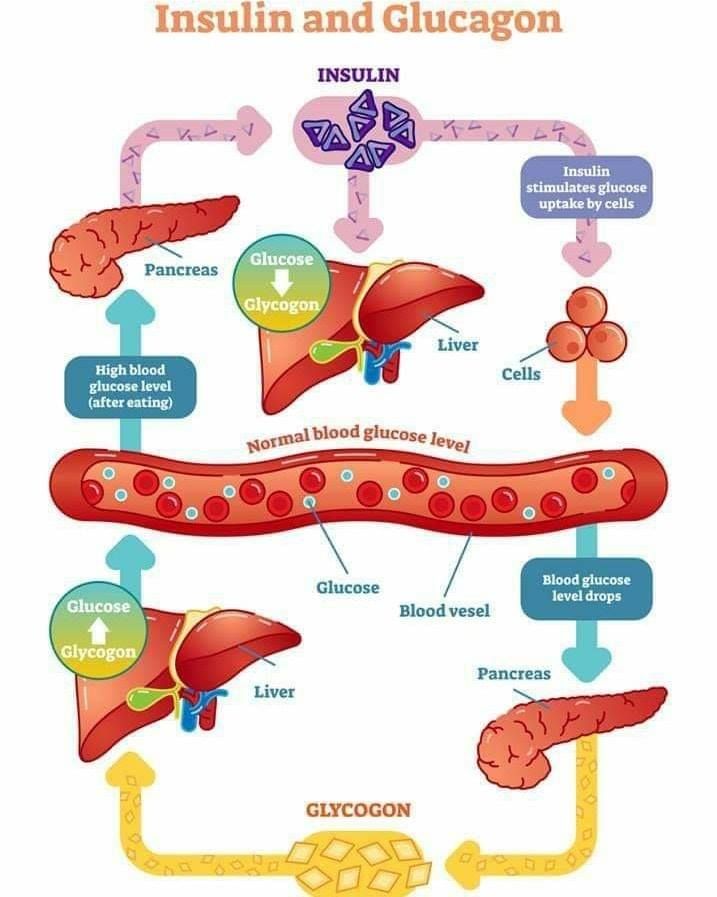 Его часто назначают, если вы принимаете лекарства, снижающие уровень глюкозы, такие как инсулин или сульфонилмочевина. Глюкагон быстро повышает уровень глюкозы в крови.
Его часто назначают, если вы принимаете лекарства, снижающие уровень глюкозы, такие как инсулин или сульфонилмочевина. Глюкагон быстро повышает уровень глюкозы в крови.
Глюкагон, отпускаемый по рецепту, доступен в нескольких формах, и его можно держать под рукой на случай чрезвычайной ситуации. Устройство для назального глюкагона доставляет порошкообразный глюкагон в кровь через нос. Ручка с глюкагоном предварительно заполнена смешанным раствором глюкагона и готова к немедленной инъекции. Если назальный или предварительно заполненный глюкагон не подходит, есть набор глюкагона, который можно быстро смешать и приготовить.
Глюкагон часто используется, когда вы не можете есть источник углеводов для повышения уровня глюкозы. Членам семьи, друзьям, школьному персоналу или коллегам рекомендуется знать, как использовать глюкагон на случай, если вы недостаточно рассудительны, чтобы сделать это самостоятельно. Если человек без сознания, его следует положить на бок, чтобы он не задохнулся. Кроме того, когда глюкагон начинает действовать, человек должен есть углеводы (фрукты, фруктовые соки, таблетки с глюкозой и т. д.), чтобы еще больше повысить уровень глюкозы.
Кроме того, когда глюкагон начинает действовать, человек должен есть углеводы (фрукты, фруктовые соки, таблетки с глюкозой и т. д.), чтобы еще больше повысить уровень глюкозы.
Помимо повышения уровня глюкозы, глюкагон играет в организме и другие функции. В жировой ткани глюкагон помогает стимулировать расщепление жира, обеспечивая организм энергией при низком уровне глюкозы. Другие эффекты глюкагона включают увеличение частоты сердечных сокращений и замедление пищеварения.
На что может указывать уровень глюкозы в крови
Наше тело хочет, чтобы уровень глюкозы в крови поддерживался на уровне от 70 мг/дл до 110 мг/дл (мг/дл означает миллиграммы глюкозы в 100 миллилитрах крови). Ниже 70 называется гипогликемией. Выше 110 может быть нормальным, если вы ели в последние 2-3 часа. Вот почему ваш врач хочет измерить уровень глюкозы в крови во время голодания, когда уровень должен быть между 70 и 110.
Однако даже после того, как вы поели, уровень глюкозы должен быть ниже 180.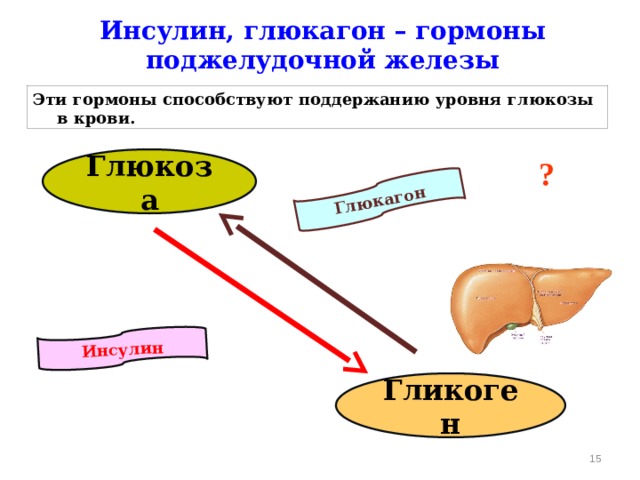 Выше 180 называется гипергликемией (что переводится как «слишком много глюкозы в крови»). Если уровень сахара в крови выше 200 после употребления воды с сахаром (тест на толерантность к глюкозе), то у вас диагностирован диабет.
Выше 180 называется гипергликемией (что переводится как «слишком много глюкозы в крови»). Если уровень сахара в крови выше 200 после употребления воды с сахаром (тест на толерантность к глюкозе), то у вас диагностирован диабет.
Четыре способа приема инсулина: https://www.cdc.gov/diabetes/basics/type-1-4-ways-to-take-insulin.html
Комитет профессиональной практики Американской диабетической ассоциации, Draznin B, Aroda В.Р., Бакрис Г., Бенсон Г., Браун Ф.М., Фриман Р., Грин Дж., Хуан Э., Исаакс Д., Кахан С., Леон Дж., Лайонс С.К., Питерс А.Л., Прахалад П., Ройш ДЖЕБ, Янг-Хайман Д. 9. Фармакологические подходы к лечению гликемии: стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S125-S143. дои: 10.2337/dc22-S009. PMID: 34964831.
Глюкагон и другие экстренные препараты глюкозы: https://diabetes.org/healthy-living/medication-treatments/glucagon-other-emergency-glucose-products
Комитет по профессиональной практике Американской диабетической ассоциации, Draznin B, Aroda VR, Bakris G, Benson G, Brown FM, Freeman R, Green J, Huang E, Isaacs D, Kahan S, Leon J, Lyons SK, Peters AL, Prahalad P, Reusch JEB, Young-Hyman D. 6. Гликемический индекс Цели: Стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S83-S96. дои: 10.2337/dc22-S006. PMID: 34964868.
6. Гликемический индекс Цели: Стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S83-S96. дои: 10.2337/dc22-S006. PMID: 34964868.
Глюкагон: https://www.ncbi.nlm.nih.gov/books/NBK559195/
Zeigerer A, Sekar R, Kleinert M, et al. Метаболическое действие глюкагона в норме и при болезнях. Комплексная физиология. 2021;11(2):1759-1783. doi:10.1002/cphy.c200013
Al-Massadi O, Fernø J, Diéguez C, et al. Глюкагон контролирует потребление пищи и энергетический баланс. Международный журнал молекулярных наук. 2019;20(16):3905. doi:10.3390/ijms20163905
Iqbal J, Wu H, Hu N, et al. Влияние агонистов рецептора глюкагоноподобного пептида-1 на массу тела у взрослых с ожирением без сахарного диабета — систематический обзор и метаанализ рандомизированных контролируемых исследований. Обзоры ожирения. 2022;23(6). doi:10.1111/obr.13435
Примечания: эта статья была первоначально опубликована 29 марта 2009 г.

 5**
5**