Глюкагон гормон: Глюкагон — описание вещества, фармакология, применение, противопоказания, формула
Глюкагон и глюконеогенез. Регуляция секреции глюкагона
Обновлено: 10.12.2022
Еще до открытия инсулина в островках поджелудочной железы были обнаружены разные группы клеток. Сам глюкагон был открыт Мерлином и Кимбаллом в 1923 г., менее чем через 2 года после инсулина. Однако если открытие инсулина вызвало ажиотаж, то глюкагоном мало кто заинтересовался. Только по прошествии более 40 лет стало ясно, какую важную физиологическую роль играет этот гормон в регуляции обмена глюкозы и кетоновых тел, но его роль как лекарственного средства и на сегодняшний день невелика. Глюкагон используют лишь для быстрого купирования гипогликемии, а также в лучевой диагностике в качестве препарата, подавляющего моторику кишечника.
Глюкагон представляет собой одноцепочечный полипептид, состоящий из 29 аминокислотных остатков (рис. 61.6). Между глюкагоном и другими полипептидными гормонами, в том числе секретином, ВИП и гастроингибирующим пептидом, имеется значительная гомология. Аминокислотная последовательность глюкагона у млекопитающих высококонсервативна; она одинакова у человека, коровы, свиньи и крысы.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислот и пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды (Mojsov et al., 1986). Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Секреция глюкагона регулируется глюкозой, поступающей с пищей, инсулином, аминокислотами и жирными кислотами. Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Большинство аминокислот стимулируют секрецию и глюкагона, и инсулина. Это объясняет, почему после приема чисто белковой пищи у человека не возникает опосредованная инсулином гипогликемия. Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина. У здоровых людей в ответ на гипогликемию секреция глюкагона увеличивается, а при инсулинозависимом сахарном диабете этот важный защитный механизм утрачивается еще в самом начале болезни.
Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина. У здоровых людей в ответ на гипогликемию секреция глюкагона увеличивается, а при инсулинозависимом сахарном диабете этот важный защитный механизм утрачивается еще в самом начале болезни.
Глюкагон быстро разрушается в печени, почках и плазме, а также в тканях-мишенях (Peterson etal., 1982). EroT1/2 в плазме составляет всего 3—6 мин. Отщепление протеазами N-концевого остатка гистидина приводит к потере глюкагоном биологической активности.
Глюкагон связывается с рецептором на мембране клеток-мишеней; этот рецептор представляет собой гликопротеид с молекулярной массой 60 ООО (Sheetz and Tager, 1988). Структура рецептора полностью не расшифрована, однако известно, что он сопряжен с Gj-белком, который активирует аденилатциклазу (гл. 2). Главный эффект глюкагона на гепатоциты опосредуется цАМФ. Модификация N-концевого участка молекулы глюкагона превращает его в частичный агонист: сродство к рецептору в той или иной степени сохраняется, а способность активировать аденилатциклазу в значительной степени утрачивается (Unson et al., 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
Посредством цАМФ-зависимого фосфорилирования глюкагон активирует фосфорилазу — фермент, который катализирует лимитирующую реакцию гликогенолиза. Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
цАМФ опосредует фосфорилирование еще одного бифункционального фермента — 6-фосфофрукто-2-киназы/фрукто-зо-2,6-дифосфатазы (Pilkis et al., 1981; Foster, 1984). От этого фермента зависит внутриклеточная концентрация фруктозо-2,6-дифосфата, который, в свою очередь, регулирует глюконеогенез и гликогенолиз. Когда концентрация глюкагона высока, а инсулина низка, 6-фосфофрукто-2-киназа/фрукго-зо-2,6-дифосфатаза фосфорилируется и работает как фосфата-за, снижая содержание фруктозо-2,6-дифосфата в печени. Когда концентрация инсулина высока, а глюкагона низка, фермент дефосфорилируется и работает как киназа, увеличивая содержание фрукгозо-2,6-дифосфата.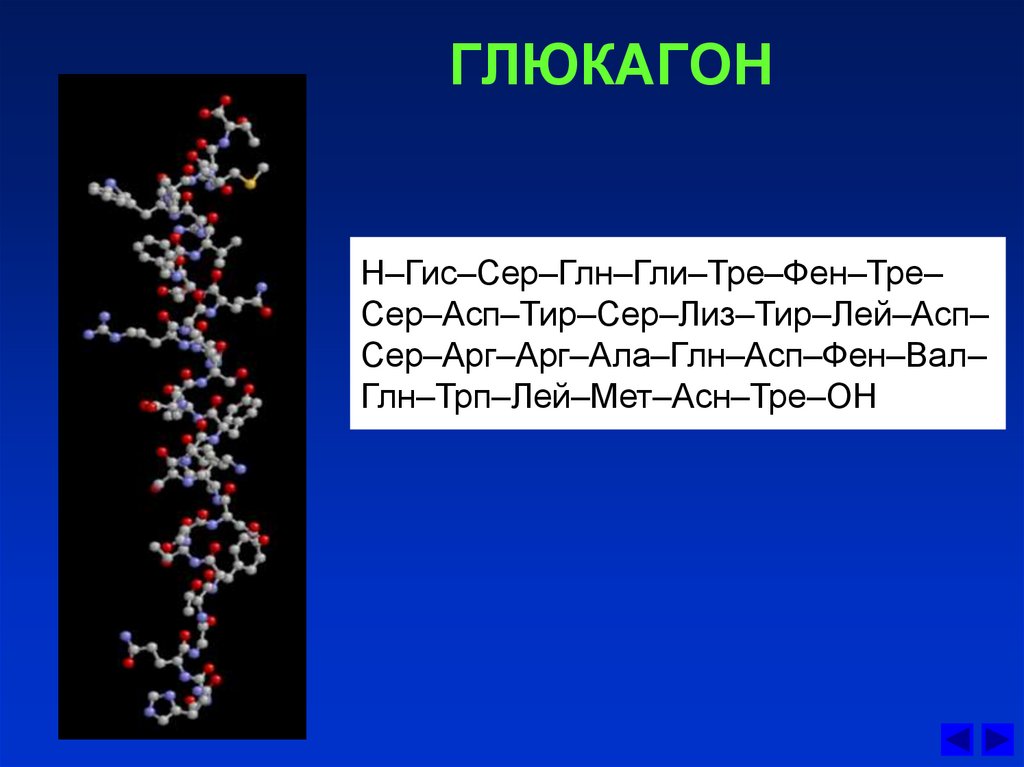 Фруктозо-2,6-дифосфат является аллостерическим активатором фосфофруктокиназы — фермента, который катализирует лимитирующую реакцию гликолиза. Таким образом, когда концентрация глюкагона высока, гликолиз тормозится, а глюконеогенез усиливается. Это приводит к увеличению уровня малонил-КоА, ускорению окисления жирных кислот и кетогенезу. Напротив, когда высока концентрация инсулина, гликолиз усиливается, а глюконеогенез и ке-тогенез подавляются (Foster, 1984).
Фруктозо-2,6-дифосфат является аллостерическим активатором фосфофруктокиназы — фермента, который катализирует лимитирующую реакцию гликолиза. Таким образом, когда концентрация глюкагона высока, гликолиз тормозится, а глюконеогенез усиливается. Это приводит к увеличению уровня малонил-КоА, ускорению окисления жирных кислот и кетогенезу. Напротив, когда высока концентрация инсулина, гликолиз усиливается, а глюконеогенез и ке-тогенез подавляются (Foster, 1984).
Глюкагон, особенно в высоких концентрациях, действует не только на печень, но и на другие ткани. В жировой ткани он активирует аденилатциклазу и усиливает липолиз, в миокарде — увеличивает силу сердечных сокращений. Глюкагон расслабляет гладкие мышцы ЖКТ; такой же эффект оказывают аналоги гормона, не активирующие аденилатциклазу. В некоторых тканях (в том числе в печени) имеется еще один тип рецепторов глюкагона; связывание гормона с ними приводит к образованию ИФ3, ДАГ и увеличению внутриклеточной концентрации кальция (Murphy et al. , 1987). Роль этого рецептора глюкагона в регуляции метаболизма остается неизвестной.
, 1987). Роль этого рецептора глюкагона в регуляции метаболизма остается неизвестной.
Глюкагон используют для лечения тяжелых эпизодов гипогликемии, обычно у больных сахарным диабетом, когда невозможно организовать в/в инфузию глюкозы. Кроме того, глюкагон применяют в лучевой диагностике как средство, подавляющее моторику ЖКТ.
Глюкагон, применяемый в лечебных целях, получают из бычьей и свиной поджелудочных желез. Аминокислотные последовательности человеческого, бычьего и свиного глюкагона идентичны. При гипогликемии 1 мг глюкагона вводят в/в, в/м или п/к. В экстренных ситуациях первые два пути введения предпочтительны. Улучшение наступает в течение 10 мин, что позволяет свести к минимуму риск поражения ЦНС. Гипергликемизирующий эффект глюкагона кратковременен и может вообще не проявиться, если запасы гликогена в печени истощены. После улучшения, наступившего под действием глюкагона, больному вводят глюкозу либо заставляют его что-нибудь съесть, чтобы предотвратить рецидив гипогликемии. Самые частые побочные эффекты глюкагона — тошнота и рвота.
Самые частые побочные эффекты глюкагона — тошнота и рвота.
Глюкагон назначают перед рентгеноконтрастными исследованиями верхних и нижних отделов ЖКТ, перед ретроградной идеографией (Monsein et al., 1986) и перед MPT (Goldberg and Thoeni, 1989) для того, чтобы расслабить гладкие мышцы желудка и кишечника. Его используют также для снятия спазма при остром дивертикулите, патологии желчных путей и сфинктера Одди, как вспомогательное средство при удалении желчных камней с помощью петли Дормиа, а также при обструкции пищевода и инвагинации кишечника (Friedland, 1983; Mortens-sonetal., 1984; Kadir and Gadacz, 1987). Введение глюкагона облегчает дифференциальную диагностику механической и паренхиматозной желтухи (Berstock et al., 1982).
Глюкагон стимулирует выброс катехоламинов клетками феохромоцитомы и используется как экспериментальное диагностическое средство при этой опухоли. Кроме того, глюкагоном пытались лечить шок, используя его инотропное действие на сердце. Препарат оказался полезным для тех больных, которые принимали β-адреноблокаторы, потому что β-адреностимуляторы у них неэффективны.
Глюкагон и глюконеогенез. Регуляция секреции глюкагона
Глюкагон и глюконеогенез. Регуляция секреции глюкагона
а) Глюкагон увеличивает глюконеогенез. После опустошения глюкагоном депо гликогена в печени на фоне дальнейшего введения глюкагона можно наблюдать параллельно развивающуюся гипергликемию. Это является результатом повышения поступления аминокислот в клетки печени под влиянием глюкагона с последующим превращением их в глюкозу в результате глюконеогенеза. Этот эффект достигается активацией множества ферментов, необходимых для транспорта аминокислот и глюконеогенеза, в особенности ферментных систем, превращающих пируват в фосфоенолпируват, что является лимитирующим скорость этапом глюконеогенеза.
б) Прочие влияния глюкагона. Большинство других влияний глюкагона обнаруживается, когда его концентрация в крови превысит максимальную величину. Возможно, одним из наиболее важных влияний глюкагона является активация липазы в жировых клетках, обеспечивающая повышение количества свободных жирных кислот, которые могут быть использованы в процессах энергообеспечения организма. Глюкагон также препятствует запасанию триглицеридов в печени, что предупреждает изъятие жирных кислот гепатоцитами из крови. Это делает их более доступными для других тканей организма.
Глюкагон также препятствует запасанию триглицеридов в печени, что предупреждает изъятие жирных кислот гепатоцитами из крови. Это делает их более доступными для других тканей организма.
Глюкагон в очень высокой концентрации также:
(1) повышает теплообразование;
(2) увеличивает кровоток в некоторых тканях, особенно в почках;
(3) увеличивает секрецию желчи;
(4) тормозит секрецию соляной кислоты в желудке. Возможно, что все эти влияния не имеют существенного значения в условиях нормального функционирования организма.
Приблизительная концентрация глюкагона при различных уровнях глюкозы в крови
Регуляция секреции глюкагона
а) Концентрация глюкозы в крови является наиболее значимым фактором, контролирующим продукцию глюкагона. Однако специально подчеркнем характер влияний концентрации глюкозы в крови на продукцию глюкагона прямо противоположен влияниям этого фактора на секрецию инсулина.
На рисунке выше показано, что снижение концентрации глюкозы в крови от уровня, сопутствующего состоянию натощак, т. е. 90 мг/дл крови, до уровня, характеризующего гипогликемию, может способствовать увеличению концентрации глюкагона в плазме в несколько раз. Напротив, увеличение концентрации глюкозы в крови до гипергликемических значений сопровождается снижением концентрации глюкагона в плазме. Таким образом, при гипогликемии глюкагон секретируется в большем количестве, что в дальнейшем вызывает повышение выхода глюкозы из печени и поэтому является важным средством компенсации гипогликемии.
е. 90 мг/дл крови, до уровня, характеризующего гипогликемию, может способствовать увеличению концентрации глюкагона в плазме в несколько раз. Напротив, увеличение концентрации глюкозы в крови до гипергликемических значений сопровождается снижением концентрации глюкагона в плазме. Таким образом, при гипогликемии глюкагон секретируется в большем количестве, что в дальнейшем вызывает повышение выхода глюкозы из печени и поэтому является важным средством компенсации гипогликемии.
б) Увеличение аминокислот в крови стимулирует продукцию глюкагона. Высокая концентрация аминокислот в крови, которая возникает после приема белковой пищи (особенно аминокислот аланина и аргинина), стимулирует секрецию глюкагона. Это влияние аналогично тому, которое оказывали аминокислоты на продукцию инсулина. Таким образом, возникающие в этом случае изменения секреции глюкагона и инсулина не носят разнона правленного характера. Важность стимуляции аминокислотами продукции глюкагона заключается в том, что глюкагон обеспечивает быстрое превращение аминокислот в глюкозу, повышая количество глюкозы, доступной для тканей.
в) Физические нагрузки стимулируют секрецию глюкагона. На фоне истощающих физических нагрузок концентрация глюкагона в крови увеличивается в 4-5 раз. Непонятно, чем это провоцируется, т.к. концентрация глюкозы в крови при этом может не снижаться. Благотворность влияния глюкагона в этой ситуации заключается в том, что он препятствует снижению уровня глюкозы в крови.
Одним из факторов, который может увеличить продукцию глюкагона в этих условиях, является увеличение циркулирующих в крови аминокислот. Наряду с этим, возможно, вносит свою лепту адренергическая стимуляция островков Лангерганса.
Видео физиология гормонов поджелудочной железы и регуляции уровня глюкозы — профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Глюкагон и глюконеогенез. Регуляция секреции глюкагона
Регуляция углеводного обмена
А. Регуляция углеводного обмена
У высших организмов обмен углеводов подвержен сложным механизмам регуляции, в которых участвуют гормоны, метаболиты и коферменты . Представленная здесь схема относится к печени , которая занимает в углеводном метаболизме центральное место (см. с. 302). Некоторые из представленных механизмов не действуют в других тканях.
Представленная здесь схема относится к печени , которая занимает в углеводном метаболизме центральное место (см. с. 302). Некоторые из представленных механизмов не действуют в других тканях.
Одной из важнейших функций клеток печени является накопление избыточной глюкозы в виде гликогена и ее быстрое высвобождение по мере метаболической необходимости (буферная функция) . После полной мобилизации запасов гликогена печень может поставлять глюкозу за счет синтеза de novo ( глюконеогенез , см. сс. 156, 232). Кроме того, как и все ткани, она потребляет глюкозу путем гликолиза. Функции накопления (синтеза) глюкозы в виде гликогена и его распада должны быть взаимосогласованы. Таким образом, совершенно невозможно одновременное протекание гликолиза и глюконеогенеза, как и синтеза и деградации гликогена. Согласование процессов обеспечивается тем, что синтез (анаболизм) и распад (катаболизм) катализируются двумя различными ферментами и контролируются независимо. На схеме показаны только эти ключевые ферменты .
Гормоны. К гормонам, которые влияют на углеводный обмен, принадлежат пептиды инсулин и глюкагон , глюкокортикоид кортизол и катехоламин адреналин (см. сс. 362, 368). Инсулин индуцирует (см. с. 120) синтез de novo гликоген-синтазы [ 1 ], а также некоторых ферментов гликолиза [ 3, 5, 7 ]. Одновременно инсулин подавляет синтез ключевых ферментов глюконеогенеза ( репрессия, [ 4, 6, 8, 9 ]). Глюкагон как антагонист инсулина действует в противоположном направлении: индуцирует ферменты глюконеогенеза [ 4, 6, 8, 9 ] и репрессирует пируваткиназу [ 7 ], ключевой фермент гликолиза. Другие аффекты глюкагона основаны на взаимопревращении ферментов и опосредованы вторичным мессенджером цАМФ (сАМР, см. с. 114). По этому механизму тормозится синтез гликогена [ 1 ] и активируется расщепление гликогена [ 2 ]. Подобным образом действует и адреналин. Торможение пируваткиназы [ 7 ] глюкагоном также обусловлено взаимопревращением ферментов.
Глюкокортикоиды, прежде всего кортизол (см. с. 362), индуцируют все ключевые ферменты глюконеогенеза [ 4, 6, 8, 9 ]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
с. 362), индуцируют все ключевые ферменты глюконеогенеза [ 4, 6, 8, 9 ]. Одновременно они индуцируют ферменты деградации аминокислот и обеспечивают тем самым глюконеогенез исходными соединениями.
Метаболиты. Высокие концентрации АТФ (АТР) и цитрата тормозят гликолиз путем аллостерической регуляции фосфо фруктокиназы. Кроме того, АТФ тормозит пируваткиназу . Ингибитором пируваткиназы является ацетил-КоА. Все эти метаболиты образуются при распаде глюкозы ( торможение конечным продуктом ). АМФ (AMP), сигнал дефицита АТФ, активирует расщепление гликогена и тормозит глюконеогенез.
Важную роль в обмене веществ в печени играет фруктозо-2,6-дифосфат . Это сигнальное вещество образуется в незначительных количествах из фруктозо-6-фосфата и выполняет чисто регуляторную функцию: стимулирует гликолиз путем активации фосфофруктокиназы и подавляет глюконеогенез с помощью торможения фруктозо-1,5-дифосфатазы.
Образование и распад фруктозо-2,6-дифосфата катализируются одним и тем же белком [ 10а и б ].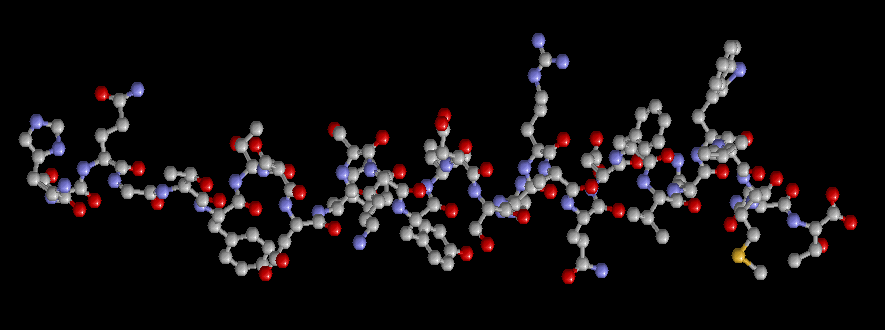 В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата [ 10а ]. После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза [ 10б ] и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ (см. с. 122), т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
В нефосфорилированной форме этот белок вызывает образование фруктозо-2,6-дифосфата [ 10а ]. После фосфорилирования цАМФ-зависимой киназой он действует как фосфатаза [ 10б ] и катализирует превращение фруктозо-2,6-дифосфата в фруктозо-6-фосфат. В присутствии адреналина и глюкагона в клетках печени повышается уровень цАМФ (см. с. 122), т.е. оба гормона воздействуют как на гликолиз, так и на глюконеогенез. Суммарным результатом является быстрое повышение уровня глюкозы в крови.
3.2. Глюкагон: химическая природа, регуляция секреции, механизм действия, роль в обмене.
Глюкагон представляет собой гормон полипептидной природы, выделяемый a-клетками поджелудочной железы. Основной функцией этого гормона является поддержание энергетического гомеостаза организма за счет мобилизации эндогенных энергетических ресурсов, этим объясняется его суммарный катаболический эффект.
В состав полипептидной цепи глюкагона входит 29 аминокислотных остатков, его молекулярная масса 4200, в его составе отсутствует цистеин. Глюкагон был синтезирован химическим путем, чем была окончательно подтверждена его химическая структура.
Глюкагон был синтезирован химическим путем, чем была окончательно подтверждена его химическая структура.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислоти пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды. Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Регулируемым параметром в контуре регуляции секреции глюкагона является концентрация глюкозы.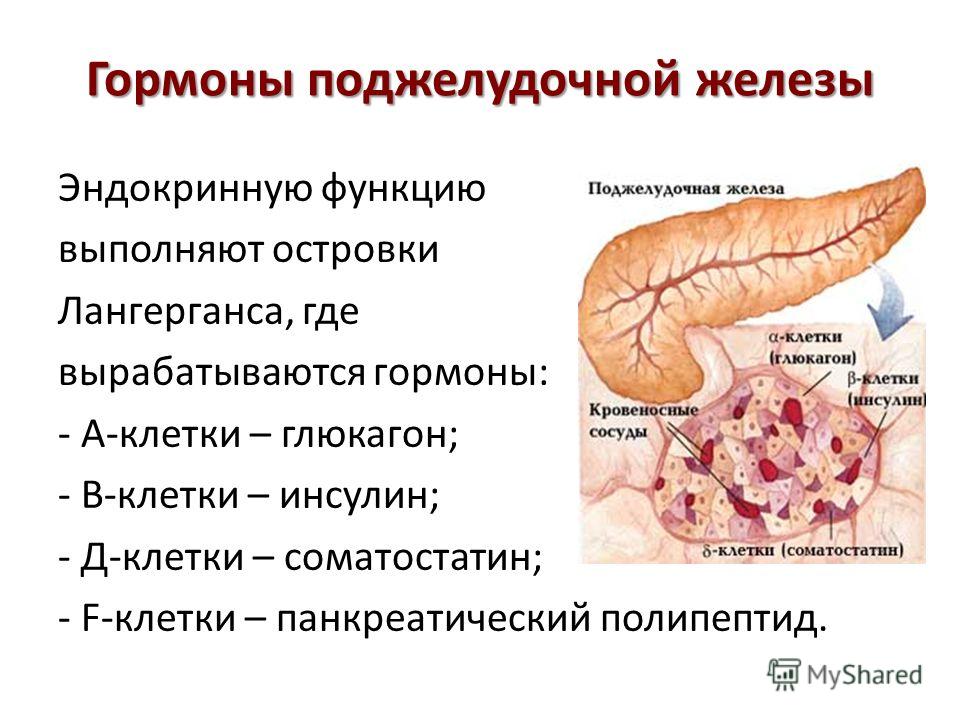 Уменьшение ее в крови стимулирует альфа-клетки, которые увеличивают секрецию гормона, что приводит к росту концентрации глюкозы, которая путем отрицательной обратной связи уменьшает секрецию глюкагона.
Уменьшение ее в крови стимулирует альфа-клетки, которые увеличивают секрецию гормона, что приводит к росту концентрации глюкозы, которая путем отрицательной обратной связи уменьшает секрецию глюкагона.
Увеличение секреции глюкагона вызывает повышение концентрации аминокислот в крови (особенно аргинина) холецистокинина, катехоламинов, ацетилхолина. Уменьшение секреции глюкагона возникает при увеличении: концентрации глюкозы в крови, инсулина, соматостатина, жирных кислот и кетонов.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ — глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.
Глюкагон увеличивает содержание глюкозы (способствует гипергликемии) в плазме крови. Этот эффект реализуется несколькими путями.
Стимуляция гликогенолиза. Глюкагон, активируя гликоген фосфорилазу и ингибируя гликоген синтазу в гепатоцитах, приводит к быстрому и выраженному распаду гликогена и освобождению глюкозы в кровь.
Подавление гликолиза. Глюкагон ингибирует ключевые ферменты гликолиза (фосфофруктокиназа, пируваткиназа) в печени, что приводит к содержания глюкозо-6-фосфата в гепатоцитах, его дефосфорилированию и освобождению глюкозы в кровь.
Стимуляция глюконеогенеза. Глюкагон усиливает транспорт АК из крови в гепатоциты и одновременно активирует ключевые ферменты глюконеогенеза (пируваткарбоксилаза. Фруктозо01,6-дифосфатаза), что приводи к содержания глюкозы в цитоплазме клеток и её поступлению в кровь.
Глюкагон способствует образованию кетоновых тел путем стимуляции окисления жирных кислот: ингибирование активности ацетил-КоА-карбоксилазы приводит к ↓ содержания ингибитора карнитин ацилтрансферазы – малонил-КоА, что приводит к усиленному поступлению жирных кислот из цитоплазмы в митохондрии для их β-окисления и превращения в кетокислоты. Другими словами, в отличие от инсулина, глюкагон оказывает кетогенный эффект.
Другими словами, в отличие от инсулина, глюкагон оказывает кетогенный эффект.
Глюкагон и его роль
Глюкагон является полипептидом, который секретируется альфа-клетками островков Лангерганса и клетками проксимального отдела пищеварительного тракта.
Основным фактором, влияющим на секрецию гормона, является концентрация глюкозы в крови. Уменьшение концентрации глюкозы в крови стимулирует секрецию глюкагона, увеличение — удручает.
РИС. 6.33. Контур регуляции секреции глюкагона. С — концентрация
Активируют секрецию глюкагона, кроме глюкозы, аминокислоты (аргинин, аланин) снижение уровня жирных кислот в крови и гормоны пищеварительного тракта: гастрин, холецистокинин (ХЦК), секретин, желудочный ингибирующий пептид (ШИП) физическая нагрузка.
Регуляция секреции глюкагона
Регулируемым параметром в контуре регуляции секреции глюкагона является концентрация глюкозы. Уменьшение ее в крови стимулирует альфа-клетки, которые увеличивают секрецию гормона, что приводит к росту концентрации глюкозы, которая путем отрицательной обратной связи уменьшает секрецию глюкагона (рис. 6.33).
6.33).
Увеличение секреции глюкагона вызывает повышение концентрации аминокислот в крови (особенно аргинина) холецистокинина, катехоламинов, ацетилхолина.
Уменьшение секреции глюкагона возникает при увеличении: концентрации глюкозы в крови, инсулина, соматостатина, жирных кислот и кетонов.
Механизм действия глюкагона на клетки-мишени
Глюкагон в основном влияет на клетки-мишени печени, в мембранах которых расположены серпентином рецепторы. Комплекс «гормон — рецептор» через стимулирующий G5-протеин активирует аденилатциклазу, что приводит к образованию внутриклеточного посредника цАМФ, которая активирует протеинкиназу А. Последняя потенцирует фосфорилазу, что приводит к увеличению распада гликогена в печени и рост концентрации глюкозы в крови.
Глюкагон действует также через другие рецепторы в гепатоцитах, связывание с которыми приводит к активации фосфолипазы С, следствием чего является увеличение в цитоплазме концентрации ионов Са 2+, стимулирующих гликогенолиз.
Физиологические влияния глюкагона
Регуляция углеводного обмена Глюкагон увеличивает концентрацию глюкозы в крови благодаря стимуляции гликогенолиза в печени и предотвращает образование гликогена. Однако гипергликемическая действие глюкагона не приводит к уменьшению утилизации глюкозы периферическими клетками.
Глюкагон увеличивает глюконеогенез в печени. Он уменьшает образование фруктозо-2,6-дифосфата, тормозит активность фосфофруктокиназы, что приводит к выходу глюкозы из печени.
Регуляция жирового метаболизма Глюкагон увеличивает концентрацию жирных кислот и кетонов в крови благодаря следующим механизмам :
1 увеличивает липолиз , подавляет синтез жирных кислот, направляя субстраты в направлении глюконеогенеза;
2 образует кетоны (β-гидроксибутират и ацетоацетат) с малонил-коэнзимом. А при деградации жирных кислот, в случае отсутствия инсулина, глюкагон может ускорять кетогенез, что приведет к метаболического ацидоза.
Читайте также:
- Опухоли вилочковой железы. Тимомы.
- Воспаления легочной паренхимы. Хронический бронхит.
- Синюшно-одышечные приступы при тетраде Фалло. Тромбоцитопении при пороке сердца
- Бериллиоз
- Аневризма синуса Valsalva. Атеросклероз аорты
— поджелудочной железы — Биохимия
Гормонами поджелудочной железы являются инсулин и глюкагон.
Глюкагон
Строение
Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез
Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции
Активируют: гипогликемия, адреналин.
Уменьшают: глюкоза, жирные кислоты.
Механизм действия
Аденилатциклазный активирующий.
Мишени и эффекты
Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови.
Жировая ткань
- повышает активность внутриклеточной гормон-чувствительной липазы и, соответственно, стимулирует липолиз.
Печень
- активация глюконеогенеза и гликогенолиза,
- за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
Патология
Гиперфункция
Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Инсулин
Дополнительная, более подробная информация, об инсулине находится на следующей странице.
Строение
Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез
Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции
Активируют синтез и секрецию:
- глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
- жирные кислоты и аминокислоты,
- влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
- гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
- хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшает: влияние симпато-адреналовой системы.
Механизм действия
Осуществляется через рецепторы с тирозинкиназной активностью (подробно).
Мишени и эффекты
Основным эффектом является снижение концентрации глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и активации внутриклеточных
- активируя фосфодиэстеразу, которая разрушает вторичный мессенджер цАМФ, инсулин прерывает эффекты адреналина и глюкагона на печень и жировую ткань.
- в мышцах и жировой ткани стимулирует транспорт глюкозы в клетки (активация Глют-4),
- в печени и мышцах ускоряет синтез гликогена (активация гликогенсинтазы).
- в печени, мышцах и адипоцитах инсулин стимулирует гликолиз, активируя фосфофруктокиназу и пируваткиназу.
- полученный в гликолизе пируват превращается в ацетил-SКоА под влиянием активированного инсулином пируватдегидрогеназного комплекса, и далее используется для синтеза жирных кислот.
 Превращение ацетил-SКоА в малонил-SКоА, первый субстрат синтеза жирных кислот, также стимулируется инсулином (ацетил-SКоА-карбоксилаза).
Превращение ацетил-SКоА в малонил-SКоА, первый субстрат синтеза жирных кислот, также стимулируется инсулином (ацетил-SКоА-карбоксилаза). - в мышцах усиливает транспорт нейтральных аминокислот в миоциты и стимулирует трансляцию (рибосомальный синтез белков).
Ряд эффектов инсулина заключается в изменении транскрипции генов и скорости трансляции ферментов, отвечающих за обмен веществ, за рост и деление клеток.
Благодаря этому индуцируется синтез ферментов метаболизма
- углеводов в печени (глюкокиназа, пируваткиназа, глюкозо-6-фосфатдегидрогеназа),
- липидов в печени (АТФ-цитрат-лиаза, ацетил-SКоА-карбоксилаза, синтаза жирных кислот, цитозольная малатдегидрогеназа) и адипоцитах (ГАФ-дегидрогеназа, пальмитатсинтаза, липопротеинлипаза).
и происходит репрессия фосфоенолпируват-карбоксикиназы (подавление глюконеогенеза).
Инактивация инсулина
Инактивация инсулина начинается после интернализации инсулин-рецепторного комплекса и образования эндосомы, в которой и происходит деградация инсулина. Участвуют две ферментные системы:
- Глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные связи между цепями А и В, в результате чего гормон распадается.
- Инсулиназа (инсулин-протеиназа), гидролизующая инсулин до аминокислот.
Период полужизни инсулина не превышает 5-6 минут. Происходит деградация в основном в печени и почках, но и другие ткани принимают в этом участие. Также в почках инсулин может фильтроваться, захватываться эпителиоцитами проксимальных канальцев и разрушаться до аминокислот.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Вы и ваши гормоны от Общества эндокринологов
Что такое глюкагон?
Глюкагон — это гормон, участвующий в контроле уровня сахара (глюкозы) в крови. Он вырабатывается альфа-клетками, обнаруженными в островках Лангерганса в поджелудочной железе, откуда он высвобождается в кровоток. Альфа-клетки, секретирующие глюкагон, окружают бета-клетки, секретирующие инсулин, что отражает тесную связь между двумя гормонами.
Роль глюкагона в организме заключается в предотвращении слишком низкого уровня глюкозы в крови. Для этого он воздействует на печень несколькими способами:
- Стимулирует превращение накопленного гликогена (хранящегося в печени) в глюкозу, которая может высвобождаться в кровоток. Этот процесс называется гликогенолизом.
- Способствует выработке глюкозы из молекул аминокислот. Этот процесс называется глюконеогенезом.
- Снижает потребление глюкозы печенью, чтобы как можно больше глюкозы могло секретироваться в кровоток для поддержания уровня глюкозы в крови.

Глюкагон также воздействует на жировую ткань, стимулируя высвобождение запасов жира в кровоток.
Как контролируется глюкагон?
Глюкагон работает вместе с гормоном инсулином, чтобы контролировать уровень сахара в крови и поддерживать его в заданных пределах. Глюкагон высвобождается, чтобы остановить слишком низкое падение уровня сахара в крови (гипогликемия), в то время как инсулин высвобождается, чтобы остановить слишком высокий уровень сахара в крови (гипергликемия).
Высвобождение глюкагона стимулируется низким уровнем глюкозы в крови, богатой белком пищей и адреналином (еще один важный гормон для борьбы с низким уровнем глюкозы). Высвобождение глюкагона предотвращается повышением уровня глюкозы в крови и углеводов в пище, обнаруживаемым клетками поджелудочной железы.
В долгосрочной перспективе глюкагон играет решающую роль в реакции организма на нехватку пищи. Например, он поощряет использование накопленного жира для получения энергии, чтобы сохранить ограниченный запас глюкозы.
Что произойдет, если у меня слишком много глюкагона?
Редкая опухоль поджелудочной железы, называемая глюкагономой, может секретировать избыточное количество глюкагона. Это может вызвать сахарный диабет, потерю веса, венозный тромбоз и характерную кожную сыпь.
Что произойдет, если у меня слишком мало глюкагона?
Сообщалось о необычных случаях дефицита секреции глюкагона у младенцев. Это приводит к очень низкому уровню глюкозы в крови, который невозможно контролировать без введения глюкагона.
Глюкагон можно вводить в виде инъекций для восстановления уровня глюкозы в крови, сниженного инсулином (даже у пациентов без сознания). Он может увеличить высвобождение глюкозы из запасов гликогена в большей степени, чем инсулин может его подавить. Эффект глюкагона ограничен, поэтому очень важно есть углеводную пищу после того, как человек выздоровел достаточно, чтобы безопасно питаться.
Последнее рассмотрение: март 2018 г.
Грелин
Глюкагоноподобный пептид 1
Теги для этого контента
Координация и контроль Ключевой этап 4 Возраст 14–16 летСахарный диабет инсулинома глюкагонома Просмотреть все эндокринные заболевания
Адреналин Глюкагоноподобный пептид 1 инсулин Просмотреть все Гормоны
поджелудочная железа Жировая ткань Просмотреть все железы
островки Лангерганса Посмотреть весь глоссарий
глюкагон: гормоны, гипогликемия и диабет
, написанный Сьюзен Бернштейн
в этой статье
- Как работает глюкагон
- Glucagon и Insulin
- , когда сахарный сахар слишком низкий
. повлиять на то, как вы себя чувствуете. Чтобы помочь вам поддерживать стабильный и здоровый уровень, ваше тело вырабатывает гормон глюкагон, когда вы спите и после еды.
повлиять на то, как вы себя чувствуете. Чтобы помочь вам поддерживать стабильный и здоровый уровень, ваше тело вырабатывает гормон глюкагон, когда вы спите и после еды.
Он вырабатывается поджелудочной железой, небольшим органом над печенью, и может повышать уровень глюкозы или сахара в крови. Это топливо, которое ваши мышцы и органы используют для работы и поддержания здоровья.
Глюкагон помогает вашей печени расщеплять пищу, которую вы едите, для производства глюкозы.
Если уровень сахара в крови упадет слишком низко, у вас может возникнуть гипогликемия. Это может вызвать у вас головокружение, вялость или даже потерю сознания. Глюкагон может помочь при гипогликемии, чтобы вы снова чувствовали себя хорошо.
Как работает глюкагон
Глюкагон работает с вашей печенью, превращая запасы сахара, называемого гликогеном, в глюкозу. Глюкоза поступает из печени в кровь, чтобы дать вам энергию.
Глюкагон может сказать вашей печени, чтобы она не потребляла слишком много глюкозы из пищи, которую вы едите, и вместо этого выпускала накопленный сахар в кровь. Это может поддерживать стабильный уровень глюкозы.
Это может поддерживать стабильный уровень глюкозы.
Если уровень сахара в крови падает слишком низко, поджелудочная железа вырабатывает глюкагон, чтобы заставить печень вырабатывать больше глюкозы.
Глюкагон также может играть роль в том, как аминокислоты (соединения, из которых состоят мышцы и ткани в организме) образуют глюкозу. И он может расщеплять триглицериды или жир, хранящийся в вашем теле, в топливо.
Глюкагон и инсулин
Глюкагон и инсулин, другой вид гормона, должны работать вместе, чтобы поддерживать баланс сахара в крови.
Клетки поджелудочной железы, вырабатывающие глюкагон, аналогичны клеткам, вырабатывающим инсулин. Ваше тело нуждается в нем, чтобы превратить сахар в крови в топливо.
Если у вас диабет, ваш организм либо не вырабатывает инсулин, либо его вырабатывается недостаточно. Это может изменить то, как ваше тело вырабатывает глюкагон.
Обычно пища дает организму необходимый сахар и энергию. Затем уровень глюкагона снижается, потому что вашей печени не нужно производить больше сахара, чтобы подпитывать ваши мышцы.
При диабете поджелудочная железа не перестает вырабатывать глюкагон, когда вы едите. Это может слишком сильно повысить уровень сахара в крови после еды.
Вы также можете вырабатывать слишком много глюкагона, если по какой-либо причине у вас была внезапная потеря веса. Редко кто-то производит слишком мало глюкагона, хотя это иногда случается с младенцами.
Когда уровень сахара в крови падает слишком низко
Гипогликемия относится к слишком низкому уровню сахара в крови. У вас может быть это, если вы чувствуете, что вы:
- Смущен
- Dizzy
- С трудом с речью
- Headachy
- Hungry
- Брустание
- Тошнота
- Следует или не может быть непревзойденной
- . Это может вызвать кошмары или ночные поты. Вы можете плакать во сне или просыпаться с чувством усталости или растерянности.
Легкую гипогликемию можно лечить сладкой закуской, напитком или таблеткой глюкозы. Это может быстро привести уровень сахара в крови в норму.

Если уровень сахара в крови станет слишком низким, вы можете потерять сознание или даже впасть в кому. Люди с диабетом 1 типа подвержены более высокому риску этого тяжелого типа гипогликемии. Но вы также можете получить его, если у вас диабет 2 типа и вы принимаете инсулин. Всем людям с диабетом важно следить за уровнем сахара в крови.
Для лечения тяжелой гипогликемии вам нужна быстрая доза глюкагона. Если вы потеряли сознание, кто-то может сделать вам укол гормона, чтобы повысить уровень сахара в крови.
Ваш врач может выписать экстренный набор глюкагона. Он содержит гормон в порошке и шприц, наполненный жидкостью. В нем будут четкие инструкции о том, как быстро смешать и ввести укол глюкагона.
Научите свою семью, соседей по комнате или коллег, как сделать вам укол, если вы потеряете сознание. Если у вашего ребенка диабет, вы можете дать школьной медсестре набор глюкагона для использования в случае чрезвычайной ситуации.
После укола глюкагона вы должны снова прийти в сознание.

