Глюкагон где вырабатывается: Глюкагон в плазме
Глюкагон в плазме
Глюкагон — пептидный гормон поджелудочной железы, который в качестве контррегуляторного гормона для инсулина стимулирует высвобождение глюкозы печенью и поддерживает гомеостаз глюкозы. Антагонист инсулина. Нормальная секреция гормона необходима для поддержания стабильности уровня глюкозы крови.
Синонимы русские
Маркер оценки функциональной активности альфа-клеток поджелудочной железы, антагонист инсулина; контроль уровня сахара, маркер углеводного обмена.
Метод исследования
Иммуноферментный анализ.
Единицы измерения
Пг/мл (пикограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.

- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Не курить в течение 3 часов до исследования.
Общая информация об исследовании
В человеческом организме глюкагон участвует в обмене углеводов. По сути он является противоположностью инсулина, который образуется в β-клетках поджелудочной железы. Глюкагон вырабатывается также в поджелудочной железе, но α-клетками. Он способствует расщеплению гликогена до глюкозы в печени, как следствие, уровень глюкозы в сыворотке крови значительно повышается (гипергликемия). Гормон действует на жировую ткань, вызывая ее расщепление. В норме на его производство обратно пропорционально влияет уровень глюкозы в кровяном русле. При повышенном уровне глюкозы синтез глюкагона снижается, и наоборот, при гипогликемии (снижение уровня глюкозы) повышается.
Гормоны поджелудочной железы инсулин и глюкагон функционально взаимосвязаны. При сахарном диабете недостаток инсулина сопровождается повышенным образованием глюкагона, что служит причиной высокого уровня сахара в крови. В таких случаях гипергликемия резко выражена, нарушается обмен веществ и кислотно-щелочное равновесие. Значительное повышение уровня глюкагона в плазме крови чаще возникает при глюкагономе — опухоли из α-клеток поджелудочной железы. У таких больных часто нарушается толерантность к глюкозе и возникает сахарный диабет. Заболевание диагностируют при высокой концентрации глюкагона в плазме крови. После приема пищи высвобождение глюкагона обычно блокируется во избежание чрезмерной выработки глюкозы печенью. Когда этого не происходит у больных диабетом, слишком большое количество глюкагона усугубляет и так высокий уровень глюкозы в крови.
Среди причин персистирующих (стойких) гипогликемий встречается дефицит контринсулярных гормонов, в частности глюкагона. Его охранная секреция, наряду с другими контринсулярными гормонами (кортизол, СТГ), является одним из факторов подтверждения врожденного гиперинсулинизма. У некоторых детей персистирование гипогликемии может быть обусловлено врожденными нарушениями обмена веществ, ферментопатиями или дисфункцией эндокринных желез, так как метаболизм глюкозы происходит с участием различных ферментов и регулируется гормонами (инсулин, глюкагон, кортизол, адреналин и др.).
Синдром множественных эндокринных неоплазий 1 типа (МЭН — 1) — наследственное заболевание, вызванное мутацией гена МЭН — 1, при котором гиперпаратиреоз сочетается с опухолями других желез внутренней секреции, чаще всего нейроэндокринными новообразованиями поджелудочной железы или аденомами гипофиза. Примерно в 80 % случаев при данном синдроме может поражаться поджелудочная железа, что характеризуется опухолями разных типов островковых клеток: инсулинома, глюкагонома, гастринома, ВИПома. Они относятся к редким функционально активным нейроэндокринным образованиям, часто обладают высоким потенциалом злокачественности, и к моменту постановки диагноза у больных присутствуют отдаленные метастазы в печень, парапанкреатические лимфоузлы, позвоночник. Исследование уровня глюкагона наряду с некоторыми другими биохимическими тестами входит в программу скрининга синдрома МЭН — 1.
Они относятся к редким функционально активным нейроэндокринным образованиям, часто обладают высоким потенциалом злокачественности, и к моменту постановки диагноза у больных присутствуют отдаленные метастазы в печень, парапанкреатические лимфоузлы, позвоночник. Исследование уровня глюкагона наряду с некоторыми другими биохимическими тестами входит в программу скрининга синдрома МЭН — 1.
Для чего используется исследование?
- Выявление нарушений углеводного обмена, секреции инсулина.
- Позволяет выявить глюкагоному как причину возникновения сахарного диабета.
- Повышает информативность обследования новорожденных с неонатальной гипогликемией (если мать ребенка больна диабетом).
Когда назначается исследование?
- Дифференциальная диагностика сахарного диабета, возникшего вследствие глюкагономы, и других видов диабета.
- Дополнительное обследование при МЭН-синдроме — 1 (множественной эндокринной неоплазии 1-го типа) для выявления глюкагономы.

- Оценка общей степени снижения массы ткани поджелудочной железы.
Что означают результаты?
Референсные значения
Референсные значения не определены. Для интерпретации результатов исследования необходимо обратиться к лечащему врачу.
Глюкагон и альфа-клетки — новая терапевтическая мишень в лечении сахарного диабета | Петунина
Согласно бигормональной гипотезе, предложенной в 1975 г. R. Unger, ключевыми гормонами, регулирующими углеводный обмен, являются инсулин и глюкагон. Несмотря на то, что функция глюкагона в регуляции гомеостаза глюкозы у здоровых людей изучена достаточно, его роль в развитии сахарного диабета 2 типа (СД2) остается недооцененной. Множество исследований последнего десятилетия показали, что ключевая роль в развитии гипергликемии натощак и постпрандиально у пациентов с СД2 принадлежит именно глюкагону. Патофизиология СД2 характеризуется не только инсулинорезистентностью и нарушением секреции инсулина, но и гиперглюкагонемией натощак, нарушением подавления выработки глюкагона при пероральном поступлении глюкозы, а также гиперпродукцией глюкагона в ответ на прием пищи.
Структура островков Лангерганса
Островки, впервые обнаруженные Лангергансом в 1869 г., содержат 5 различных типов клеток, каждый из которых продуцирует свой собственный гормон. У мышей β-клетки, продуцирующие инсулин, занимают 60–80% от клеток, составляющих островок, и локализуются в его ядре, тогда как остальные клетки располагаются в так называемом покровном слое. Это α-клетки, секретирующие глюкагон (занимают 10–20% от клеток островков), δ-клетки, секретирующие соматостатин, рр-клетки, производящие панкреатический пептид, и ε-клетки, продуцирующие грелин [1]. У человека α-, рр-, δ- и ε-клетки обнаруживаются как на периферии, так и в центре островков. Такая разница в строении островков поджелудочной железы у человека и грызунов объясняется особенностями паракринной регуляции.
Удобной моделью для изучения развития и дифференцировки эндокринных клеток поджелудочной железы послужили мыши. Первые гормонпродуцирующие клетки были обнаружены у них на 9-й день эмбрионального развития, большинство этих клеток было глюкагонпродуцирующими. Первые инсулинпродуцирующие клетки были обнаружены на 10-й день, причем это были клетки, производившие инсулин и глюкагон одновременно. На 13-й день была обнаружена вторая генерация гормонпродуцирующих клеток, и она уже включала глюкагон-, инсулин-, соматостатин-, грелин- и РР‑продуцирующие клетки. Миграция и дифференцировка клеток с образованием компактных структур (островков Лангерганса) происходила в период с 16-го дня и до рождения [2].
Первые инсулинпродуцирующие клетки были обнаружены на 10-й день, причем это были клетки, производившие инсулин и глюкагон одновременно. На 13-й день была обнаружена вторая генерация гормонпродуцирующих клеток, и она уже включала глюкагон-, инсулин-, соматостатин-, грелин- и РР‑продуцирующие клетки. Миграция и дифференцировка клеток с образованием компактных структур (островков Лангерганса) происходила в период с 16-го дня и до рождения [2].
Эндокринные клетки поджелудочной железы у человека дифференцируются из предшественников протоковых клеток. Популяция эндокринных клеток начинает расширяться в раннем постнатальном периоде. Во взрослом состоянии последующая пролиферация, вероятно, включает репликацию существующих островковых клеток и их новообразование [3].
Дифференцировка α- и β-клеток
α-Клетки вместе с энтероцитами, бокаловидными клетками и клетками Паннета происходят из общих мультипотентных клеток в кишечных криптах, формирующихся из эндодермы. После дифференцировки всех этих клеток из предшественницы происходит их миграция на верхушку кишечной ворсинки, затем они возвращаются обратно, цикл повторяется каждые 3–4 дня [4]. Дифференцировка α-клеток происходит под влиянием большого количества факторов (рис. 1).
Дифференцировка α-клеток происходит под влиянием большого количества факторов (рис. 1).
Основные гены, участвующие в дифференцировке эндокринных клеток поджелудочной железы, относятся к кластеру хоумбокс-содержащих генов (Pdx1+ – Pancreas duodenum homeobox-1, Arx – Aristaless related homeobox, Pax4 Paired homeobox gene 4, FoxA2 – forkhead homeobox A2, FoxA1 – forkhead homeobox A1, Pax 6 – paired homeobox 6, Isl-1 – ISL LIM homeobox 1, Nkx2.2 Nk 2 homeobox-2, Nkx6.1 Nk 6 homeobox-1).
У мышей Pdx1-ген активируется в клетках-предшественницах первичной кишки на 8–9-й день эмбриогенеза. В начале развития он экспрессируется во всех клетках эпителиального ростка. В поздние периоды развития плода и у взрослых высокий уровень экспрессии Pdx1 сохраняется только в β- и δ-клетках, а также некоторых протоковых клетках. В экспериментах с моделированием нарушения экспрессии Pdx1 обнаруживалось увеличение количества α-клеток. Происходит ли это вследствие уменьшения подавления β-клетками развития α-клеток или из-за преобразования β-клеток в α-клетки, пока неизвестно.
Pdx1-клетки дифференцируются в Нейрогенин 3+ (Ngn3+ или Neurog 3) эндокринные клетки-предшественники. Клетки, экспрессирующие Ngn3+, в большом количестве обнаруживаются только в период эмбрионального развития. Эти клетки не продуцируют ни глюкагон, ни инсулин, но способствуют росту всех эндокринных клеток поджелудочной железы [2]. Различные наблюдения показали, что Ngn3+-экспрессирующие клетки-предшественницы проходят через различные этапы развития. Так, молодые Ngn3+ экспрессирующие клетки увеличивают рост исключительно α-клеток, тогда как на поздних стадиях развития эти клетки увеличивают рост β-, РР- и δ-клеток [1].
Далее целый ряд факторов транскрипции направляет формирующиеся эндокринные клетки по четырем основным путям развития. Эти факторы могут быть разделены на ранние (такие как Nkx2.2, Nkx6.1, Pax4 или Arx), которые соэкспрессируются вместе с Ngn3 в эндокринных клетках-предшественницах, и поздние факторы (включая, Pax6, Isl1,MafA или Pdx1), которые обнаруживаются в более зрелых клетках [5]. Остановимся на некоторых из них более подробно.
Остановимся на некоторых из них более подробно.
Гены Arx и Pax-4
Гены Arx и Pax-4 имеют специфическое действие на пролиферацию клеток островков. Arx необходим для развития α-клеток и достаточной промоции α- и РР‑линий во время морфогенеза поджелудочной железы, Pax-4 ген способствует гибели β- и δ-клеток, приводя к уменьшению их количества и увеличению количества α-клеток. Интересным открытием является то, что нарушенное действие Arx на β-клетки у взрослых может привести к их перерождению в клетки, проявляющие свойства α- и РР-клеток. Локальная же экспрессия Pax-4 в развивающейся поджелудочной железе мышей приводит к тому, что в увеличенных островках Лангерганса формируются клетки, проявляющие свойства β-клеток. Более того, нарушение его экспрессии ведет к тому, что количество α-клеток соответствует увеличению инсулин-продуцирующих клеток. Эксперименты на родственных линиях демонстрируют превращение глюкагон-продуцирующих клеток в инсулин-продуцирующие, которые проявляют все остальные свойства истинных β-клеток. Было продемонстрировано, что долговременное превращение α-клеток в β-подобные клетки, индуцированное нарушенной экспрессией Pax4, приводит к стимуляции новообразования α-клеток. Это происходит по механизму продолжительной активации клеток-предшественниц, расположенных в выстилке протоков, которые реактивируются экспрессией Ngn3. Этот повторяющийся цикл приводит к гиперплазии островков. Интересно, что такой процесс у молодых животных с химически индуцированным СД является достаточным, чтобы обратить болезнь вспять [6].
Было продемонстрировано, что долговременное превращение α-клеток в β-подобные клетки, индуцированное нарушенной экспрессией Pax4, приводит к стимуляции новообразования α-клеток. Это происходит по механизму продолжительной активации клеток-предшественниц, расположенных в выстилке протоков, которые реактивируются экспрессией Ngn3. Этот повторяющийся цикл приводит к гиперплазии островков. Интересно, что такой процесс у молодых животных с химически индуцированным СД является достаточным, чтобы обратить болезнь вспять [6].
Ген Pax-6
Ген Pax-6 экспрессируется во всех эндокринных клетках поджелудочной железы и требуется для экспрессии генов, обеспечивающих функции α-, β- и δ-клеток [7]. Pax-6 играет решающую роль в экспрессии гена глюкагона (Gcg) и регуляции превращения проглюкагона в глюкагон в α-клетках. После подавления или удаления Pax-6 у мышей, уровень мРНК глюкагона сильно снижается. Отмечается, что Pax-6 необходим для дифференцировки L-клеток кишечника и экспрессии Gcg-гена в этих клетках. Предполагается, что продукция глюкагоноподобного пептида-1 (GLP-1) также может зависеть от Pax-6 [8].
Предполагается, что продукция глюкагоноподобного пептида-1 (GLP-1) также может зависеть от Pax-6 [8].
Структура гена глюкагона
Ген глюкагона (Gcg) экспрессируется в α-клетках эндокринной части поджелудочной железы, но также его экспрессия возможна и в L-клетках кишечника, и в специфических областях головного мозга. Сигнальный пептид отщепляется от препроглюкагона, далее кодируется Gcg мРНК для получения проглюкагона, который является предшественником для образования пептидов (включая глюкагон, глюкагонподобные пептиды 1 и 2).
Глюкагон образуется в α-клетках поджелудочной железы путем расщепления проглюкагона прогормон-конвертазой-2 (Pcsk2), в то время как глюкагонoподобные пептиды (GLPp-1, GLP-2) синтезируются одновременно в L-клетках кишечника и в некоторых клетках ЦНС путем расщепления прогормон-конвертазой-1 (Pcsk1). Таким образом, большая часть проглюкагона преобразуется в глюкагон. Тем не менее, в некоторых ситуациях, к примеру, при повреждении β-клеток, GLP-1 может обнаруживаться в клетках островков одновременно с глюкагоном. При альтернативном или неполном расщеплении проглюкагона могут образовываться некоторые другие пептиды, например, глицентин и оксинтомодулин, которые были описаны, но их физиологическая роль до сих пор мало изучена [9, 10] (рис. 2).
При альтернативном или неполном расщеплении проглюкагона могут образовываться некоторые другие пептиды, например, глицентин и оксинтомодулин, которые были описаны, но их физиологическая роль до сих пор мало изучена [9, 10] (рис. 2).
Гипотезы регуляции экспрессии гена глюкагона
Предполагается, что экспрессия гена глюкагона происходит по умолчанию: при отсутствии специфических факторов, таких как Pdx1, Pax4 и Nkx6.1, достаточно наличия других островковых факторов для экспрессии гена глюкагона и для дифференцировки α-клеток. Тем не менее, у мутантных мышей с недостатком Pax6, FoxA 2 или Arx α-клетки отсутствовали или были представлены в небольшом количестве. Это подтверждает, что перечисленные факторы наиболее важны для дифференцировки α-клеток [8].
Другими важными факторами транскрипции являются гены FoxA1 и FoxA2, представленные в α-клетках и в период развития, и во взрослом состоянии. Исследования на мутантных мышах показали, что FoxA1 участвует в транскрипции гена глюкагона, в то время как FoxA2 в большей степени участвует в дифференцировке α-клеток.
Maf B (musculoaponeurotic fibrosarcoma oncogene homolog B) экспрессируется у взрослых исключительно в α-клетках, однако в период развития встречается и в α-, и в β-клетках. Эксперименты на мышах, лишенных MafB, показали, что этот фактор регулирует основные этапы дифференцировки обоих типов клеток: и инсулин-, и глюкагонпродуцирующих [8].
Регуляция секреции глюкагона
Предполагают, что периферическая концентрация глюкагона неточно отражает истинную секрецию α-клеток вследствие печеночного клиренса. Тем не менее, эти данные являются спорными. Концентрация глюкагона натощак довольно низкая и равна 10 пмоль/л. Являясь частью регуляции углеводного обмена, секреция глюкагона зависит от концентрации глюкозы в плазме. При падении уровня глюкозы до 2–3 ммоль/л, концентрация глюкагона возрастает до 40 пмоль/л и снижается до 1–2 пмоль/л, когда уровень глюкозы повышается до 10–12 ммоль/л [11]. Новые работы демонстрируют комплексные, но несколько усложненные регуляторные механизмы, моделирующие глюкагоновый ответ α-клеток, с участием панкреатических и эндокринных гормонов (инсулин, соматостатин, эпинефрин, инкретины), Zn2+, питательных веществ, центральной и автономной нервной систем [12].
Роль инсулина
Различные исследования in vivo и in vitro доказали, что инсулин подавляет выработку глюкагона. Исследования на αIRKO мышах доказали, что in vivo регулирующее действие инсулина необыкновенно важно для реализации функции α-клеток. Несмотря на то, что у нокаут-мышей глюкагоновый ответ на фоне голодной гипогликемии, сопровождающейся гипоинсулинемией, был значительно снижен, подопытные демонстрировали усиление глюкагонового ответа на гипогликемию, вызванную гиперинсулинемией. Напротив, в контрольной группе глюкагоновая секреция была выше в первом случае и подавлялась во втором [12]. Это доказывает, что αIRKO мыши не способны чувствовать вариации уровня инсулина и, соответственно, адаптировать секрецию глюкагона. Интересно, что стрептозотоцин-индуцированная (STZ) гипергликемия, вторичная по отношению к гипоинсулинемии, вызывала похожее повышение уровня глюкагона в плазме крови как в группе контроля, так и у αIRKO мышей. Затем мышей, находившихся под воздействием STZ, пролечили флоридунином, на фоне чего уровень глюкагона снизился до значений, сравнимых со значениями у мышей с нормогликемией, не подвергавшихся воздействию. Это исследование доказывает, что in vivo гипергликемия стимулирует секрецию глюкагона α-клетками без участия инсулина, а внутриостровковый эффект инсулина играет центральную роль в физиологическом подавлении секреции глюкагона в ответ на гипергликемию. Это также демонстрирует, что гипогликемия может стимулировать секрецию глюкагона независимо от инсулина, так как в обеих группах (контрольной и αIRKO) происходило значительное увеличение секреции глюкагона на фоне гиперинсулинемии выше физиологических значений. Важно отметить, что этот феномен может быть частично обусловлен действием других веществ, влияющих на секрецию глюкагона, таких как глютамат, нейротрансмиттеры [12].
Это исследование доказывает, что in vivo гипергликемия стимулирует секрецию глюкагона α-клетками без участия инсулина, а внутриостровковый эффект инсулина играет центральную роль в физиологическом подавлении секреции глюкагона в ответ на гипергликемию. Это также демонстрирует, что гипогликемия может стимулировать секрецию глюкагона независимо от инсулина, так как в обеих группах (контрольной и αIRKO) происходило значительное увеличение секреции глюкагона на фоне гиперинсулинемии выше физиологических значений. Важно отметить, что этот феномен может быть частично обусловлен действием других веществ, влияющих на секрецию глюкагона, таких как глютамат, нейротрансмиттеры [12].
Роль инкретинов
Инкретины – гормоны, выделяемые эндокринными клетками кишечника, которые усиливают глюкозозависимую секрецию инсулина, обеспечивая тем самым «инкретиновый эффект» – разницу в уровне секреции инсулина в ответ на внутривенное и пероральное поступление глюкозы. У млекопитащих известны следующие инкретины: глюкозозависимый инсулинотропный пептид (GIP) и GLP-1, 2. GIP и GLP-1 закодированы индивидуальной генной последовательностью в геноме человека. GIP-ген кодирует исключительно GIP и экспрессируется в K-клетках кишечника. GLP-1 кодируется геном проглюкагона (Gcg). У млекопитающих существует также GLP-2, который регулирует пролиферацию клеток кишечника, участвует в их функционировании, а также способствует делению клеток костной ткани и нейропротекции. Интересно, что в то время как действие глюкагона одинаковое у всех живых организмов, действие GLP-1 сильно различается у млекопитающих и рыб, а GLP-2 определяется только у млекопитающих. Функционирование GIP-гена было описано у ограниченного количества видов млекопитающих и у некоторых других видов позвоночных, обладающих геном, подобным GIP. Оба гена, GIP и Gcg, существуют в геноме млекопитающих в единственном числе и занимают в нем стабильное положение, в строго определенном порядке [10].
GIP и GLP-1 закодированы индивидуальной генной последовательностью в геноме человека. GIP-ген кодирует исключительно GIP и экспрессируется в K-клетках кишечника. GLP-1 кодируется геном проглюкагона (Gcg). У млекопитающих существует также GLP-2, который регулирует пролиферацию клеток кишечника, участвует в их функционировании, а также способствует делению клеток костной ткани и нейропротекции. Интересно, что в то время как действие глюкагона одинаковое у всех живых организмов, действие GLP-1 сильно различается у млекопитающих и рыб, а GLP-2 определяется только у млекопитающих. Функционирование GIP-гена было описано у ограниченного количества видов млекопитающих и у некоторых других видов позвоночных, обладающих геном, подобным GIP. Оба гена, GIP и Gcg, существуют в геноме млекопитающих в единственном числе и занимают в нем стабильное положение, в строго определенном порядке [10].
СД2 проявляется характерными нарушениями в секреции глюкагона. Очень часто у пациентов отмечается гиперглюкагонемия натощак и избыточный ответ на пищевую нагрузку, в то время как у здоровых людей и внутривенное, и пероральное введение глюкозы приводит к одинаковой супрессии выработки глюкагона. Пациенты же с СД2 демонстрируют парадоксальное увеличение выделения глюкагона, отсутствие его подавления при пероральной нагрузке глюкозой в первые 45–60 минут и супрессию после внутривенного введения глюкозы. Похожие наблюдения были сделаны у пациентов с СД 1 типа (СД1) при резком снижении количества β-клеток. Полагают, что эта разница может быть результатом нарушения взаимодействия между α- и β-клетками внутри островков или же результатом инсулинорезистентности α-клеток.
Пациенты же с СД2 демонстрируют парадоксальное увеличение выделения глюкагона, отсутствие его подавления при пероральной нагрузке глюкозой в первые 45–60 минут и супрессию после внутривенного введения глюкозы. Похожие наблюдения были сделаны у пациентов с СД 1 типа (СД1) при резком снижении количества β-клеток. Полагают, что эта разница может быть результатом нарушения взаимодействия между α- и β-клетками внутри островков или же результатом инсулинорезистентности α-клеток.
В последнее время доказано, что GLP-1-индуцированная стимуляция инсулина и подавление глюкагона в равной степени способствуют эффекту снижения гликемии у пациентов с СД [13]. Поэтому особое значение в лечении СД2 приобретают новые группы препаратов, основанные на воспроизведении эффектов GLP-1: это агонисты GLP-1 и ингибиторы дипептидилпептидазы (ДПП-4). Ряд клинических исследований доказал эффективное подавление секреции глюкагона и, соответственно, подавление гиперпродукции глюкозы печенью, при назначении ингибиторов ДПП-4 [14] (рис.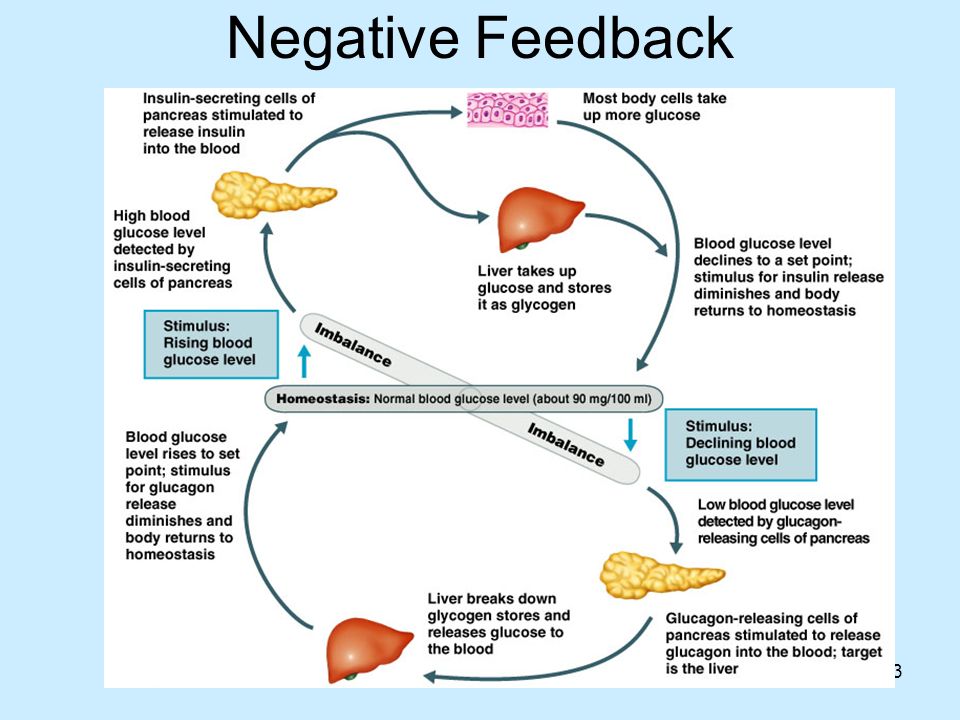 3, 4).
3, 4).
Одним из новых и потенциально возможных путей развития инкретиновой терапии становится применение ее при СД1, т.к. GLP-1 может предотвращать, а возможно и восстанавливать функцию β-клеток, увеличивать их количество, а также подавлять секрецию глюкагона. Назначение GLP-1 в фармакологических дозах пациентам с СД1, гипергликемией и минимальной остаточной функцией β-клетки, снижает гликемию на 3–4 ммоль/л параллельно со снижением глюкагона плазмы на 40%–50% [15].
Важным направлением развития терапии инкретинами должен стать поиск соединений, стимулирующих выработку собственного эндогенного GLP-1, а также определение клеточных механизмов, ответственных за выработку GLP-1 в ответ на поступление питательных веществ.
Альтернативным подходом является разработка системы доставки генов для усиления продукции и выделения GLP-1 в β-клетке. В исследованиях на мышах это приводило к увеличению количества β-клеток и защищало мышей от развития STZ-индуцированного СД.
Наконец, воздействие на выработку проглюкагона, такое как увеличение выработки прогормональной конвертазы в клетках островков, индуцированное аденовирусом, может приводить к превращению глюкагон-продуцирующих α-клеток в GLP-1-продуцирующие клетки [16].
Изучение новых данных о патофизиологии и патогенезе СД открывает широкие перспективы в лечении этого заболевания. Ниже перечислены лишь некоторые из них.
Возможности перепрограммирования α-клеток в β-клетки
Усиленная экспрессия гена Pax4 в глюкагон-продуцирующих клетках приводит к увеличению количества клеток, подобных β-клеткам. Это показывает, что переключение α-клеток на функционирование по типу β-клеток принципиально возможно. Открытие говорит о возможности использования Pax4 для «перепрограммирования» α-клеток в β-клетки.
Последние исследования продемонстрировали, что после введения дифтерийного токсина и гибели более 99% β-клеток у трансгенных мышей, клеточный остаток островков представлен в основном α-клетками. Под действием факторов транскрипции β-клеток (таких, как Pdx 1, Nkx 6.1) оставшиеся α-клетки временно производили и инсулин, и глюкагон, а затем полностью превращались в зрелые функциональные β-клетки. Таким образом показано, что α-клетки могут перепрограммироваться в β-клетки. Тем не менее, остается неясным, способны ли вновь образованные β-клетки заменить оригинальные, так как большое количество мышей в обоих исследованиях заболевали диабетом. Также перед учеными встает вопрос об источнике α-клеток для перепрограммирования и пересадки их человеку [2].
Тем не менее, остается неясным, способны ли вновь образованные β-клетки заменить оригинальные, так как большое количество мышей в обоих исследованиях заболевали диабетом. Также перед учеными встает вопрос об источнике α-клеток для перепрограммирования и пересадки их человеку [2].
Некоторые исследователи пытались вырастить β-клетки in vivo с помощью эктопической экспрессии различных факторов транскрипции в клетках кишечника, учитывая, что поджелудочная железа в ходе естественного органогенеза развивается из кишечника. К примеру, индуцированное аденовирусом увеличение экспрессии фактора транскрипции МafA (Ad-MafA) приводит к увеличению уровня инсулина плазмы и снижения гипергликемии, спровоцированной введением стрептозотоцина. Тем не менее, инсулин-продуцирующие клетки кишечника не усиливают секреции инсулина в ответ на оральную нагрузку глюкозой. Абсолютно ясно, что требуются дальнейшие исследования для развития безопасных и эффективных подходов для создания инсулинпродуцирующих клеток с глюкозозависимым инсулиновым ответом [17].
Другие инкретины и биоактивные гастроэнтеропанкреатические гормоны
Другие инкретины и биоактивные гастроэнтеропанкреатические гормоны могут улучшать инсулиновый ответ подобно агонистам рецепторов GLP. Предполагалось, что для этой цели возможно использование аналогов оксинтомодулина. Оксинтомодулин производится совместно с GLP-1 и является агонистом его рецепторов, но при этом он стимулирует глюкагоновые рецепторы, что можно рассматривать как негативный эффект такой терапии. Учитывая, что GIP также стимулирует секрецию глюкагона, в перспективе лечения СД ингибирование этих рецепторов, возможно, более предпочтительно, чем их стимуляция. Для этого может быть использован панкреатический пептид PYY3-36 самостоятельно или в комбинации с антагонистами рецепторов оксинтомодулина, холецистокинина и грелина [16].
Заключение
В настоящее время очевидно, что участие глюкагона в развитии СД было недооценено. Множество современных исследований посвящено глюкагону, его физиологической роли в поддержании нормального уровня глюкозы и его значения в патогенезе диабета. Нарушение обмена глюкагона, возможно, не ведущий патогенетический фактор этого заболевания, однако понимание его физиологии и функции открывает перед нами возможности улучшения терапевтического эффекта, без усиления риска тяжелых осложнений, и даже открытия новых способов коррекции углеводного обмена.
Нарушение обмена глюкагона, возможно, не ведущий патогенетический фактор этого заболевания, однако понимание его физиологии и функции открывает перед нами возможности улучшения терапевтического эффекта, без усиления риска тяжелых осложнений, и даже открытия новых способов коррекции углеводного обмена.
Авторы декларируют отсутствие конфликта (двойственности) интересов в связи с подготовкой рукописи.
1. Lefebvre PJ. Early milestones in glucagon research. Diabetes Obes Metab. 2011;13 Suppl 1:1-4. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01437.x
2. Bramswig NC, Kaestner KH. Transcriptional regulation of alpha-cell differentiation. Diabetes Obes Metab. 2011;13 Suppl 1:13-20. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01440.x
3. Cnop M, Hughes SJ, Igoillo-Esteve M, Hoppa MB, Sayyed F, van de Laar L, et al. The long lifespan and low turnover of human islet beta cells estimated by mathematical modelling of lipofuscin accumulation. Diabetologia. 2010;53(2):321-330. DOI: http://dx.doi.org/10.1007/s00125-009-1562-x [PubMed]
DOI: http://dx.doi.org/10.1007/s00125-009-1562-x [PubMed]
4. Li HJ, Ray SK, Singh NK, Johnston B, Leiter AB. Basic helix-loop-helix transcription factors and enteroendocrine cell differentiation. Diabetes Obes Metab. 2011;13 Suppl 1:5-12. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01438.x
5. Collombat P, Hecksher-Sorensen J, Krull J, Berger J, Riedel D, Herrera PL, et al. Embryonic endocrine pancreas and mature beta cells acquire alpha and PP cell phenotypes upon Arx misexpression. Journal of Clinical Investigation. 2007;117(4):961-970. DOI: http://dx.doi.org/10.1172/JCI29115
6. Collombat P, Mansouri A, Hecksher-Sorensen J, Serup P, Krull J, Gradwohl G, et al. Opposing actions of Arx and Pax4 in endocrine pancreas development. Genes and Development. 2003;17(20):2591-2603. DOI: http://dx.doi.org/10.1101/gad.269003
7. Gosmain Y, Cheyssac C, Masson MH, Guerardel A, Poisson C, Philippe J. Pax6 is a key component of regulated glucagon secretion. Endocrinology. 2012;153(9):4204-4215. DOI: http://dx.doi.org/10.1210/en.2012-1425
DOI: http://dx.doi.org/10.1210/en.2012-1425
8. Gosmain Y, Marthinet E, Cheyssac C, Guerardel A, Mamin A, Katz LS, et al. Pax6 controls the expression of critical genes involved in pancreatic {alpha} cell differentiation and function. Journal of Biological Chemistry. 2010;285(43):33381-33393. DOI: http://dx.doi.org/10.1074/jbc.M110.147215
9. Hayashi Y, Yamamoto M, Mizoguchi H, Watanabe C, Ito R, Yamamoto S, et al. Mice deficient for glucagon gene-derived peptides display normoglycemia and hyperplasia of islet {alpha}-cells but not of intestinal L-cells. Molecular Endocrinology. 2009;23(12):1990-1999. DOI: http://dx.doi.org/10.1210/me.2009-0296
10. Irwin DM. Molecular evolution of mammalian incretin hormone genes. Regulatory Peptides. 2009;155(1-3):121-130. DOI: http://dx.doi.org/10.1016/j.regpep.2009.04.009
11. Holst JJ, Vilsboll T, Deacon CF. The incretin system and its role in type 2 diabetes mellitus. Molecular and Cellular Endocrinology. 2009;297(1-2):127-136.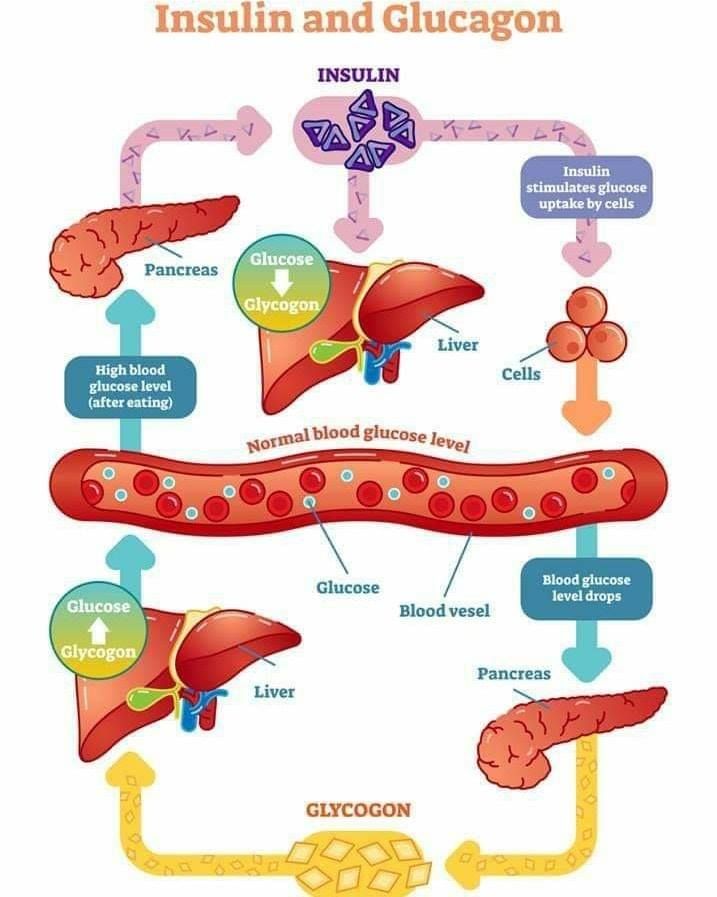 DOI: http://dx.doi.org/10.1016/j.mce.2008.08.012
DOI: http://dx.doi.org/10.1016/j.mce.2008.08.012
12. Kawamori D, Kurpad AJ, Hu J, Liew CW, Shih JL, Ford EL, et al. Insulin signaling in alpha cells modulates glucagon secretion in vivo. Cell Metabolism. 2009;9(4):350-361. DOI: http://dx.doi.org/10.1016/j.cmet.2009.02.007
13. Holst JJ, Christensen M, Lund A, de Heer J, Svendsen B, Kielgast U, et al. Regulation of glucagon secretion by incretins. Diabetes Obes Metab. 2011;13 Suppl 1:89-94. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01452.x
14. Balas B, Baig MR, Watson C, Dunning BE, Ligueros-Saylan M, Wang Y, et al. The dipeptidyl peptidase IV inhibitor vildagliptin suppresses endogenous glucose production and enhances islet function after single-dose administration in type 2 diabetic patients. Journal of Clinical Endocrinology and Metabolism. 2007;92(4):1249-1255. DOI: http://dx.doi.org/10.1210/jc.2006-1882
15. Kieffer TJ, Habener JF. The glucagon-like peptides. Endocrine Reviews. 1999;20(6):876-913. DOI: http://dx. doi.org/10.1210/er.20.6.876
doi.org/10.1210/er.20.6.876
16. Kielgast U, Holst JJ, Madsbad S. Antidiabetic actions of endogenous and exogenous GLP-1 in type 1 diabetic patients with and without residual ß-cell function. Diabetes. 2011;60(5):1599-1607. DOI: http://dx.doi.org/10.2337/db10-1790
17. Ahren B. Autonomic regulation of islet hormone secretion—implications for health and disease. Diabetologia. 2000;43(4):393-410. DOI: http://dx.doi.org/10.1007/s001250051322
Как сделать инъекцию глюкагона при экстренной ситуации для нормализации пониженного содержания сахара в крови
Поделиться
Время для прочтения: Примерно 3 мин.
Эта информация научит вас делать инъекцию (укол) глюкагона при экстренной ситуации для нормализации очень низкого содержания сахара в крови.
Очень низким содержанием сахара в крови считаются показатели ниже 50 миллиграммов на децилитр (мг/дл). Глюкагон поднимает сахар в крови до более безопасного уровня.
Используйте этот материал, чтобы вспомнить все этапы выполнения инъекции.
Вернуться к началу страницыИнформация о пониженном содержании сахара в крови (гипогликемии)
При пониженном содержании сахара в крови глюкозы в кровотоке становится недостаточно. Если содержание сахара в крови опустится слишком низко, у вас могут возникнуть следующие симптомы:
- потливость;
- дрожь;
- головная боль;
- ощущение предобморочного состояния;
- учащенное, усиленное сердцебиение.
- слабость.
Без лечения падение содержания сахара в крови может продолжиться. Это может привести к возникновению таких симптомов, как:
- нарушение координации движений;
- спутанность сознания;
- неспособность безопасно принимать пищу или пить из-за спутанности сознания;
- потеря сознания;
- судорожные припадки.

Информация о наборе для инъекции глюкагона при экстренной ситуации
Глюкагон — это гормон, который вырабатывает поджелудочная железа. Под его действием из печени в кровоток выбрасывается сахар.
Поскольку очень низкое содержание сахара в крови является опасным, это состояние требует незамедлительного лечения. Инъекция глюкагона из набора для экстренной ситуации быстро поднимает содержание сахара в крови. Вам станет лучше и ваше состояние будет более безопасным.
Рисунок 1. Набор для инъекции глюкагона при экстренной ситуации
В наборе вы найдете все необходимое для инъекции глюкагона при экстренной ситуации. В него входит флакон и шприц (см. рисунок 1). Во флаконе находится глюкагон в виде сухого порошка. Шприц заполнен жидкостью для разведения глюкагона. На шприц уже надета игла.
Лица, ухаживающие за вами, должны знать, как сделать вам инъекцию глюкагона, если содержание сахара у вас в крови упадет слишком низко.
Набор можно хранить при комнатной температуре. Проверьте срок годности набора при покупке. Сделайте пометку в календаре, чтобы заменить набор после истечения его срока годности.
Когда использовать набор для инъекции глюкагона при экстренной ситуации
Глюкагон вводится при снижении уровня сахара в крови до менее чем 50 мг/дл, а также при:
- неспособности безопасно принимать пищу или пить из-за спутанности сознания и дезориентированности;
- потере сознания;
- судорожных припадках.
По возможности кто-то должен проверить ваш уровень сахара в крови и убедиться, что он понижен. Это необходимо потому, что при высоком содержании сахара в крови вы также можете потерять сознание. В этом случае глюкагон не поможет. Вместо этого обратитесь за медицинской помощью, позвонив по телефону 911. Если вы не можете найти набор для повышения содержания глюкозы в крови и у человека появились описанные выше симптомы, пропустите этот шаг.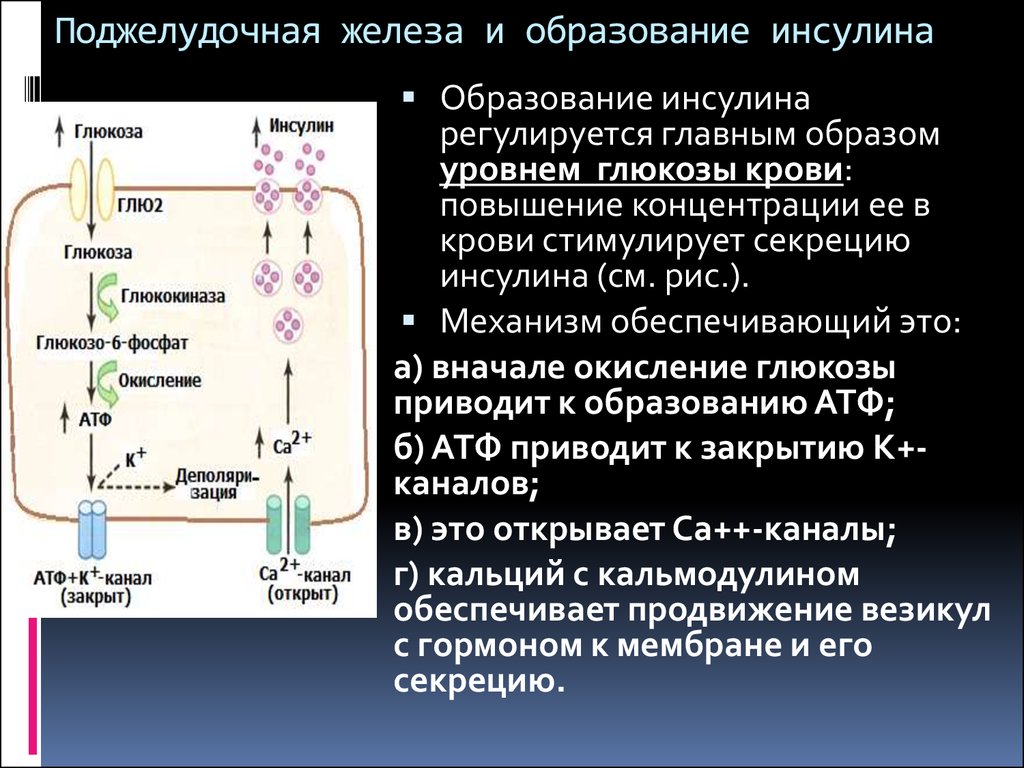
Как сделать инъекцию глюкагона
- Откройте набор для инъекции глюкагона.
- Снимите крышку флакона с глюкагоном в виде порошка (см. рисунок 2).
Рисунок 2. Вскрытие стеклянного флакона с глюкагоном в виде порошка
- Снимите колпачок с иглы шприца.
- Проткните иглой резиновую пробку на горлышке флакона.
- Нажмите на поршень шприца, чтобы ввести всю жидкость во флакон с глюкагоном (см. рисунок 3).
Рисунок 3. Введение разбавляющей жидкости во флакон с глюкагоном
- Не извлекая иглы, аккуратно потрясите или покатайте флакон в ладонях, чтобы перемешать его содержимое. Проще всего это сделать, если держать флакон и шприц в одной руке так, чтобы флакон был выше, а шприц ниже (см. рисунок 4). Смешивайте до полного растворения порошка. Раствор должен быть прозрачным и бесцветным.
- Наберите глюкагон в шприц. Для этого держите флакон и шприц так, чтобы флакон оставался выше, а кончик шприца был направлен ко дну флакона (см.
 рисунок 5). Потяните за поршень, чтобы набрать глюкагон в шприц. Обязательно наберите в шприц все лекарство из флакона.
рисунок 5). Потяните за поршень, чтобы набрать глюкагон в шприц. Обязательно наберите в шприц все лекарство из флакона.Рисунок 5. Набор глюкагона в шприц
- Глюкагон нужно вводить в бедро или в ягодицу человека. Протрите участок для введения инъекции пропитанным спиртом тампоном. Если у вас нет пропитанного спиртом тампона, пропустите этот шаг.
- Одним быстрым движением введите иглу в кожу под углом 90 градусов (двигаясь строго вверх и вниз, см. рисунок 6). Большим пальцем нажмите на поршень и опустите его до упора, пока не введете все лекарство.
Рисунок 6. Введение глюкагона
- Когда шприц опустошится, извлеките иглу из кожи, двигаясь вертикально вверх.
- После инъекции поверните человека на бок. После инъекции у него может возникнуть рвота, поэтому нужно повернуть человека на бок, чтобы он не подавился.
Вернуться к началу страницы
После инъекции глюкагона
После введения инъекции позвоните по телефону 911.
Проверьте содержание сахара в крови или попросите кого-нибудь сделать это после инъекции. Оно должно подняться хотя бы до 70 мг/дл. По прибытии сотрудников скорой медицинской помощи сообщите им полученные результаты измерения сахара в крови.
Обычно человек приходит в сознание через 15 минут после инъекции. Когда человек очнется и сможет пить, дайте ему несколько глотков фруктового сока или простой газированной воды. Это поможет восстановить содержание глюкозы в печени и предотвратит повторное падение сахара в крови.
Вернуться к началу страницыПобочные эффекты
У большинства людей не возникает никаких побочных эффектов. У некоторых людей после введения глюкагона может появиться тошнота и рвота.
Вернуться к началу страницыYou must have JavaScript enabled to use this form.
Поделитесь своим мнением
Поделитесь своим мнением
Ваш отзыв поможет нам скорректировать информацию, предоставляемую пациентам и лицам, ухаживающим за больными.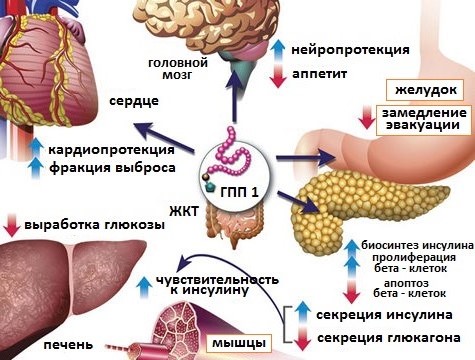
Вопросы опросника
| Questions | Да | В некоторой степени | Нет |
|---|---|---|---|
Вам было легко понять эту информацию? | Да | В некоторой степени | Нет |
Что следует объяснить более подробно?
Дата последнего обновления
где вырабатывается, функции и механизм действия
Гормоны, которые вырабатывает поджелудочная железа человека, оказывают важное воздействие на качество жизни и процессы метаболизма в организме. Инсулин находится у всех на слуху, однако мало кто знает, что его действие во многом связано с работой другого гормона – глюкагона. Чтобы разобраться в его важности, нужно рассмотреть все стороны вопроса.
Чтобы разобраться в его важности, нужно рассмотреть все стороны вопроса.
Поджелудочная железа и ее гормоны
Человеческий организм представляет собой сложный механизм, который должен работать слаженно, без сбоев, чтобы мы могли ощущать себя хорошо. Поджелудочная железа – один из важнейших органов, который участвует в основных процессах метаболизма. Именно благодаря работе этой железы продукты питания перерабатываются в те соединения, которые усваиваются клетками организма. Происходит это с помощью гормонов, которые синтезируются в поджелудочной железе.
Главные гормоны поджелудочной железы:
- Инсулин, который отвечает за уровень сахара в крови.
- Гормон глюкагон, который оказывает противоположное инсулину воздействие.
- Соматостатин выполняет функцию подавления ряда гормонально активных веществ.
- Полипептид панкреатический, который контролирует работу пищеварительной системы.
Действие гормона глюкагона тесно связано с действием инсулина. Специалисты редко рассматривают их по отдельности, хотя в разговорах об уровне сахара в крови мы чаще оперируем инсулином.
Специалисты редко рассматривают их по отдельности, хотя в разговорах об уровне сахара в крови мы чаще оперируем инсулином.
Строение глюкагона
В медицинской практике данный гормон принято называть также «гормоном голода». Определив, где вырабатывается гормон глюкагон, ученые перешли к изучению его строения. Как выяснилось, несмотря на свою важность для человеческого организма, по своей структуре глюкагон достаточно прост: состоит всего из 29 аминокислот.
Доказано, что строение гормона глюкагона одинаково для человека, коровы, свиньи и крысы. Современная фармакология использует поджелудочные железы свиней или быков для выделения необходимого вещества, которое добавляется в медикаменты.
Гормон глюкагон и его функции
Несмотря на свою малую известность, этот гормон берет на себя выполнение важных для жизни человека процессов. Попадая в кровь, гормон голода двигается в сторону печени, где взаимодействует с рецепторами ее клеток и способствует выработке глюкозы, которая также попадает в кровь. Глюкагон позволяет поддерживать ее на необходимом стабильном уровне.
Глюкагон позволяет поддерживать ее на необходимом стабильном уровне.
Другие функции гормона глюкагона:
- Стимулирует и усиливает почечный кровоток.
- Принимает активное участие в регенеративных процессах клеток печени.
- Гормон глюкагон ускоряет распад липидов и контролирует уровень холестерина в крови человека.
- Способствует быстрому выводу натрия из организма, что улучшает работу сердца.
- Выводит инсулин из клеток организма.
Этот гормон тесно взаимодействует с адреналином в моменты опасности. При увеличении уровня адреналина в крови резко повышается уровень глюкагона, что способствует лучшему кислородному снабжению мышц.
Также доказано, что в момент протекания процессов пищеварения уровень глюкагона резко падает, а уровень инсулина, напротив, возрастает. Как только процессы в организме завершены, гормональный уровень меняется в противоположную сторону.
Нормальный уровень глюкагона
На стабильную выработку гормона глюкагона в организме человека оказывает воздействие ряд факторов:
- Падение уровня глюкозы в крови.

- Повышение уровня аминокислот в крови.
- Активные физические нагрузки.
Все перечисленные действия способствуют резкому скачку глюкагона в крови. При этом специалисты склонны разделять норму содержания гормона для детей и взрослых.
Нормальный уровень:
- Дети от 4 до 14 лет. Норма находится в пределах от 0 до 148 пг/мл.
- Взрослые (старше 14 лет). Норма определяется границами от 20 до 100 пг/мл.
Резкое отклонение от нормативных показателей свидетельствует о развитии в организме патологий самого различного характера.
Уровень содержания гормона в крови человека определяется проведением забора крови из локтевой вены. Только на основании анализа крови можно определить, на каком уровне находится гормон голода.
Повышенный уровень гормона
Изменение гормонального уровня в организме человека чаще всего свидетельствует о каких-либо процессах, которые могут оказывать пагубное воздействие на здоровье. Некоторые из них протекают, на первый взгляд, незаметно.
Итак, повышение уровня гормона глюкагона является симптомом для следующих заболеваний:
- Сахарный диабет 1 типа.
- Панкреатит в острой форме.
- Цирроз печени.
- Почечная недостаточность в хронической форме.
- Гипогликемия.
- Тяжелый стресс для организма, связанный с травмирующим воздействием (операции, ожоги и др.).
Это только ряд факторов, которые повлияют на отклонение гормона голода от нормального уровня. Снижение же показателя также может говорить о патологиях: муковисцидоз, хронический панкреатит.
Препараты глюкагона
Современная медицина способна снабдить человека препаратами, которые помогут естественным процессам организма правильно регулировать гормональный фон. Выяснив, где вырабатывается гормон глюкагон, какие функции он выполняет, на что влияет и для чего необходим, ученые успешно решили вопрос с созданием соответствующих лекарственных средств.
В первую очередь препараты с содержанием глюкагона используются для снятия спазмов, улучшения работы сердечно-сосудистой системы, а также для лечения сахарного диабета. В состав лекарства входит гормон, которые выделяется из поджелудочной железы коров и свиней (как указано выше, структура гормона у указанных животных идентична человеческому).
В состав лекарства входит гормон, которые выделяется из поджелудочной железы коров и свиней (как указано выше, структура гормона у указанных животных идентична человеческому).
Показания к применению
Применение препаратов, которые оказывают влияние на гормональный фон, возможно исключительно по рекомендации врача. В противном случае это чревато развитием нежелательных патологических последствий.
Согласно исследованиям, препараты, в составе которых находится животный глюкагон, назначаются в следующих случаях:
- Для эффекта расслабления мышц желудка и кишечника.
- Проведение шоковой терапии пациентов, страдающих психическими расстройствами.
- Сахарный диабет, в некоторых случаях диабет 2 типа.
- Устранение спазмов при дивертикулезе кишечника.
- Вспомогательное средство для проведения лабораторной диагностики организма.
Подобные лекарственные средства должны скорректировать уровень глюкозы в крови человека, в некоторых случаях дополнительного применению инсулина не требуется.
Противопоказания к применению
Подобный гормональный препарат выпускается в форме раствора для инъекций, который может вводиться как внутривенно, внутримышечно, так и подкожно. Для экстренного применения подходят только первые два типа введения лекарства.
Подходящую дозировку определяет лечащий врач, основываясь на диагнозе пациента, его индивидуальных особенностях организма. Для лечения и для подготовки к обследованию используются различные дозы препарата. Врачи отмечают, что в экстренных случаях улучшение состояния наступает в течение десяти минут.
Существуют ограничения к применению:
- Беременность. Доказано, что препарат не проникает через плацентарный барьер, а значит безопасен для плода. Однако врачи рекомендуют применение лекарств только в крайних случаях.
- Не рекомендуется использовать препарат для детей, вес которых составляет менее 25 килограммов.
- Индивидуальная непереносимость вспомогательных компонентов препарата.
Во всех иных случаях все рекомендации зависят исключительно от решения врача. После проведения терапии глюкагоном пациенту необходим восстановительный период: пища с содержанием белка, сладкий чай и покой около 2-3 часов.
После проведения терапии глюкагоном пациенту необходим восстановительный период: пища с содержанием белка, сладкий чай и покой около 2-3 часов.
Заключение
Врачи сходятся в едином мнении, что лучшей профилактикой заболеваний является правильный образ жизни, что также способствует поддержанию необходимого гормонального фона. Избежать неприятных отклонений возможно, если следить за своим питанием и бдительно относиться к сигналам собственного организма.
Путем устранения действия глюкагона диабет 1 типа можно перевести в форму бессимптомного, не зависящего от инсулина расстройства
Главная > Новости > Путем устранения действия глюкагона диабет 1 типа можно перевести в форму бессимптомного, не зависящего от инсулина расстройства
Путем устранения действия глюкагона диабет 1 типа можно перевести в форму бессимптомного, не зависящего от инсулина расстройства
Ученые Юго-западного медицинского центра (Southwestern Medical Center) Техасского Университета (University of Texas — UT) считают, что путем устранения действия определенного гормона диабет 1 типа можно перевести в форму бессимптомного, не зависящего от инсулина расстройства. Полученные ими в экспериментах на мышах результаты свидетельствуют о том, что инсулин становится совершенно лишним и его отсутствие не приводит к диабету или любой другой аномалии, если подавлено действие глюкагона. Вырабатываемый поджелудочной железой гормон глюкагон предупреждает низкий уровень сахара в крови здоровых людей и повышает его уровень при диабете 1 типа. Доктор Роджер Унгер (слева) и доктор Янг Ли (Young Lee) в исследованиях на животных установили, что блокирование гормона глюкагона может устранить симптомы сахарного диабета 1 типа. (Фото: utsouthwestern.edu) «Мы все привыкли считать, что инсулин – всемогущий гормон, без которого жизнь невозможна, но это не так», — говорит доктор Роджер Унгер (Roger Unger), профессор кафедры внутренних болезней и старший автор статьи, опубликованной в журнале Diabetes. «Если диабет определяется как восстановление до нормы гомеостаза глюкозы, тогда наш метод может, вероятно, рассматриваться как очень близкий к средству «исцеления»». Введение инсулина является золотым стандартом лечения диабета 1 типа (инсулин-зависимого диабета) со времени его открытия в 1922 году. Но регуляция диабета только инсулином, даже оптимальная, не может восстановить нормальную толерантность к глюкозе. Новые данные свидетельствуют о том, что восстановление толерантности к глюкозе до нормы достигается устранением действия глюкагона. Обычно глюкагон выделяется при низком уровне в крови глюкозы, или сахара. При инсулиновой недостаточности, однако, уровни глюкагона чрезмерно высоки, что заставляет печень выделять в кровь дополнительное количество глюкозы. Это действие противоположно действию инсулину, который стимулирует удаление сахара из крови клетками организма. При диабете 1 типа, которым страдает около 1 миллиона человек только в США, погибают вырабатывающие инсулин островковые клетки поджелудочной железы. В качестве контрмеры больные должны получать инсулин несколько раз в день, чтобы усваивать находящийся в крови сахар, регулировать его уровень и предотвращать диабетическую кому. Ученые изучили, как генетически модифицированные мыши с отсутствием рецепторов глюкагона отвечают на оральный тест на толерантность к глюкозе. Тест, который может быть использован для диагностики диабета, гестационного диабета (диабета беременных) и преддиабета, оценивает способность организма метаболизировать, или расщеплять, находящуюся в крови глюкозу. Исследователи установили, что мыши с нормальной продукцией инсулина, но без функционирующих рецепторов глюкагона отвечают на тест нормально. Такая же картина наблюдалась, если были разрушены их инсулин-продуцирующие бета-клетки. Мыши не испытывали действия ни инсулина, ни глюкагона, но диабет у них не развивался. «Эти данные позволяют предположить, что если нет глюкагона, не имеет значения, есть ли инсулин», — объясняет доктор Унгер. «Это не означает, что инсулин неважен. Он необходим для нормального роста и развития от рождения до зрелого возраста. Но в зрелом возрасте, по крайней мере, в том, что касается метаболизма глюкозы, роль инсулина заключается в контроле над глюкагоном». «И если у вас нет глюкагона, инсулин вам не нужен». Следующим шагом в работе исследователей будет определение механизма, приводящего к такому результату. «Мы надеемся, что это открытие когда-нибудь поможет больным диабетом 1 типа», — говорит ведущий автор статьи доктор Янг Ли (Young Lee), доцент кафедры внутренних болезней Юго-западного медицинского центра UT. «Если нам удастся найти способ блокировать действие глюкагона у людей, мы сможем минимизировать необходимость инсулинотерапии». Все, что снижает необходимость введения инсулина, является благом, считает доктор Унгер. «Достижение с помощью инъекций уровней инсулина, достаточно высоких для того, чтобы достичь глюкагоновых клеток, возможно только при количествах, которые являются избыточными для других тканей», — говорит он. «Периферически введенный инсулин не может точно дублировать нормальный процесс, с помощью которого организм вырабатывает и распределяет этот гормон». Если полученные результаты подтвердятся на людях, больным с диабетом 1 типа больше будут не нужны инъекции инсулина. Источник: lifesciencestoday.ru
|
ISSN 2588-0519 (Print)
ISSN 2618-8473 (Online)
Революционные перемены в эндокринологии | Панков
Эндокринология первоначально зародилась как наука о железах внутренней секреции, которые являются высокоспециализированными органами и выполняют четко очерченные физиологические функции. У этих органов отсутствуют протоки, которые выводят секрет в полости тела, и они направляют синтезируемые ими активные вещества в кровяное русло, которые с кровью распространяются по всему телу и регулируют функции разных органов. В результате успешных исследований первой половины прошлого века довольно быстро был идентифицирован ряд эндокринных желез, в состав которых вошли надпочечники, половые железы (тестикулы и яичники) и щитовидная железа, секретирующие в кровь небелковые (стероидные и тиреоидные) гормоны, а также поджелудочная, паращитовидная железы, плацента и др.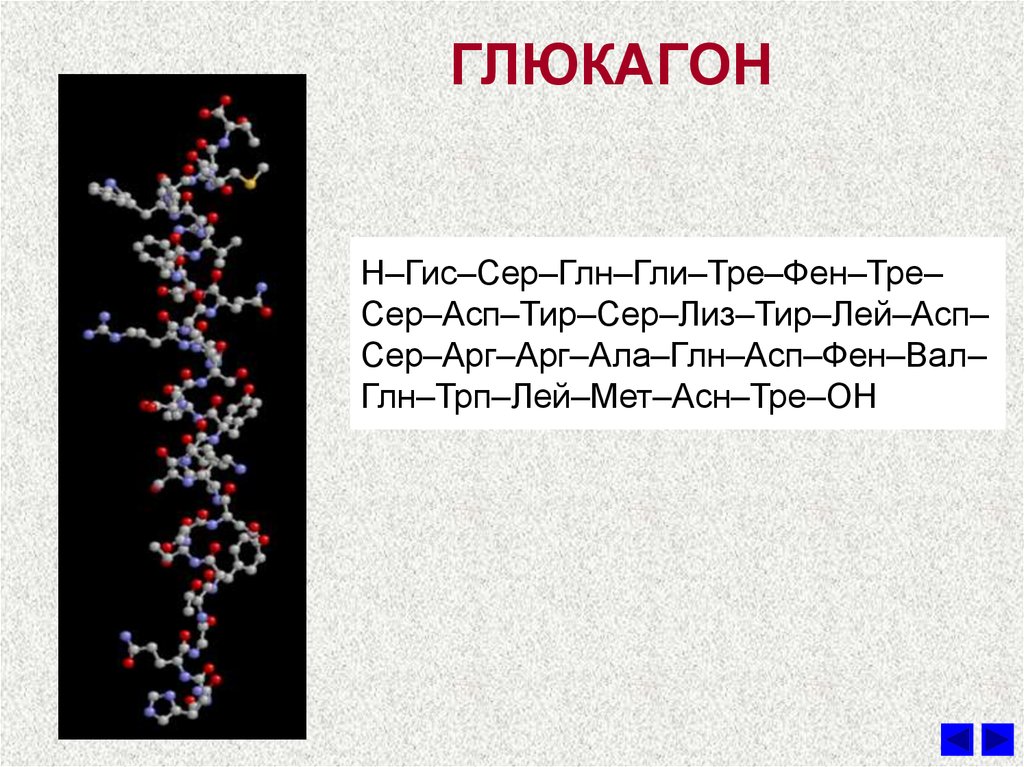 Почти сразу же был выявлен центральный орган внутренней секреции — гипофиз, вырабатывающий белковые тропные гормоны (АКТГ, ЛГ, ФСГ, соматотропин, пролактин, тиреотропный гормон и др.), которые проявляют свое действие на периферии и контролируют секрецию гормонов периферическими железами внутренней секреции. Интересно, что все эндокринные органы, функционирующие независимо от гипофиза, сами секретируют в кровь гормоны белковой природы. Поджелудочная железа вырабатывает инсулин и глюкагон, паращитовидная железа — паратгормон, а плацента — хорионические гонадотропин и соматомаммотропин.
Почти сразу же был выявлен центральный орган внутренней секреции — гипофиз, вырабатывающий белковые тропные гормоны (АКТГ, ЛГ, ФСГ, соматотропин, пролактин, тиреотропный гормон и др.), которые проявляют свое действие на периферии и контролируют секрецию гормонов периферическими железами внутренней секреции. Интересно, что все эндокринные органы, функционирующие независимо от гипофиза, сами секретируют в кровь гормоны белковой природы. Поджелудочная железа вырабатывает инсулин и глюкагон, паращитовидная железа — паратгормон, а плацента — хорионические гонадотропин и соматомаммотропин.
Вскоре было показано, что функция гипофиза регулируется и управляется гормонами гипоталамуса, который связан с гипофизом портальной системой сосудов. Продукты секреции гипоталамуса (тиролиберин, гонадолиберин, соматолиберин и др.) через портальную систему сосудов поступают в гипофиз и регулируют его гормональную активность. Нейрогипофиз, или задняя доля гипофиза, представляет собой вырост гипоталамуса, но морфологически он соединен в единый орган с аденогипофизом. Гормоны нейрогипофиза окситоцин и вазопрессин синтезируются в гипоталамусе, по его нейронам поступают в заднюю долю гипофиза, где накапливаются и секретируются в кровь в зависимости от возникающих потребностей организма. Сложившаяся и утвердившаяся общая схема эндокринной регуляции [1] просуществовала практически неизмененой вплоть до середины 90-х годов прошлого столетия. Однако довольно быстро были открыты гормоны, которые секретируются не традиционными железами внутренней секреции, а другими органами. Оказалось, что почки выделяют в кровь ренин и ангиотензин, регулирующие АД, но это воспринималось специалистами-эндокринологами как некое исключение из общего правила.
Гормоны нейрогипофиза окситоцин и вазопрессин синтезируются в гипоталамусе, по его нейронам поступают в заднюю долю гипофиза, где накапливаются и секретируются в кровь в зависимости от возникающих потребностей организма. Сложившаяся и утвердившаяся общая схема эндокринной регуляции [1] просуществовала практически неизмененой вплоть до середины 90-х годов прошлого столетия. Однако довольно быстро были открыты гормоны, которые секретируются не традиционными железами внутренней секреции, а другими органами. Оказалось, что почки выделяют в кровь ренин и ангиотензин, регулирующие АД, но это воспринималось специалистами-эндокринологами как некое исключение из общего правила.
Примерно 4 года назад мировая общественность отмечала 100-летнюю годовщину открытия первого гормона — адреналина, секретируемого в кровь мозговым слоем надпочечников. Вскоре было показано существование его аналога норадреналина. Однако адреналин в то время еще не называли гормоном. Впервые термин «гормон» ввели Бейлис и Стейнбек в 1902 г. , и гормоном стали называть секретин, вырабатываемый желудком [3]. Интересно, что термин «гормон» впервые был введен для названия вещества, секретируемого в кровь не традиционным эндокринным органом, а клетками желудка.
, и гормоном стали называть секретин, вырабатываемый желудком [3]. Интересно, что термин «гормон» впервые был введен для названия вещества, секретируемого в кровь не традиционным эндокринным органом, а клетками желудка.
Следует отметить, что исследование гормонов желудочно-кишечного тракта развивалось очень быстрыми темпами и часто опережало изучение гормонов традиционных эндокринных органов. В результате, кроме секретина, были выделены и исследованы гастрин, панкреозимин, холецистокинин, бомбезин, вещество Р, вазоактивный интестинальный пептид, нейротензин и десятки других соединений [2]. Одним из последних интересных гормонов желудочно-кишечного тракта стал гре- лин, регулирующий соматотропную функцию гипофиза.
Удивительный факт, который часто поражал специалистов, заключался в том, что как только открывали новый гормон пищеварительного тракта, всегда находились исследователи, которые сразу же показывали присутствие этого гормона в различных структурах мозга [2]. Сделанные открытия длительное время не находили удовлетворительного объяснения или какой-либо разумной интерпретации, и ученые их просто констатировали, не углубляясь в детальное обсуждение возникшей проблемы.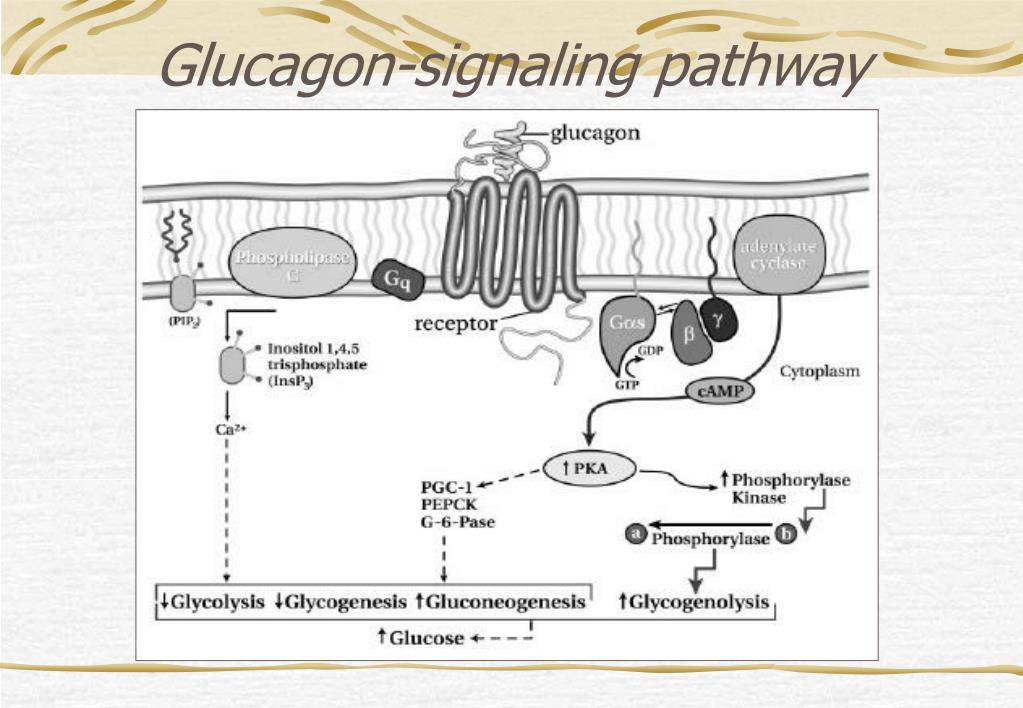 Впоследствии появлялись специалисты, которые рассматривали мозг также как эндокринный орган, способный секретировать гормоны, что подтверждалось секрецией разных гормонов гипоталамусом — одним из отделов мозга. Так эндокринология постепенно превращалась в науку о свойствах и роли гормональных веществ, регулирующих различные физиологические функции.
Впоследствии появлялись специалисты, которые рассматривали мозг также как эндокринный орган, способный секретировать гормоны, что подтверждалось секрецией разных гормонов гипоталамусом — одним из отделов мозга. Так эндокринология постепенно превращалась в науку о свойствах и роли гормональных веществ, регулирующих различные физиологические функции.
Открытие лептина
Постепенно и неуклонно круг эндокринных органов расширялся очень быстрыми темпами. Выдающиеся достижения последнего десятилетия свидетельствуют, что интересным эндокринным органом является подкожная жировая клетчатка, которая секретирует в кровь лептин, играющий важную роль в организме [3, 7, И, 17]. Большую часть своих эффектов лептин осуществляет через воздействие на нейроны мозга, но может оказывать и прямое действие на периферические органы. При дефиците лептина или при нарушении молекулярных механизмов его действия в организме повышается аппетит, снижается энергетический обмен, развивается ожирение, блокируется эффективность действия эндогенного инсулина и других гормонов, возникает сахарный диабет, нарушается репродуктивная функция, у женских особей развивается поликистоз яичников, задерживается рост тела и выявляются другие формы патологии.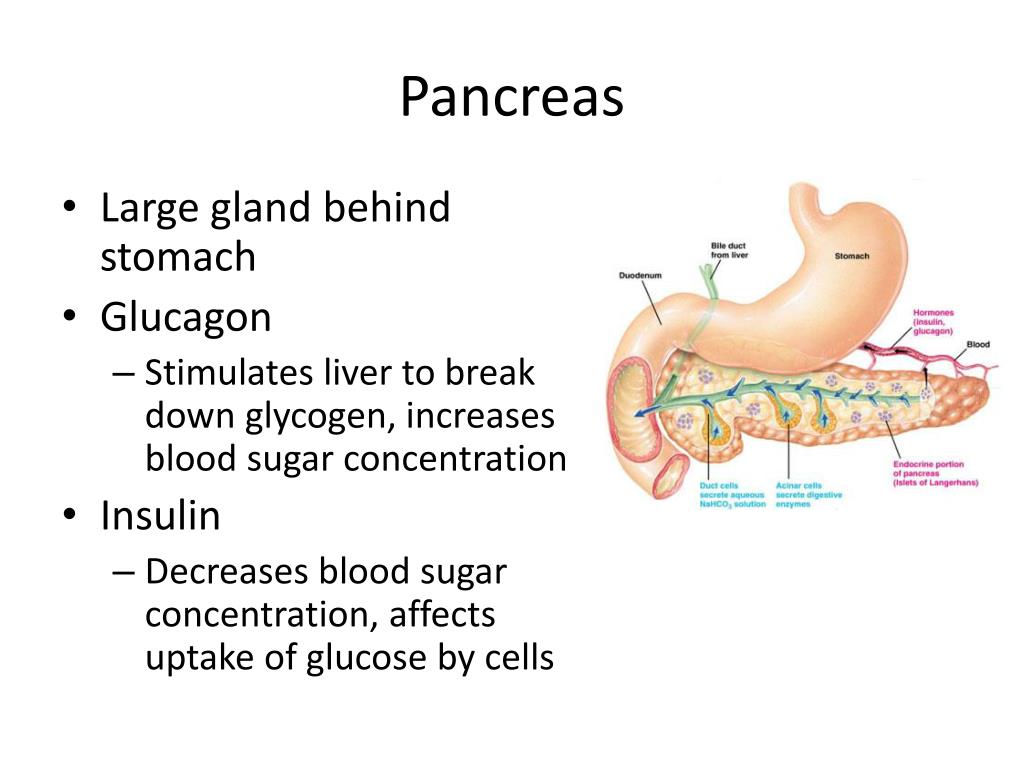 Если эти формы патологии были вызваны дефицитом лептина, то введение гормона восстанавливает нарушенные функции до нормы. Более трудной задачей является исправление патологии, которая связана не с отсутствием лептина, а с недостаточностью его рецепторов или с неспособностью эндогенного гормона выполнять физиологические функции. Наука пока не знает эффективных подходов к исправлению нарушений, которые ассоциируются не с недостатком гормонов, а с повреждением рецепторов или других проводников гормонального действия [3,11,17].
Если эти формы патологии были вызваны дефицитом лептина, то введение гормона восстанавливает нарушенные функции до нормы. Более трудной задачей является исправление патологии, которая связана не с отсутствием лептина, а с недостаточностью его рецепторов или с неспособностью эндогенного гормона выполнять физиологические функции. Наука пока не знает эффективных подходов к исправлению нарушений, которые ассоциируются не с недостатком гормонов, а с повреждением рецепторов или других проводников гормонального действия [3,11,17].
Следует отметить, что жировая ткань секретирует в кровь не только лептин. Она вырабатывает адипонектин, при дефиците которого, как и при недостаточности лептина, нарушается функционирование эндогенного инсулина, снижается его регулирующее действие на углеводный обмен и обостряются патологические процессы, развивающиеся при сахарном диабете [14].
Гормоны сердечно-сосудистой системы
Гормоны вырабатываются не только жировой тканью и, помимо известных эндокринных органов, они секретируются в кровь также органами и тканями сердечно-сосудистой системы. Сегодня можно иногда услышать заявления о том, что сердце не выполняет каких-либо физиологических функций, кроме обеспечения организма кровью, которая доставляет питательные вещества и кислород, необходимые для нормального обмена веществ, и удаляет конечные продукты обмена. Мягко выражаясь, такое утверждение является глубоким заблуждением. В настоящее время показано, что сердце и сосуды секретируют в кровь большое количество гормонов, совершенно необходимых для нормальной жизни [12]. Предсердия и желудочки, например, синтезируют по крайней мере 3 натрийуретических гормона (НУГ), которые, судя по их названию, призваны стимулировать выделение из организма ионов натрия. Однако более глубокие исследования выявили совершенно неожиданные формы их биологического действия. Одним из интересных эффектов стало вызываемое этими гормонами расширение сосудов и снижение АД-
Сегодня можно иногда услышать заявления о том, что сердце не выполняет каких-либо физиологических функций, кроме обеспечения организма кровью, которая доставляет питательные вещества и кислород, необходимые для нормального обмена веществ, и удаляет конечные продукты обмена. Мягко выражаясь, такое утверждение является глубоким заблуждением. В настоящее время показано, что сердце и сосуды секретируют в кровь большое количество гормонов, совершенно необходимых для нормальной жизни [12]. Предсердия и желудочки, например, синтезируют по крайней мере 3 натрийуретических гормона (НУГ), которые, судя по их названию, призваны стимулировать выделение из организма ионов натрия. Однако более глубокие исследования выявили совершенно неожиданные формы их биологического действия. Одним из интересных эффектов стало вызываемое этими гормонами расширение сосудов и снижение АД-
Помимо влияния на кровяное русло, вновь открытые гормоны проявляли многие другие свойства. Например,чрезвычайная экспрессия гена одного из НУГ (а именно НУГ В) у трансгенных животных, помимо влияния на АД, оказывает стимулирующее действие на рост костной ткани и вызывает такое быстрое разрастание скелета, что кости не помещаются в нормально растущем теле и возникают различного рода искривления и деформации [12]. Все это доказывает, что в нормально развивающемся организме сердце участвует в эндокринной регуляции роста скелета и костной ткани.
Все это доказывает, что в нормально развивающемся организме сердце участвует в эндокринной регуляции роста скелета и костной ткани.
Другой НУГ (НУГ А) имеет прямое отношение к различного рода патологиям сердечно-сосудистой системы. Его концентрация увеличивается при врожденных пороках сердца и злокачественной гипертонии. При этом выявляется четкая зависимость между тяжестью заболевания и степенью повышения уровня циркулирующего в крови НУГ.
Сердце секретирует многие другие гормональные вещества, которые тоже регулируют давление. К ним относятся, в частности, адреномедуллин и белок, родственный паратиреоидному гормону [4, 8, 12]. Как и НУГ, эти соединения вызывают расширение сосудов и снижают АД. Интересно, что экспрессия генов гормонов сердца увеличивается при возрастании давления на сердечную мышцу или при простом ее физическом растяжении, т. е. при развитии гипертонии сердце выделяет в кровь гормоны, которые вызывают расширение сосудов и снижают давление. Какие механизмы лежат в основе такой активации экспрессии генов, пока остается загадкой, однако можно видеть, что она проявляется как естественный компенсаторный процесс, в результате которого повышение АД увеличивает нагрузку на стенки сердечных сосудов и запускает гормональные реакции, вызывающие снижение давления. Возможность существования подобного механизма саморегуляции подозревал еще И. П. Павлов, когда занимался исследованием сердечно-сосудистой системы, однако выяснение точных биохимических механизмов, лежащих в основе такой регуляции, в тот период еще представляло слишком большие трудности.
Возможность существования подобного механизма саморегуляции подозревал еще И. П. Павлов, когда занимался исследованием сердечно-сосудистой системы, однако выяснение точных биохимических механизмов, лежащих в основе такой регуляции, в тот период еще представляло слишком большие трудности.
Важную роль в регуляции жизненных процессов играют гормоны эндотелия кровеносных сосудов (эндотелины). Один из таких гормонов, эндотелии-1, вызывает сильное сокращение сосудов в 100 раз активнее, чем норадреналин [12]. Он причастен ко многим формам патологии сердечно-сосудистой системы и других органов. Концентрация эндоте- лина-1 резко увеличивается при легочной гипертонии, врожденных пороках сердца, гипертрофии миокарда, ишемических повреждениях. В отличие от эндотелина-1 эндотелины 2 и 3 вызывают не сокращение, а расширение сосудов и снижают АД; их действие осуществляется через стимуляцию образования в стенках сосудов оксида азота (NO) — известного вазодилататора [8, 12].
Помимо влияния на сосуды эндотелины регулируют пролиферацию и дифференцировку клеток, синтез белков, иммунные процессы и секрецию го- монов другими органами.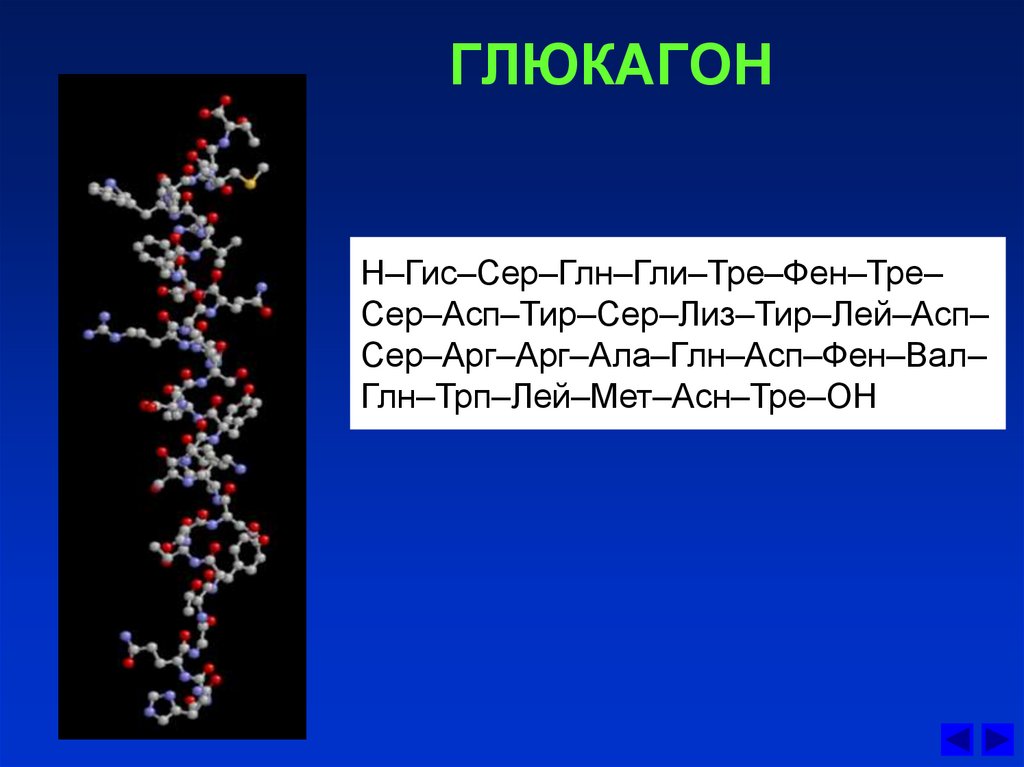 Они участвуют в регуляции репродукции путем активации секреции гонадотропинов гипофизом, но проявляют также прямое влияние на сокращение матки и скорость кровотока через половые органы. Поэтому сердце и кровеносные сосуды являются эндокринными органами и регулируют гемодинамику, рост скелета, репродукцию, иммунитет и другие физиологические процессы.
Они участвуют в регуляции репродукции путем активации секреции гонадотропинов гипофизом, но проявляют также прямое влияние на сокращение матки и скорость кровотока через половые органы. Поэтому сердце и кровеносные сосуды являются эндокринными органами и регулируют гемодинамику, рост скелета, репродукцию, иммунитет и другие физиологические процессы.
В связи с этим, вероятно, является заблуждением уверенность в том, что искусственные органы типа искусственного сердца или искусственной почки способны в полной мере компенсировать нарушения физиологических процессов, вызванные повреждением этих органов. На самом деле они заменяют только одну из функций сердца или почек, оставляя нарушенными многие другие, в том числе эндокринные. Высказанный постулат подтверждается тем, что почти все пациенты, присоединенные к искусственным органам, как правило, умирают, если развившиеся у них патологические процессы не удается компенсировать более адекватными и более эффективными методами.
Открытие грелина
Заслуживает внимания новый гормон желудочно-кишечного тракта грелин [16]. В 1992 г. в гипофизе был идентифицирован рецептор, для которого были неизвестны природные лиганды или гормоны, но с ним связывались синтетические пептидные и непептидные препараты и активировали секрецию гипофизом соматотропина и стимулировали рост тела. Многие из исследованных пептидных активаторов были гомологичны метэнкефали- ну, но в отличие от него не оказывали обезболивающего действия. Интересно, что признанный гипоталамический стимулятор секреции гормона роста соматолиберин совсем не связывался с новым рецептором и осуществлял свое действие через другой рецептор.
В 1992 г. в гипофизе был идентифицирован рецептор, для которого были неизвестны природные лиганды или гормоны, но с ним связывались синтетические пептидные и непептидные препараты и активировали секрецию гипофизом соматотропина и стимулировали рост тела. Многие из исследованных пептидных активаторов были гомологичны метэнкефали- ну, но в отличие от него не оказывали обезболивающего действия. Интересно, что признанный гипоталамический стимулятор секреции гормона роста соматолиберин совсем не связывался с новым рецептором и осуществлял свое действие через другой рецептор.
Японские исследователи предприняли серию попыток выделить природный лиганд нового рецептора из разных тканей [15]. Естественно, они начали работу с гипоталамуса, вполне обоснованно полагая, что именно этот отдел мозга — основной регулятор функции гипофиза — должен быть главным источником подобного гормона. Однако все попытки получить активный препарат из мозга были тщетными, природный лиганд нового рецептора в гипоталамусе отсутствовал. Исследование других органов и тканей показало, что искомое соединение в наибольшем количестве синтезируется желудком, секретируется в кровь и стимулирует секрецию гипофизом гормона роста. Сразу же была установлена структура гормона, проведен химический синтез и подробно исследованы его биологические свойства. Новый пептид был назван грели- ном, и вскоре было показано, что он синтезируется также в других органах, включая гипоталамус, но в значительно меньшем количестве. Специальные расчеты показывают, что более 80% циркулирующего грелина синтезируется и секретируется в кровь желудочно-кишечным трактом, тогда как вклад других органов не превышает 20%. Грелин активирует секрецию гормона роста и осуществляет свое действие, по крайней мере частично, в синергизме с известными гормонами гипоталамуса. Помимо непосредственной активации секреции гормона роста, грелин увеличивает эффективность действия соматолиберина, синтезируемого в гипоталамусе, и снижает тормозящее влияние соматостатина на секрецию гормона роста.
Исследование других органов и тканей показало, что искомое соединение в наибольшем количестве синтезируется желудком, секретируется в кровь и стимулирует секрецию гипофизом гормона роста. Сразу же была установлена структура гормона, проведен химический синтез и подробно исследованы его биологические свойства. Новый пептид был назван грели- ном, и вскоре было показано, что он синтезируется также в других органах, включая гипоталамус, но в значительно меньшем количестве. Специальные расчеты показывают, что более 80% циркулирующего грелина синтезируется и секретируется в кровь желудочно-кишечным трактом, тогда как вклад других органов не превышает 20%. Грелин активирует секрецию гормона роста и осуществляет свое действие, по крайней мере частично, в синергизме с известными гормонами гипоталамуса. Помимо непосредственной активации секреции гормона роста, грелин увеличивает эффективность действия соматолиберина, синтезируемого в гипоталамусе, и снижает тормозящее влияние соматостатина на секрецию гормона роста. В результате все эффекты грелина суммируются, приводят к значительному повышению содержания соматотропина в крови и заметно активируют рост тела.
В результате все эффекты грелина суммируются, приводят к значительному повышению содержания соматотропина в крови и заметно активируют рост тела.
Вместе с тем грелин стимулирует секрецию гипофизом не только гормона роста, но и пролактина и АКТГ [16]. Поэтому он может иметь прямое отношение к таким формам патологии, как гиперпролактинемия и болезнь Иценко—Кушинга, которые часто развиваются у человека, однако этиология и патогенез этих заболеваний, несмотря на многочисленные исследования, остаются не до конца понятными. Вполне возможно, что чрезмерная секреция грелина желудком может быть одной из вероятных причин развития подобных форм патологии.
Во взаимодействии с инсулином и лептином грелин регулирует энергетический и углеводный обмен. Однако в отличие от лептина и инсулина он не снижает, а повышает аппетит, увеличивает потребление пищи, активирует синтез липидов и вызывает развитие ожирения в результате активации действия орексигенных и торможения анорекси- генных нейропептидов. Наиболее высокая концентрация грелина выявляется у пациентов с сидро- мом Прадера—Вилли, страдающих ожирением [16]. При других формах патологии, сочетающихся с избыточным накоплением массы тела, увеличение концентрации грелина обычно менее выражено. Большую часть рассмотренных эффектов грелин, как и лептин, осуществляет через центральную нервную систему путем воздействия на нейроны вентромедиальной области гипоталамуса, где гематоэнцефалический барьер является не таким высоким, как в других отделах мозга, и в меньшей степени препятствует проникновению гормонов в структуры мозга.
Наиболее высокая концентрация грелина выявляется у пациентов с сидро- мом Прадера—Вилли, страдающих ожирением [16]. При других формах патологии, сочетающихся с избыточным накоплением массы тела, увеличение концентрации грелина обычно менее выражено. Большую часть рассмотренных эффектов грелин, как и лептин, осуществляет через центральную нервную систему путем воздействия на нейроны вентромедиальной области гипоталамуса, где гематоэнцефалический барьер является не таким высоким, как в других отделах мозга, и в меньшей степени препятствует проникновению гормонов в структуры мозга.
Как можно видеть, грелин является одним из новых гормонов желудочно-кишечного тракта, к которым можно отнести и инсулин, поскольку он секретируется в кровь [3-клетками поджелудочной железы.
Гормоны и центральная нервная система
Как было отмечено в начале статьи, гормоны желудочно-кишечного тракта довольно быстро обнаруживаются в мозге, где идентифицирован и инсулин. Какую функцию инсулин и другие гормоны выполняют в нейронах, пока остается загадкой. Можно провести лишь некую аналогию с разной ролью проопиомеланокортина (ПОМК) в зависимости от места биосинтеза этого белкового предшественника. Когда ПОМК синтезируется в передней доле гипофиза, из него образуется АКТГ, который с кровью поступает в кору надпочечников и стимулирует секрецию кортикостероидов, регулирующих важные физиологические функции. Когда ПОМК синтезируется в нейронах гипоталамуса, он подвергается более глубокому расщеплению, и из него высвобождаются а-меланостимулирующий гормон и другие меланокортины, которые являются проводниками действия лептина в синапсах нейронов, уменьшают чувство голода, потребление пищи и препятствуют развитию ожирения [6]. Проводниками каких биологических эффектов и каких лигандов в нейронах мозга являются инсулин и другие гормоны и какие функции они регулируют в нервной системе, науке еще предстоит исследовать.
Можно провести лишь некую аналогию с разной ролью проопиомеланокортина (ПОМК) в зависимости от места биосинтеза этого белкового предшественника. Когда ПОМК синтезируется в передней доле гипофиза, из него образуется АКТГ, который с кровью поступает в кору надпочечников и стимулирует секрецию кортикостероидов, регулирующих важные физиологические функции. Когда ПОМК синтезируется в нейронах гипоталамуса, он подвергается более глубокому расщеплению, и из него высвобождаются а-меланостимулирующий гормон и другие меланокортины, которые являются проводниками действия лептина в синапсах нейронов, уменьшают чувство голода, потребление пищи и препятствуют развитию ожирения [6]. Проводниками каких биологических эффектов и каких лигандов в нейронах мозга являются инсулин и другие гормоны и какие функции они регулируют в нервной системе, науке еще предстоит исследовать.
В зависимости от места синтеза в различных органах гормоны могут выполнять эндокринную, паракринную, аутокринную или нейрокринную функции. Поэтому гормоны являются основными средствами коммуникации между органами и тканями, поддерживают постоянные контакты этих органов с нервной системой и объединяют их в единое целое, именуемое живым организмом [2, 11]. Независимо от формы регуляции молекулярные механизмы действия гормонов во всех случаях остаются одинаковыми. При действии в различных тканях гормоны связываются с рецепторами, запускают каскад реакций, которые активируют или тормозят экспрессию генов, и индуцируют другие биохимические реакции. Конечные проявления действия гормонов зависят не только от самого гормона, но и от особенностей специализации и функционирования каждой ткани, и вызываемые ими эффекты могут существенно различаться при действии гормонов в мышцах, печени, мозге, жировой ткани или половых органах [13].
Поэтому гормоны являются основными средствами коммуникации между органами и тканями, поддерживают постоянные контакты этих органов с нервной системой и объединяют их в единое целое, именуемое живым организмом [2, 11]. Независимо от формы регуляции молекулярные механизмы действия гормонов во всех случаях остаются одинаковыми. При действии в различных тканях гормоны связываются с рецепторами, запускают каскад реакций, которые активируют или тормозят экспрессию генов, и индуцируют другие биохимические реакции. Конечные проявления действия гормонов зависят не только от самого гормона, но и от особенностей специализации и функционирования каждой ткани, и вызываемые ими эффекты могут существенно различаться при действии гормонов в мышцах, печени, мозге, жировой ткани или половых органах [13].
Активному изучению этой проблемы способствуют новые эффективные методы, разработанные в современной медико-биологической науке [5, 9, 13]. К этим методам относится, в частности, нокаутирование генов, которое блокирует экспрессию генов и тормозит биосинтез кодируемых генами белков. Совершенно естественно, что нокаутирование генов инсулина или инсулиноподобного ростового фактора, как и ликвидация генов рецепторов этих гормонов во всем теле, приводит к быстрой гибели животных, поскольку отсутствие кодируемых этими генами белков во всем организме оказывается несовместимым с поддержанием нормальной жизни. Поэтому выдающимся достижением стала разработка технологии ликвидации генов не во всем теле, а избирательное их повреждение только в отдельных органах или тканях [5, 9, 13]. Блокада экспрессии генов только в отдельных органах вызывает серьезные нарушения, но подопытные животные продолжают жить, что позволяет исследовать их более тщательно.
Совершенно естественно, что нокаутирование генов инсулина или инсулиноподобного ростового фактора, как и ликвидация генов рецепторов этих гормонов во всем теле, приводит к быстрой гибели животных, поскольку отсутствие кодируемых этими генами белков во всем организме оказывается несовместимым с поддержанием нормальной жизни. Поэтому выдающимся достижением стала разработка технологии ликвидации генов не во всем теле, а избирательное их повреждение только в отдельных органах или тканях [5, 9, 13]. Блокада экспрессии генов только в отдельных органах вызывает серьезные нарушения, но подопытные животные продолжают жить, что позволяет исследовать их более тщательно.
Тканеспецифическое нокаутирование генов рецептора инсулина
В настоящей публикации нет необходимости подробно останавливаться на деталях разработанных методов, поскольку они являются довольно сложными, и можно просто провести анализ конкретных результатов, полученных в ходе таких исследований, ограничиваясь в основном работами по нокаутированию гена рецептора инсулина в разных органах [9, 13]. Подробное обсуждение этих данных было представлено 1 сентября 2004 г. Ronald С. Kahn на 12-м Международном эндокринологическом конгрессе в Лиссабоне в пленарной лекции «Дальнейшие исследования патогенеза диабета на животных с нокаутированными генами» [13].
Подробное обсуждение этих данных было представлено 1 сентября 2004 г. Ronald С. Kahn на 12-м Международном эндокринологическом конгрессе в Лиссабоне в пленарной лекции «Дальнейшие исследования патогенеза диабета на животных с нокаутированными генами» [13].
При ликвидации, например, гена рецептора инсулина только в мышечной ткани, скорее всего, можно было ожидать развития сахарного диабета, поскольку мышцы являются основными потребителями глюкозы, и прекращение этого процесса должно было бы вызвать гипергликемию. Однако концентрации глюкозы и инсулина в крови при отсутствии рецептора инсулина в мышцах сохраняются на нормальном уровне, и у животных не проявляются никакие другие нарушения углеводного обмена [5, 13]. Создается впечатление, что когда глюкоза теряет способность проникать в мышечные ткани, мышцы просто переключаются с использования углеводов на потребление жирных кислот в качестве основного источника энергии. Поэтому, когда действие инсулина нарушается только в мышцах, а его регуляция углеводного обмена во всех других тканях сохраняется, животные выглядят вполне нормальными, правда, с некоторыми отклонениями.
Инсулин, как известно, относится к небольшой группе гормонов, которые в отличие от многих других оказывают не жиромобилизующее, а липогенное действие, т. е. инсулин стимулирует не распад, а синтез жиров в организме. Поэтому у животных с нокаутированным геном инсулинового рецептора только в мышцах сохраняется нормальная чувствительность печени и жировой ткани к действию инсулина. Под действием инсулина циркулирующая глюкоза свободно проникает в печень и жировую ткань, где подвергается обычному обмену, но поскольку она поступает в эти органы в избытке из-за неспособности мышц использовать глюкозу в энергетическом обмене, большая ее часть трансформируется в жирные кислоты и накапливается в форме триглицеридов. Распад жиров увеличивает поступление жирных кислот в кровь, повышает их концентрацию и способствует активному использованию жиров мышцами в энергетическом обмене [5, 13].
Ожирение у таких животных отличается некоторыми особенностями. Оно выражается не в гипертрофии, т. е. в увеличении размеров клеток, а в гиперплазии адипоцитов, т. е. в возрастании их количества, что сохраняет нормальную (сниженную) секрецию ими лептина, и концентрация лептина в крови не повышается, как обычно при ожирении, а остается в пределах нормы. С другой стороны, жировые клетки увеличивают секрецию адипонекти- на, который стимулирует чувствительность тканей к действию инсулина и препятствует развитию диабета [13].
в увеличении размеров клеток, а в гиперплазии адипоцитов, т. е. в возрастании их количества, что сохраняет нормальную (сниженную) секрецию ими лептина, и концентрация лептина в крови не повышается, как обычно при ожирении, а остается в пределах нормы. С другой стороны, жировые клетки увеличивают секрецию адипонекти- на, который стимулирует чувствительность тканей к действию инсулина и препятствует развитию диабета [13].
Сформировавшийся фенотип напоминает состояние предиабета у человека, при котором у мышц также снижается способность использовать углеводы в энергетическом обмене, и они переключаются на обмен жиров, что стимулирует биосинтез жирных кислот в печени и увеличивает накопление жировых запасов во всем теле при отсутствии других нарушений, свойственных сахарному диабету.
Иная картина развивается после нокаутирования гена рецептора инсулина в печени. При дефиците рецептора в этом органе развивается тяжелая форма инсулинорезистентности, увеличивается концентрация циркулирующего инсулина и нарушается толерантность к глюкозе [5, 9, 13]. Поскольку в печени отсутствует рецептор, инсулин теряет способность стимулировать поступление глюкозы — основного питательного продукта — в печень, что замедляет ее рост, уменьшает размеры и приводит к нарушению нормальной функции. Поэтому развитие невосприимчивости печени к действию инсулина вызывает более существенные изменения углеводного обмена, близкие к тем, которые наблюдаются при сахарном диабете, чем аналогичные повреждения гена рецептора инсулина в мышечной ткани.
Поскольку в печени отсутствует рецептор, инсулин теряет способность стимулировать поступление глюкозы — основного питательного продукта — в печень, что замедляет ее рост, уменьшает размеры и приводит к нарушению нормальной функции. Поэтому развитие невосприимчивости печени к действию инсулина вызывает более существенные изменения углеводного обмена, близкие к тем, которые наблюдаются при сахарном диабете, чем аналогичные повреждения гена рецептора инсулина в мышечной ткани.
Интересные и совсем неожиданные результаты получены после ликвидации гена инсулинового рецептора в жировой ткани, которая сама является эндокринным органом и секретирует в кровь гормоны, влияющие на чувствительность органов к действию инсулина. Кроме лептина, жировая ткань вырабатывает адипонектин, повышенная секреция которого увеличивает чувствительность к действию инсулина и повышает эффективность его гормональной регуляции. Поэтому лептин и адипонектин являются важными факторами нормальной регуляции углеводного обмена и других физиологических функций инсулином. При отсутствии рецептора инсулина в жировой ткани у животных наблюдается значительное (более чем вдвое) уменьшение жировых запасов. Подобные изменения вполне ожидаемы, поскольку в отсутствие рецептора инсулин теряет способность стимулировать поступление глюкозы в жировую ткань, уменьшает ее трансформацию в липиды и снижает накопление жиров в подкожной жировой клетчатке. Даже при искусственной стимуляции потребления пищи, когда животные начинают много есть, не происходит заметного увеличения массы тела. У них сохраняется нормальная толерантность к глюкозе и не наблюдается других нарушений обмена веществ. Поразительно, но нокаутирование гена рецептора инсулина в жировой ткани оказывает положительное и благоприятное воздействие. У подопытных животных снижается смертность и увеличивается продолжительность жизни [13]. Если половина интактных особей обычно умирают в возрасте 30 мес, то через такой же промежуток времени более 80% подопытных животных, у которых отсутствует рецептор инсулина в жировой ткани, продолжают жить.
При отсутствии рецептора инсулина в жировой ткани у животных наблюдается значительное (более чем вдвое) уменьшение жировых запасов. Подобные изменения вполне ожидаемы, поскольку в отсутствие рецептора инсулин теряет способность стимулировать поступление глюкозы в жировую ткань, уменьшает ее трансформацию в липиды и снижает накопление жиров в подкожной жировой клетчатке. Даже при искусственной стимуляции потребления пищи, когда животные начинают много есть, не происходит заметного увеличения массы тела. У них сохраняется нормальная толерантность к глюкозе и не наблюдается других нарушений обмена веществ. Поразительно, но нокаутирование гена рецептора инсулина в жировой ткани оказывает положительное и благоприятное воздействие. У подопытных животных снижается смертность и увеличивается продолжительность жизни [13]. Если половина интактных особей обычно умирают в возрасте 30 мес, то через такой же промежуток времени более 80% подопытных животных, у которых отсутствует рецептор инсулина в жировой ткани, продолжают жить. Абсурд, но получается, что нарушение действия инсулина на жировую ткань при сохранении его активности в других органах даже полезно, оказывает положительное действие и увеличивает жизнеспособность организма.
Абсурд, но получается, что нарушение действия инсулина на жировую ткань при сохранении его активности в других органах даже полезно, оказывает положительное действие и увеличивает жизнеспособность организма.
Более слабые изменения наблюдаются после нокаутирования гена инсулинового рецептора в эндотелиальных клетках. Первоначально предполагалось, что нарушение функции эндотелия и потеря им чувствительности к действию инсулина должны были препятствовать проникновению глюкозы и нарушать транспорт сахаров через сосудистую стенку. Однако проведенные исследования такое предположение не подтвердили. Уровни инсулина и глюкозы в крови при отсутствии рецептора инсулина в эндотелии остаются нормальными. По внешнему виду и другим показателям, таким как продолжительность жизни, репродукция, функция кровеносной системы, экспериментальные животные не отличаются от здоровых особей. Самое заметное их отличие выражается в снижение в 2 раза уровня циркулирующего фактора роста эндотелия сосудов, секреция которого в нормальных условиях стимулируется инсулином, а уменьшение его концентрации способствует торможению васкуляризации и препятствует развитию ретинопатии, ангиопатии и других сосудистых осложнений, обычно наблюдаемых при сахарном диабете вследствие избыточного введения экзогенного инсулина [13].
Новым чувствительным к действию инсулина органом является мозг, в который глюкоза способна проникать и подвергаться нормальному обмену даже в отсутствие инсулина. Тем не менее ген рецептора инсулина активно экспрессируется в нейронах и участвует в регуляции роста и дифференцировки нервных тканей, а нарушение функции инсулинового рецептора в мозге приводит у человека к нервно-дегенеративным заболеваниям типа болезни Паркинсона. Интересно, что в гипоталамусе ген рецептора экспрессируется в тех же клетках, где синтезируется рецептор лептина, и в действиях двух гормонов (инсулина и лептина) на мозг обнаруживается много общего. Оба гормона стимулируют экспрессию гена ПОМК и снижают экспрессию гена белка, родственного белку Агути, вызывая, таким образом, снижение чувства голода и уменьшение потребления пищи. Естественно, что после нокаутирования гена рецептора инсулина в мозге блокируется проведение гормонального сигнала инсулина в гипоталамусе, у животных повышается аппетит, они начинают потреблять больше пищи и набирают массу. У них развиваются некоторые проявления инсулинорезистентности и повышается концентрация циркулирующего инсулина, но при сохранении действия инсулина на другие ткани сахарный диабет у них не развивается [13].
У них развиваются некоторые проявления инсулинорезистентности и повышается концентрация циркулирующего инсулина, но при сохранении действия инсулина на другие ткани сахарный диабет у них не развивается [13].
Специальные опыты показывают, что ген рецептора инсулина активно экспрессируется не только в нейронах, но и в р-клетках поджелудочной железы. Поэтому р-клетки, которые секретируют инсулин в кровь, в то же время сами являются мишенью действия инсулина. При отсутствии рецептора инсулин теряет способность стимулировать проникновение глюкозы в р-клетки, в результате чего задерживается рост р-клеток, блокируется возрастание секреции инсулина в ответ на гипергликемию и изменяется общая регуляция углеводного обмена. У животных нарушается толерантность к глюкозе, у 20% таких особей развивается сахарный диабет.
Интересно, что эти данные, впервые полученные на экспериментальных животных, подтверждаются исследованиями на человеке, проведение которых представляет значительные трудности. Тем не менее они были выполнены, и экспрессия гена инсулинового рецептора в р-клетках пациентов, страдающих сахарным диабетом 2-го типа, оказалась на 75% сниженной по сравнению с экспрессией этого гена у здоровых лиц [13]. Рассмотренные результаты убедительно показывают, что у человека определенные формы диабета могут развиваться в результате потери чувствительности р- клеток к действию инсулина, которая приводит к уменьшению способности р-клеток поглощать глюкозу и реагировать адекватным повышением секреции инсулина в ответ на развивающуюся гипергликемию.
Тем не менее они были выполнены, и экспрессия гена инсулинового рецептора в р-клетках пациентов, страдающих сахарным диабетом 2-го типа, оказалась на 75% сниженной по сравнению с экспрессией этого гена у здоровых лиц [13]. Рассмотренные результаты убедительно показывают, что у человека определенные формы диабета могут развиваться в результате потери чувствительности р- клеток к действию инсулина, которая приводит к уменьшению способности р-клеток поглощать глюкозу и реагировать адекватным повышением секреции инсулина в ответ на развивающуюся гипергликемию.
Заключительные замечания
Рассмотренные результаты исследования молекулярной генетики сахарного диабета вселяют определенную надежду на близкий прогресс в решении этой проблемы и предвещают возможный сдвиг ее с «мертвой точки». Нахождение исследований сахарного диабета в состоянии «мертвой точки» подтверждается тем, что рост количества таких больных во всем мире незначительно отстает от роста числа научно-исследовательских учреждений и количества ученых, занятых изучением этой проблемы.
Тем не менее последние достижения современной эндокринологии позволяют по-новому взглянуть на особенности развития этой науки в наши дни, и начало нового столетия отмечается выдающимися достижениями медико-биологической науки. В качестве примеров можно привести расшифровку полной нуклеотидной последовательности генома человека, достижения в изучении трансгенных животных и клонировании живых организмов, включая клонирование млекопитающих. Заслуживают также внимания успехи в исследовании стволовых клеток и их использовании для лечения некоторых форм патологии и т. д. Сегодня появляются специалисты, которые считают, что если прошлое столетие было веком физики, то наступившее вполне может стать веком биологии и медицины [10]. Предсказывать, как будут развиваться медикобиологические науки в будущем, — довольно неблагодарное занятие. История и наука, как правило, потешаются над подобными прогнозами ученых и очень часто их опровергают. Одно из таких предсказаний, когда-то очень популярное, звучало так: «один ген — один фермент», но от него в результате успешного развития науки практически ничего не осталось.
Поэтому нет необходимости предсказывать, что произойдет с биологией в наступившем столетии. Скорее всего, с ней произойдет то же, что случилось с физикой в прошлом веке. Физика, как известно, началась с исследований Резерфорда электронов и структуры атома, в которых активное участие принимал российский ученый Петр Капица. В конечном итоге достижения физики воплотились в радио и телевидение, атомные и водородные бомбы, межконтинентальные баллистические ракеты и полеты в космос, компьютеры и Интернет, мобильную связь и многое другое, что прочно вошло в наш быт, жизнь и работу [4]. В медицине и биологии они воплотились в компьютерные томографы, УЗИ, искусственные органы и автоматические секвенаторы аминокислотных и нуклеотидных последовательностей. Нечто подобное можно ожидать при успешном развитии медико-биологических наук в наступившем веке, а во что это воплотится конкретно, покажет будущее.
Гормоны поджелудочной железы | Endocrine Society
Основной функцией поджелудочной железы является поддержание здорового уровня сахара в крови. Это большая железа, расположенная за желудком. Он вырабатывает инсулин, глюкагон и другие гормоны. Диабет возникает, когда поджелудочная железа не вырабатывает достаточного количества инсулина или когда организм не использует инсулин должным образом (так называемая резистентность к инсулину).
Это большая железа, расположенная за желудком. Он вырабатывает инсулин, глюкагон и другие гормоны. Диабет возникает, когда поджелудочная железа не вырабатывает достаточного количества инсулина или когда организм не использует инсулин должным образом (так называемая резистентность к инсулину).
Глюкагон
Глюкагон — это гормон, который работает с другими гормонами и функциями организма для контроля уровня глюкозы в крови. Он происходит из альфа-клеток поджелудочной железы и тесно связан с бета-клетками, секретирующими инсулин, что делает его важным компонентом, поддерживающим стабильный уровень глюкозы в крови.
В то время как глюкагон предотвращает слишком низкое падение уровня глюкозы в крови, инсулин вырабатывается для предотвращения слишком высокого повышения уровня глюкозы в крови. Два гормона уравновешивают друг друга, стабилизируя уровень глюкозы в крови. Когда уровень глюкозы в крови падает слишком низко (низкий уровень глюкозы в крови), поджелудочная железа вырабатывает больше глюкагона. Этот гормон помогает поднять уровень глюкозы в крови несколькими способами: (Этот процесс называется гликогенолизом.)
Этот гормон помогает поднять уровень глюкозы в крови несколькими способами: (Этот процесс называется гликогенолизом.)
Когда все работает хорошо, инсулин перемещает глюкозу из крови в клетки, где она используется для получения энергии. Между тем, сложная система обратной связи в организме сообщает ему, когда глюкагон больше не нужен. Короче говоря, глюкагон обычно предотвращает слишком низкое падение уровня глюкозы в крови. Инсулин не дает ему подняться слишком высоко. Два гормона уравновешивают друг друга.
Возможные проблемы с функцией глюкагона
Функция глюкагона имеет решающее значение для надлежащего уровня глюкозы в крови, поэтому проблемы с выработкой глюкагона приведут к проблемам с уровнем глюкозы. Низкий уровень глюкагона встречается редко, но иногда наблюдается у младенцев. Основным результатом является низкий уровень глюкозы в крови. Лечение заключается во введении пациенту глюкагона. Когда человек достаточно выздоровел, употребление углеводов еще больше повысит уровень глюкозы в крови.
Основным результатом является низкий уровень глюкозы в крови. Лечение заключается во введении пациенту глюкагона. Когда человек достаточно выздоровел, употребление углеводов еще больше повысит уровень глюкозы в крови.
Высокие уровни глюкагона также редки, но могут возникать, когда у пациента развивается определенный тип опухоли в поджелудочной железе. У пациентов с высоким уровнем глюкагона может развиться сахарный диабет или возникнуть неожиданная потеря веса.
Гипогликемия и глюкагон
Легкий случай гипогликемии может вызвать дрожь, головную боль, потливость, липкую кожу или учащенное сердцебиение. Уровень глюкозы в крови падает до 54–69 мг/дл. Легкую гипогликемию обычно можно лечить, употребляя 15 граммов быстродействующих источников сахара, таких как фруктовый сок, недиетическая газировка, леденцы или таблетки глюкозы.
Если гипогликемия становится тяжелой, вы не сможете безопасно глотать пищу или питье. К этому моменту уровень глюкозы в крови составляет менее 54 мг/дл, часто ниже 40 мг/дл. Вы можете чувствовать себя сбитым с толку, потерять сознание или у вас может случиться припадок. Без своевременного лечения тяжелая гипогликемия может привести к коме или даже смерти.
Вы можете чувствовать себя сбитым с толку, потерять сознание или у вас может случиться припадок. Без своевременного лечения тяжелая гипогликемия может привести к коме или даже смерти.
К счастью, тяжелую гипогликемию у человека с диабетом можно лечить с помощью рецептурного глюкагона. Кому-то другому, вероятно, потребуется ввести глюкагон, но этот человек не обязательно должен быть медицинским работником. Родственники, друзья, коллеги и другие лица могут научиться давать глюкагон.
Типы неотложной помощи Глюкагон
Набор для инъекций : Традиционный набор для инъекций содержит флакон с порошком (глюкагоном) и шприц, наполненный физиологическим раствором (соленой водой).
Ручка-автоинжектор : предварительно смешанная, готовая к использованию доза глюкагона. Он похож на EpiPen, используемый для лечения серьезных аллергических реакций.
Сухой назальный спрей : (безыгольная) форма глюкагона в виде порошка для носа. Он использует поршень для распыления в нос, как обычный назальный спрей.
Он использует поршень для распыления в нос, как обычный назальный спрей.
Что происходит после дозы глюкагона?
Если вы потеряли сознание из-за тяжелой гипогликемии, обычно вы приходите в сознание в течение 15 минут после приема глюкагона. Когда вы проснетесь и сможете глотать, ваш помощник должен дать вам быстродействующий источник сахара. После этого съешьте источник сахара длительного действия, например крекеры с сыром или бутерброд с мясом. Кроме того, немедленно позвоните своему врачу. У вашего врача могут быть дополнительные рекомендации по лечению.
Если вы остаетесь без сознания в течение 15 минут после введения глюкагона, ваш помощник должен ввести еще одну дозу глюкагона и позвонить по номеру 911. Ваш помощник также должен позвонить по номеру 911, если вы проснулись, но все еще в замешательстве.
Побочные эффекты экстренного лечения глюкагоном
Возможные побочные эффекты лечения глюкагоном включают:
- Тошнота и рвота
- Головная боль
- Временное увеличение частоты сердечных сокращений
- Покраснение и припухлость в месте инъекции.

Для назального глюкагона дополнительные побочные эффекты могут включать:
- Насморк или заложенность носа
- Красные или слезящиеся глаза
- Зуд в носу, глазах или горле
Если вы боретесь с контролем уровня сахара в крови или хронически низким уровнем сахара в крови, причиной вашей проблемы может быть ряд факторов. Поговорите со своим врачом о глюкагоне и о том, может ли он быть фактором. Попробуйте спросить:
- Какие методы лечения и изменения образа жизни могут помочь справиться с моим диабетом?
- Влияет ли глюкагон на уровень сахара в крови?
- Что я могу сделать, чтобы повысить уровень глюкагона?
- Каким должен быть мой целевой диапазон уровня глюкозы в крови?
- Как лучше контролировать уровень сахара в крови?
- Что я могу сделать, чтобы повысить осведомленность о низком уровне глюкозы в крови?
- Как лечить легкую гипогликемию, чтобы она не стала тяжелой?
- Нужен ли рецепт на глюкагон? Если да, то какой продукт лучше всего подходит для моих нужд?
- Где люди из моей сети поддержки могут пройти обучение по тому, как давать глюкагон?
Инсулин незаменим
Необходимый для жизни гормон инсулин регулирует многие метаболические процессы, которые обеспечивают клетки необходимой энергией. Понимание инсулина, того, что инсулин делает и как он влияет на организм, важно для вашего общего состояния здоровья. За желудком спрятан орган под названием поджелудочная железа, который вырабатывает инсулин. Производство инсулина регулируется в зависимости от уровня сахара в крови и других гормонов в организме. У здорового человека выработка и высвобождение инсулина — строго регулируемый процесс, позволяющий организму сбалансировать свои метаболические потребности.
Понимание инсулина, того, что инсулин делает и как он влияет на организм, важно для вашего общего состояния здоровья. За желудком спрятан орган под названием поджелудочная железа, который вырабатывает инсулин. Производство инсулина регулируется в зависимости от уровня сахара в крови и других гормонов в организме. У здорового человека выработка и высвобождение инсулина — строго регулируемый процесс, позволяющий организму сбалансировать свои метаболические потребности.
Что делает инсулин?
Инсулин позволяет клеткам мышц, жира и печени поглощать глюкозу, находящуюся в крови. Глюкоза служит источником энергии для этих клеток или при необходимости может быть преобразована в жир. Инсулин также влияет на другие метаболические процессы, такие как расщепление жира или белка.
Проблемы с производством или использованием инсулина
Наиболее распространенной проблемой, связанной с инсулином, является диабет. Диабет возникает, когда организм либо не выделяет достаточного количества инсулина, либо когда организм больше не использует выделяемый им инсулин эффективно. Диабет делится на две категории:
Диабет делится на две категории:
Диабет 1 типа возникает, когда поджелудочная железа не может вырабатывать инсулин в количестве, необходимом для удовлетворения собственных потребностей. Это обычно происходит у детей, и хотя точная причина не найдена, многие считают это аутоиммунным заболеванием. Некоторые симптомы диабета 1 типа включают усталость, учащенное мочеиспускание и жажду, а также проблемы со зрением.
Диабет 2 типа чаще всего связан с поведением взрослых и образом жизни. У людей с диабетом 2 типа инсулин вырабатывается, но часто его недостаточно для удовлетворения потребностей организма. Им также может быть трудно эффективно использовать инсулин, который они производят. Пациенты могут не знать, что у них диабет 2 типа, до тех пор, пока они не проходят ежегодное обследование, поскольку симптомы, как правило, слабо выражены, пока болезнь не станет тяжелой.
Когда организм не вырабатывает достаточного количества инсулина или не использует его эффективно, в организме повышается уровень сахара в крови. Также клетки организма не получают из глюкозы необходимую им энергию, поэтому больной может бороться с усталостью. Когда тело обращается к другим тканям, таким как жир или мышцы, для получения энергии, может произойти потеря веса.
Также клетки организма не получают из глюкозы необходимую им энергию, поэтому больной может бороться с усталостью. Когда тело обращается к другим тканям, таким как жир или мышцы, для получения энергии, может произойти потеря веса.
Высокий уровень сахара в крови является распространенным симптомом диабета, но пациенты, лечащие диабет с помощью инъекций инсулина, могут иногда вводить слишком много инсулина. Это заставляет клетки организма брать слишком много глюкозы из крови, что приводит к эпизоду низкого уровня сахара в крови. Низкий уровень сахара в крови может вызвать спутанность сознания, головокружение и обмороки. Поскольку нервные клетки полностью зависят от глюкозы в качестве источника энергии, низкий уровень сахара в крови также может вызвать реакцию нервной системы.
Если вы подозреваете, что у вас проблемы с уровнем и выработкой инсулина, ваш лечащий врач может проверить уровень инсулина с помощью анализа крови на A1c. Если у вас диагностирован диабет, вам потребуется медицинское наблюдение, чтобы справиться с этим заболеванием. Попробуйте спросить:
Попробуйте спросить:
- Как я могу контролировать уровень сахара и инсулина в крови?
- Какой тип мониторинга мне нужен?
- Какие изменения образа жизни могут сделать уровень сахара в крови более стабильным?
- Как я могу предотвратить развитие диабета, если я подвержен риску, но у меня не развилось заболевание?
Вернуться к гормонам и эндокринной функции>>>
Редакторы: Рамон Мартинес, доктор медицины
Последнее обновление:
Что это такое, функция и симптомы
Что такое глюкагон?
Глюкагон — это естественный гормон, вырабатываемый вашим организмом, который взаимодействует с другими гормонами и функциями организма для контроля уровня глюкозы (сахара) в крови. Глюкагон предотвращает слишком низкое падение уровня сахара в крови. Альфа-клетки в вашей поджелудочной железе вырабатывают глюкагон и выделяют его в ответ на падение уровня сахара в крови, длительное голодание, физические упражнения и прием пищи, богатой белком.
Гормоны — это химические вещества, которые координируют различные функции в вашем теле, передавая сообщения через вашу кровь к вашим органам, коже, мышцам и другим тканям. Эти сигналы сообщают вашему телу, что и когда делать.
Поджелудочная железа — это железистый орган в брюшной полости, который выделяет несколько ферментов, способствующих пищеварению, и несколько гормонов, включая глюкагон и инсулин. Он окружен вашим желудком, кишечником и другими органами.
Глюкоза — это основной сахар, содержащийся в крови. Вы получаете глюкозу из углеводов в пище, которую едите. Этот сахар является важным источником энергии и обеспечивает питательными веществами органы, мышцы и нервную систему вашего тела. Глюкоза очень важна, потому что это основной источник энергии для вашего мозга.
В организме обычно есть сложная система, обеспечивающая оптимальный уровень сахара в крови. Если у вас слишком много или слишком мало глюкозы в крови, это может вызвать определенные симптомы и осложнения.
Инъекции глюкагона и назальные спреи
Существует также синтетическая форма глюкагона, которую можно вводить в виде инъекций или назального порошка (сухой назальный спрей). Люди с диабетом 1 типа в основном используют эту форму глюкагона в экстренных ситуациях, когда у них очень низкий уровень сахара в крови. Синтетический глюкагон заставляет печень высвобождать накопленную глюкозу, которая затем повышает уровень сахара в крови.
Какова функция глюкагона?
В норме ваш организм тщательно регулирует уровень глюкозы (сахара) в крови, главным образом, с помощью гормонов глюкагона и инсулина. Когда уровень глюкозы в крови снижается или падает слишком низко (гипогликемия), поджелудочная железа выделяет больше глюкагона. Глюкагон помогает восстановить уровень глюкозы в крови несколькими способами, в том числе:
- Глюкагон заставляет печень преобразовывать сохраненную глюкозу (гликоген) в пригодную для использования форму, а затем высвобождать ее в кровоток.
 Этот процесс называется гликогенолизом.
Этот процесс называется гликогенолизом. - Глюкагон также может препятствовать тому, чтобы ваша печень поглощала и хранила глюкозу, поэтому в крови оставалось больше глюкозы.
- Глюкагон помогает вашему организму вырабатывать глюкозу из других источников, таких как аминокислоты.
Если уровень глюкозы в крови повышается, поджелудочная железа вырабатывает инсулин, чтобы вернуть его в норму.
В чем разница между глюкагоном и инсулином?
Глюкагон и инсулин являются важными гормонами, играющими важную роль в регулировании уровня глюкозы (сахара) в крови. Оба гормона вырабатываются поджелудочной железой — альфа-клетки поджелудочной железы производят и выделяют глюкагон, а бета-клетки поджелудочной железы производят и выделяют инсулин.
Разница заключается в том, как эти гормоны способствуют регулированию уровня сахара в крови. Глюкагон повышает уровень сахара в крови, тогда как инсулин снижает уровень сахара в крови. Если ваша поджелудочная железа не вырабатывает достаточно инсулина или ваше тело не использует его должным образом, у вас может быть высокий уровень сахара в крови (гипергликемия), что приводит к диабету.
В чем разница между глюкагоном и гликогеном?
Глюкагон и гликоген — это не одно и то же. Гликоген представляет собой запасную форму глюкозы (сахара). Ваше тело в основном хранит гликоген в печени и мышцах.
Глюкагон — это гормон, который заставляет гликоген печени снова превращаться в глюкозу и поступать в кровоток, чтобы организм мог использовать его для получения энергии.
Какие тесты могут проверить уровень глюкагона?
Медицинские работники обычно не назначают тесты на уровень глюкагона людям с диабетом, но они могут назначить тест для диагностики некоторых редких эндокринных заболеваний.
Ваш врач может назначить анализ крови на глюкагон для измерения уровня глюкагона, если у вас есть определенные симптомы. Во время теста медицинский работник возьмет образец крови из вашей вены с помощью иглы. Затем они отправят его в лабораторию для тестирования.
Каков нормальный уровень глюкагона?
Нормальные значения глюкагона могут варьироваться от лаборатории к лаборатории и в зависимости от продолжительности голодания и уровня глюкозы в крови.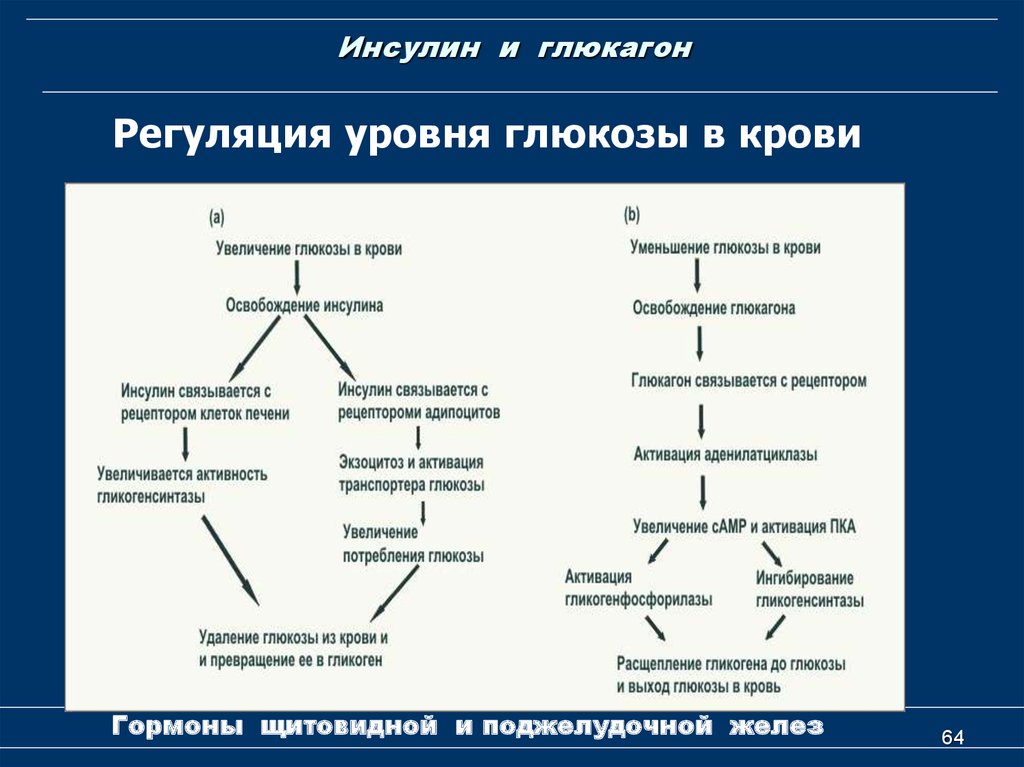 Всегда сравнивайте свои результаты с референтным диапазоном, указанным в вашем отчете о анализе крови, и обращайтесь к своему лечащему врачу, если у вас есть вопросы.
Всегда сравнивайте свои результаты с референтным диапазоном, указанным в вашем отчете о анализе крови, и обращайтесь к своему лечащему врачу, если у вас есть вопросы.
Обычно нормальный уровень глюкагона в крови составляет от 50 до 100 пикограмм на миллилитр (пг/мл). Пикограмм – это одна триллионная часть грамма.
У людей с диабетом может развиться неспособность выделять достаточное количество глюкагона в ответ на снижение уровня глюкозы в крови. Из-за этого у них с большей вероятностью может развиться частый низкий или очень низкий уровень сахара в крови, если они принимают лекарства, которые могут вызвать низкий уровень сахара в крови, особенно синтетический инсулин и препараты класса сульфонилмочевины.
У людей с диабетом 2 типа уровень глюкагона может быть относительно выше, чем считается нормальным, исходя из уровня глюкозы в крови. Это может способствовать повышению уровня сахара в крови.
Проблемы с продукцией глюкагона вне диабета встречаются редко, а некоторые встречаются редко.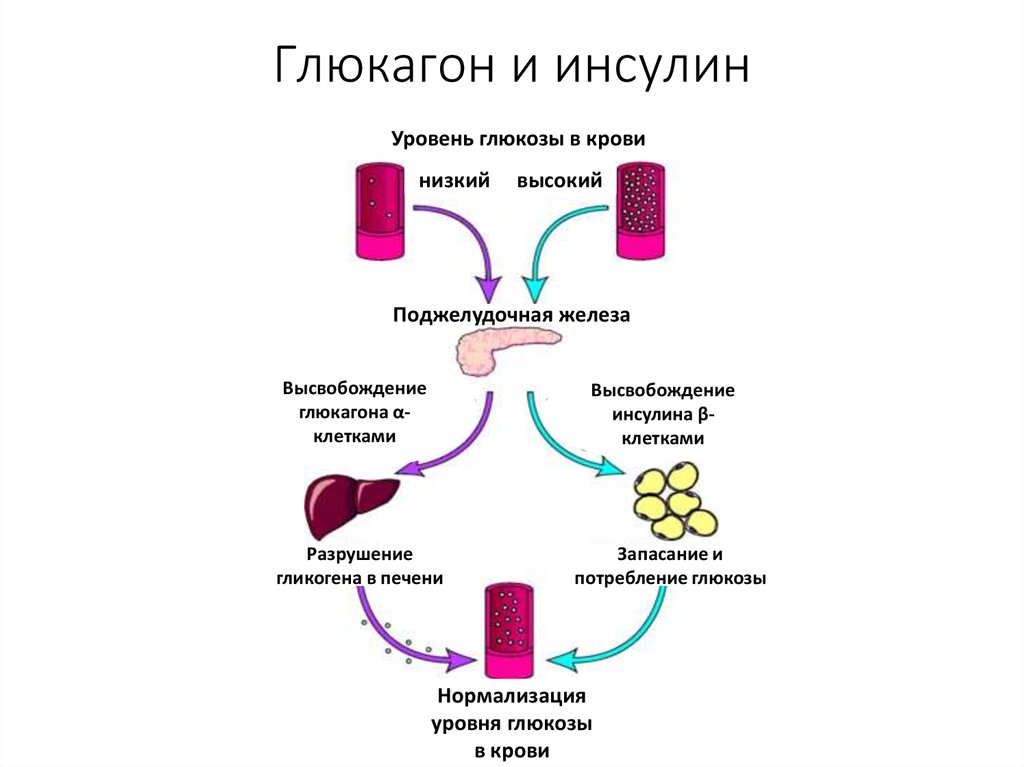 Следующие состояния могут повлиять или повлиять на вашу функцию глюкагона:
Следующие состояния могут повлиять или повлиять на вашу функцию глюкагона:
- Панкреатит : У людей, у которых развивается воспаление поджелудочной железы (панкреатит), могут возникать некоторые осложнения. Одним из них является повреждение клеток, вырабатывающих глюкагон и инсулин. Недостаток инсулина может привести к диабету. Если у вас развился диабет из-за панкреатита и вы принимаете синтетический инсулин для лечения, вы подвергаетесь более высокому риску развития низкого уровня сахара в крови из-за неспособности вашей поджелудочной железы вырабатывать и выделять достаточное количество глюкагона.
- Глюкагонома : Это очень редкая опухоль поджелудочной железы, которая выделяет избыточное количество глюкагона. Он вызывает определенные симптомы, в том числе высокий уровень сахара в крови, кожную сыпь, называемую некротизирующей мигрирующей эритемой, потерю веса, легкий диабет, анемию, воспаленный и болезненный рот (стоматит) и опухший язык (глоссит).

- Множественная эндокринная неоплазия : Это редкое генетическое заболевание, при котором у вас есть опухоли более чем в одной из желез эндокринной системы, включая поджелудочную железу. Поскольку у вас может развиться опухоль в поджелудочной железе, это состояние потенциально может повлиять на уровень глюкагона.
- Цирроз печени : Цирроз — это заболевание печени на поздней стадии, при котором здоровая ткань печени заменяется рубцовой тканью. Рубцовая ткань препятствует нормальной работе печени. Поскольку ваше тело хранит много глюкозы в печени, а глюкагон высвобождает эту запасенную глюкозу в печени, цирроз может помешать правильной работе глюкагона вашего организма. Это может относиться и к другим редким заболеваниям печени.
- Побочный эффект панкреатэктомии : Люди, которым необходимо частично или полностью удалить поджелудочную железу (панкреатэктомия), потеряют часть или все клетки, высвобождающие глюкагон и инсулин, что может повлиять на способность организма использовать глюкагон.

В зависимости от ситуации и состояния вы можете испытывать низкий и/или высокий уровень сахара в крови из-за аномального уровня глюкагона.
Симптомы низкого уровня сахара в крови (гипогликемия)
Признаки и симптомы низкого уровня сахара в крови включают:
- Дрожь или дрожь.
- Потливость и озноб.
- Головокружение или предобморочное состояние.
- Более быстрый сердечный ритм.
- Голод.
- Спутанность сознания или проблемы с концентрацией внимания.
- Нервозность или раздражительность.
- Бледная кожа.
- Слабость.
- Покалывание или онемение лица или рта.
Если вы испытываете эти симптомы, важно есть пищу с углеводами/сахаром, чтобы вылечить их и повысить уровень сахара в крови. Если вы часто испытываете эти симптомы, обратитесь к своему лечащему врачу.
Симптомы высокого уровня сахара в крови (гипергликемии)
В то время как высокий уровень сахара в крови чаще всего вызван проблемой недостаточного количества инсулина, а не изолированной проблемой глюкагона, возможно повышение уровня сахара в крови из-за редких проблем с глюкагоном.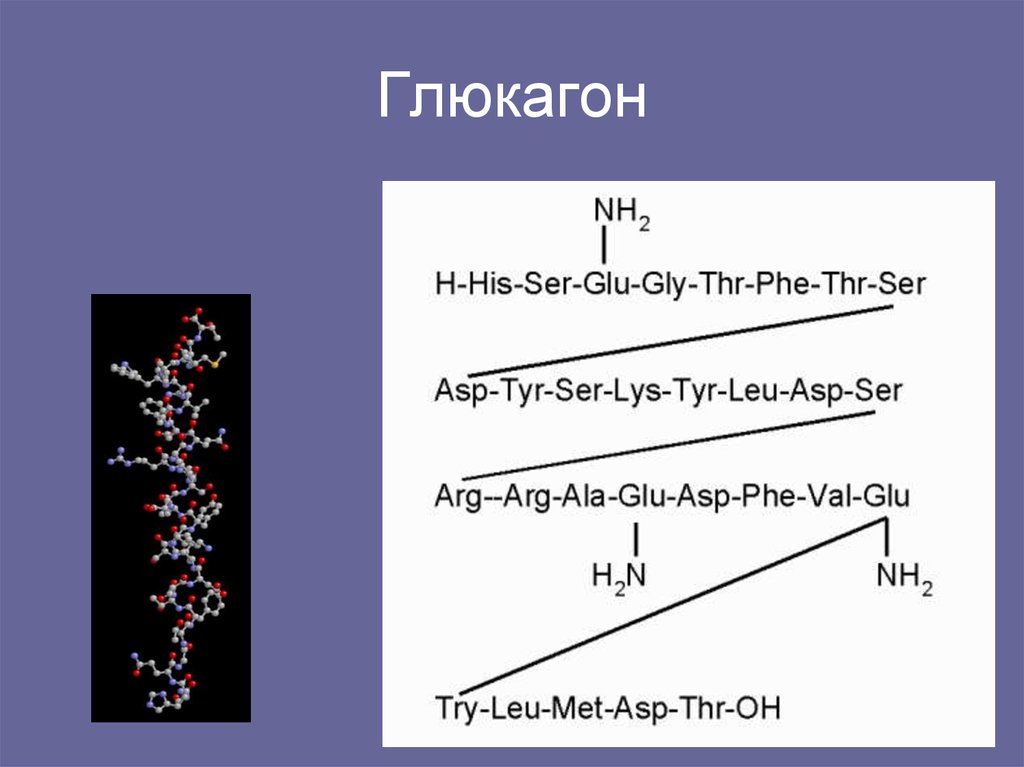 Ранние признаки и симптомы высокого уровня сахара в крови включают:
Ранние признаки и симптомы высокого уровня сахара в крови включают:
- Повышенная жажда и/или голод.
- Затуманенное зрение.
- Частое мочеиспускание.
- Головная боль.
Дополнительные симптомы включают:
- Усталость (чувство слабости и усталости).
- Необъяснимая потеря веса.
- Частые вагинальные дрожжевые инфекции и кожные инфекции.
- Медленно заживающие порезы и язвы.
Если вы испытываете эти симптомы, важно обратиться к врачу.
Когда мне следует обратиться к поставщику медицинских услуг по поводу уровня глюкагона?
Если у вас диабет и у вас частые эпизоды низкого или высокого уровня сахара в крови, важно связаться с вашим лечащим врачом. Уровень глюкагона обычно не измеряется и не контролируется у людей с диабетом, но вашему врачу может потребоваться скорректировать прием лекарств (а иногда и образ жизни), чтобы свести к минимуму эпизоды как низкого, так и высокого уровня сахара в крови.
Хотя другие проблемы с глюкагоном встречаются редко, если у вас есть симптомы, важно выяснить причину. Обратитесь к своему поставщику медицинских услуг.
Записка из клиники Кливленда
Глюкагон — очень важный гормон, который помогает регулировать уровень сахара в крови. Несмотря на то, что не связанные с диабетом проблемы со способностью вашего организма вырабатывать и использовать глюкагон встречаются редко, важно обратиться к врачу, если вы испытываете симптомы низкого или высокого уровня сахара в крови. Они могут провести некоторые тесты, чтобы выяснить, является ли причиной проблема с глюкагоном в вашем организме или что-то еще.
Также важно регулярно посещать врача, если у вас диабет, особенно если вы часто испытываете низкий и/или высокий уровень сахара в крови. Если вы лечите диабет инсулином, убедитесь, что у вас есть экстренный глюкагон на случай серьезного эпизода низкого уровня сахара в крови.
Физиология глюкагона — Endotext — NCBI Bookshelf
РЕФЕРАТ
Глюкагон – это пептидный гормон, секретируемый альфа-клетками островков Лангерганса поджелудочной железы. Гипогликемия является физиологически наиболее мощным секреторным стимулом, и наиболее известным действием глюкагона является стимуляция продукции глюкозы в печени и, таким образом, поддержание адекватных концентраций глюкозы в плазме. Однако глюкагон также участвует в метаболизме липидов и аминокислот в печени и может увеличивать расход энергии в состоянии покоя. Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.
Гипогликемия является физиологически наиболее мощным секреторным стимулом, и наиболее известным действием глюкагона является стимуляция продукции глюкозы в печени и, таким образом, поддержание адекватных концентраций глюкозы в плазме. Однако глюкагон также участвует в метаболизме липидов и аминокислот в печени и может увеличивать расход энергии в состоянии покоя. Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW. ENDOTEXT.ORG.
ENDOTEXT.ORG.
ВВЕДЕНИЕ
Глюкагон, секретируемый альфа-клетками поджелудочной железы в островке Лангерганса, играет важную роль в поддержании гомеостаза глюкозы путем стимуляции продукции глюкозы в печени (1). Таким образом, в отличие от глюкозодепонирующего характера действия инсулина, глюкагон действует как глюкозомобилизующий гормон. В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2).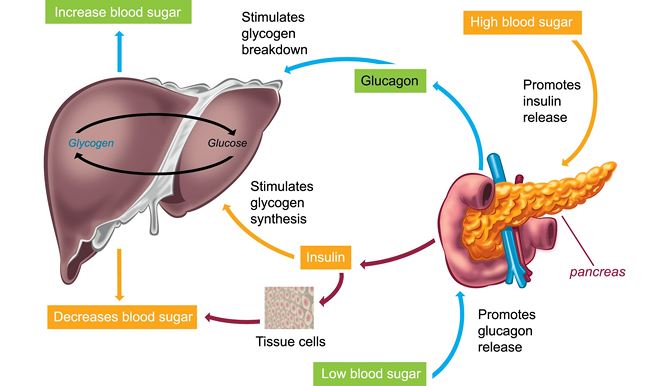 В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5). Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5). Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
СТРУКТУРА И СИНТЕЗ ГЛЮКАГОНА
Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, преимущественно секретируемый альфа-клетками поджелудочной железы. Он получен из предшественника проглюкагона, который может превращаться в ряд родственных пептидных гормонов (12). Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Рисунок 1.
Тканеспецифический процессинг проглюкагона. В поджелудочной железе проглюкагон процессируется в глюкагон, родственный глицентину полипептид поджелудочной железы (GRPP), промежуточный пептид 1 (IP1) и основной фрагмент проглюкагона (MPGF) с помощью фермента процессинга прогормонконвертазы 2 (PC2). В кишечнике и в головном мозге проглюкагон процессируется прогормонконвертазой 1/3 (PC1/3) в глюкагоноподобный пептид 1 (ГПП-1), глюкагоноподобный пептид 2 (ГПП-2), оксинтомодулин, промежуточный пептид 2 ( IP2) и глицентин.
В кишечнике и в головном мозге проглюкагон процессируется прогормонконвертазой 1/3 (PC1/3) в глюкагоноподобный пептид 1 (ГПП-1), глюкагоноподобный пептид 2 (ГПП-2), оксинтомодулин, промежуточный пептид 2 ( IP2) и глицентин.
СЕКРЕЦИЯ ГЛЮКАГОНА
Глюкагон секретируется в ответ на гипогликемию, длительное голодание, физические упражнения и прием пищи, богатой белком (10). Высвобождение глюкагона регулируется эндокринными и паракринными путями; по питательным веществам; и вегетативной нервной системой (11). Секреция глюкагона происходит как экзоцитоз запасенных пептидных везикул, инициируемый секреторными стимулами альфа-клетки. Стимулирующие регуляторы высвобождения глюкагона включают гипогликемию, аминокислоты и глюкозозависимый инсулинотропный пептид (ГИП) гормона кишечника, тогда как гипергликемия и ГПП-1 ингибируют высвобождение глюкагона. Кроме того, высвобождение глюкагона ингибируется паракринным образом такими факторами, как соматостатин, инсулин, цинк и, возможно, амилин. Глюкагон может косвенно регулировать собственную секрецию через стимулирующее действие на бета-клетки, чтобы они секретировали инсулин (12,13). В отличие от глюкозы, неглюкозные регуляторы секреции глюкагона, по-видимому, опосредуют свое действие через изменения уровней цАМФ, а не через кальций-зависимый путь, описанный ниже (14,15).
Глюкагон может косвенно регулировать собственную секрецию через стимулирующее действие на бета-клетки, чтобы они секретировали инсулин (12,13). В отличие от глюкозы, неглюкозные регуляторы секреции глюкагона, по-видимому, опосредуют свое действие через изменения уровней цАМФ, а не через кальций-зависимый путь, описанный ниже (14,15).
Регуляция секреции глюкагона глюкозой
Наиболее мощным регулятором секреции глюкагона является циркулирующая глюкоза. Гипогликемия стимулирует альфа-клетки поджелудочной железы к высвобождению глюкагона, а гипергликемия ингибирует секрецию глюкагона (11). Клеточный механизм этой глюкозозависимой регуляции секреции глюкагона включает поглощение глюкозы переносчиком глюкозы 1 (GLUT1) в клеточной мембране альфа-клеток поджелудочной железы и последующий гликолиз, который в конечном итоге генерирует аденозинтрифосфат (АТФ) в митохондриях альфа-клетки. . Таким образом, уровень внутриклеточного АТФ в альфа-клетке отражает уровень глюкозы в плазме.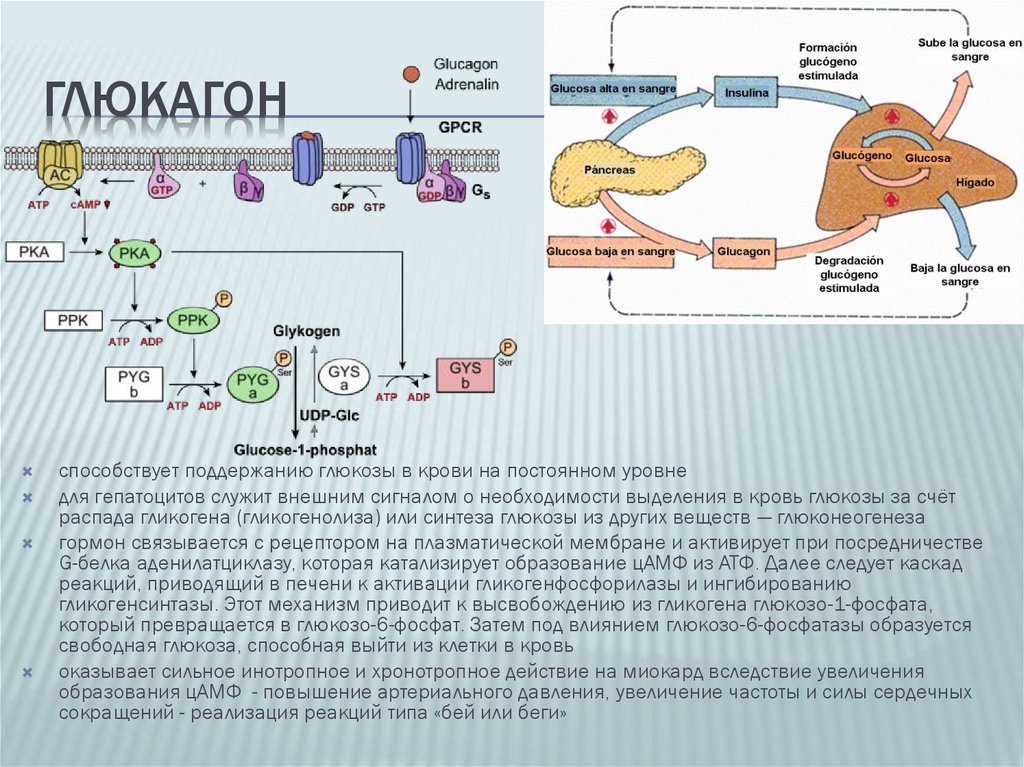 Гипогликемия и, как следствие, низкие внутриклеточные уровни АТФ в альфа-клетках закрывают АТФ-чувствительные калиевые каналы (K ATP -каналы), в результате чего отток калия (K + ) снижается. Это вызывает деполяризацию клеточной мембраны, которая, в свою очередь, открывает потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Гипогликемия и, как следствие, низкие внутриклеточные уровни АТФ в альфа-клетках закрывают АТФ-чувствительные калиевые каналы (K ATP -каналы), в результате чего отток калия (K + ) снижается. Это вызывает деполяризацию клеточной мембраны, которая, в свою очередь, открывает потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Рисунок 2.
Глюкозозависимая секреция глюкагона альфа-клеткой. При гипогликемии концентрация внутриклеточной глюкозы падает с последующим снижением гликолиз-генерируемого аденозинтрифосфата (АТФ) в митохондриях клетки. Это закрывает АТФ-чувствительный калий (K + ) и внутриклеточная концентрация K + повышается, что деполяризует клеточную мембрану, таким образом открывая потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Это закрывает АТФ-чувствительный калий (K + ) и внутриклеточная концентрация K + повышается, что деполяризует клеточную мембрану, таким образом открывая потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Концентрация глюкагона в кровотоке
В нормальной физиологии концентрация глюкагона в кровотоке находится в пикомолярном диапазоне. В состоянии натощак при уровне глюкозы в плазме около 5 ммоль/л глюкагон секретируется на базальном уровне, что приводит к концентрации в плазме ниже 20 пмоль/л (16–18). Базальная секреция глюкагона уравновешивает эффект базальной секреции инсулина, что приводит к устойчивому состоянию между поглощением глюкозы и эндогенной выработкой глюкозы натощак; то есть стабильные концентрации глюкозы в крови. Во время физической нагрузки или в случае гипогликемии уровень циркулирующего глюкагона может резко увеличиться в 3-4 раза по сравнению с базальным уровнем, увеличивая соотношение глюкагона и инсулина (12,19).,20) ().
Во время физической нагрузки или в случае гипогликемии уровень циркулирующего глюкагона может резко увеличиться в 3-4 раза по сравнению с базальным уровнем, увеличивая соотношение глюкагона и инсулина (12,19).,20) ().
Рисунок 3.
Концентрации глюкагона в ответ на гипогликемию, эугликемию и гипергликемию.
СИГНАЛИЗАЦИЯ РЕЦЕПТОРА ГЛЮКАГОНА
Действие глюкагона опосредовано связыванием и активацией рецептора глюкагона. Рецептор глюкагона представляет собой семь трансмембранных рецепторов, связанных с G-белком (1), преимущественно экспрессируемых в печени, но также обнаруживаемых в различных количествах в почках, сердце (спорно), надпочечниках, жировой ткани (спорно), желудочно-кишечном тракте и поджелудочной железе ( 21). Основной способ внутриклеточной передачи сигналов включает активацию G с и G q . Активация G s стимулирует аденилатциклазу, которая продуцирует циклический аденозинмонофосфат (цАМФ), который активирует протеинкиназу А (ПКА). Активированный PKA мигрирует в ядро и активирует факторы транскрипции, такие как белок, связывающий элемент ответа цАМФ (CREB), посредством фосфорилирования. Это позволяет CREB связываться с ответными элементами генов-мишеней, что приводит к рекрутированию коактиваторов и, в конечном итоге, к экспрессии генов. Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Активированный PKA мигрирует в ядро и активирует факторы транскрипции, такие как белок, связывающий элемент ответа цАМФ (CREB), посредством фосфорилирования. Это позволяет CREB связываться с ответными элементами генов-мишеней, что приводит к рекрутированию коактиваторов и, в конечном итоге, к экспрессии генов. Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Рисунок 4.
Примеры двух наиболее хорошо описанных внутриклеточных путей, участвующих в глюкагон-индуцированной регуляции экспрессии генов-мишеней: путей PKA и IP 3 . AC, аденилатциклаза; CRTC2, коактиватор транскрипции, регулируемый CREB; CREB, белок, связывающий элемент ответа цАМФ; IP 3, инозитол-1,4,5-трифосфат; PIP 2 , фосфатидилинозитол-4,5-бисфосфат; PKA, протеинкиназа А; PLC, фосфолипаза C.
AC, аденилатциклаза; CRTC2, коактиватор транскрипции, регулируемый CREB; CREB, белок, связывающий элемент ответа цАМФ; IP 3, инозитол-1,4,5-трифосфат; PIP 2 , фосфатидилинозитол-4,5-бисфосфат; PKA, протеинкиназа А; PLC, фосфолипаза C.
ДЕГРАДАЦИЯ И ЭЛИМИНАЦИЯ ГЛЮКАГОНА
Разложению глюкагона в основном способствует рецептор-опосредованный эндоцитоз и протеолиз с помощью вездесущего фермента дипептидилпептидазы 4 (22,23). В соответствии с относительной экспрессией рецепторов, печень и почки, по-видимому, представляют собой два основных органа, удаляющих глюкагон из кровообращения. Сообщается, что период полураспада глюкагона в плазме у человека составляет от четырех до семи минут (24, 25).
ДЕЙСТВИЕ ГЛЮКАГОНА
Глюкагон увеличивает выработку глюкозы в печени
Глюкагон регулирует концентрацию глюкозы в плазме во время голодания, физической нагрузки и гипогликемии, увеличивая выход глюкозы печенью в кровоток. В частности, глюкагон способствует превращению гликогена в глюкозу в печени (гликогенолиз), стимулирует синтез глюкозы de novo (глюконеогенез) и ингибирует расщепление глюкозы (гликолиз) и образование гликогена (гликогенез) (26).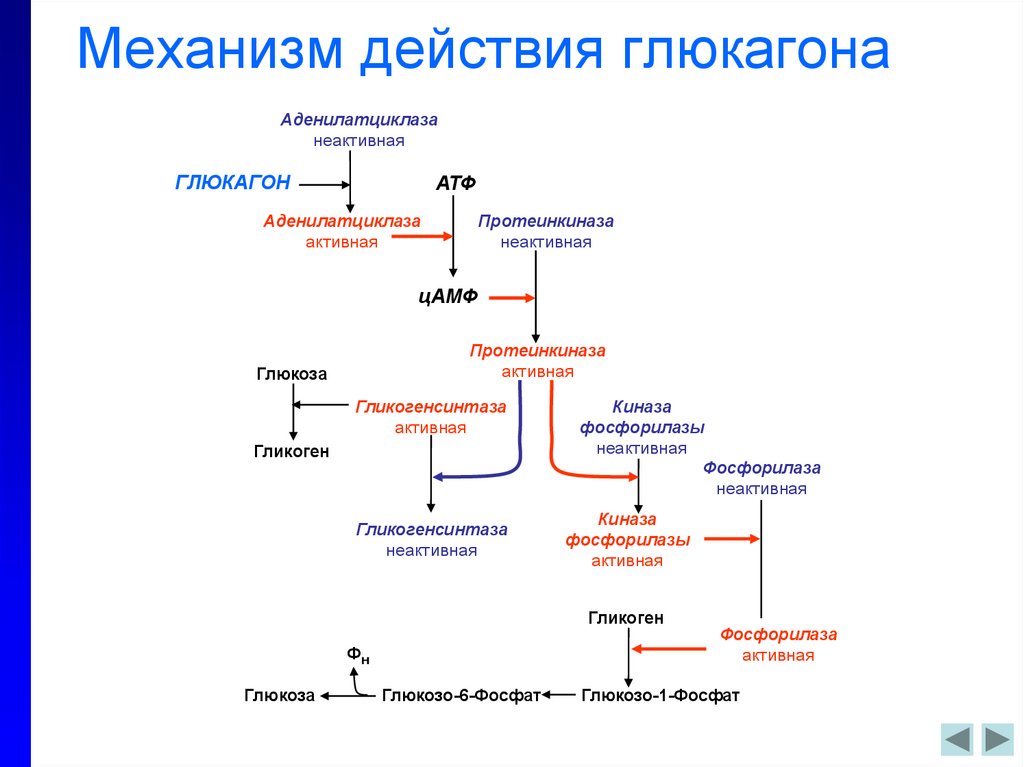 Производство глюкозы в печени быстро увеличивается в ответ на физиологическое повышение уровня глюкагона; достигается за счет стимуляции гликогенолиза с незначительными острыми изменениями глюконеогенеза (27,28). Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Производство глюкозы в печени быстро увеличивается в ответ на физиологическое повышение уровня глюкагона; достигается за счет стимуляции гликогенолиза с незначительными острыми изменениями глюконеогенеза (27,28). Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Рисунок 5.
Регуляция метаболизма глюкозы глюкагоном в печени. Глюкагон увеличивает выработку глюкозы в печени, стимулируя гликогенолиз и гликогеногенез (зеленые стрелки), ингибируя гликолиз и гликогенез (красные стрелки).
Глюкагон стимулирует расщепление жирных кислот и ингибирует липогенез в печени
Глюкагон способствует образованию неуглеводных источников энергии в виде липидов и кетоновых тел. Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Глюкагон снижает потребление пищи
Было показано, что однократное введение глюкагона снижает потребление пищи и уменьшает чувство голода (38,39). И наоборот, предпрандиальное ингибирование передачи сигналов глюкагона увеличивает потребление пищи у крыс (40, 41), что свидетельствует о роли глюкагона в регуляции аппетита. Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Глюкагон увеличивает расход энергии
В дополнение к потенциальному влиянию глюкагона на потребление пищи данные свидетельствуют о том, что глюкагон способствует отрицательному энергетическому балансу, стимулируя расход энергии. У людей этот эффект наблюдался в исследованиях, в которых введение глюкагона приводило к увеличению расхода энергии в состоянии покоя (42–44). Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
У людей этот эффект наблюдался в исследованиях, в которых введение глюкагона приводило к увеличению расхода энергии в состоянии покоя (42–44). Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Глюкагон может регулировать частоту сердечных сокращений и сократительную способность
Введение высоких доз глюкагона увеличивает частоту сердечных сокращений и сократительную способность сердца (46). Фактически, инфузия глюкагона в фармакологических дозах (миллиграмм) часто используется при лечении острой сердечной депрессии, вызванной передозировкой антагонистов кальциевых каналов или бета-блокаторов (47), несмотря на ограниченные данные (48). Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48).
Фактически, инфузия глюкагона в фармакологических дозах (миллиграмм) часто используется при лечении острой сердечной депрессии, вызванной передозировкой антагонистов кальциевых каналов или бета-блокаторов (47), несмотря на ограниченные данные (48). Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Рисунок 6.
Органоспецифическое действие глюкагона. ГИП, глюкозозависимый инсулинотропный полипептид
ГЛЮКАГОН ПАТОФИЗИОЛОГИЯ
Глюкагон при диабете 2 типа
У пациентов с диабетом 2 типа наблюдается нарушение регуляции секреции глюкагона, что в значительной степени способствует диабетической гипергликемии. В частности, диабет 2 типа характеризуется повышенным уровнем глюкагона во время голодания, в то время как подавление глюкагона в ответ на пероральный прием глюкозы нарушено или даже парадоксально повышено (16, 51, 52). Механизмы гиперглюкагонемии до конца не изучены, но обычно объясняются уменьшением подавляющего действия инсулина на альфа-клетки из-за гипоинсулинемии и резистентности к инсулину на уровне альфа-клеток (53, 54). Интересно, что пациенты с диабетом 2 типа, у которых наблюдается гиперглюкагонемический ответ на пероральное введение глюкозы, реагируют нормальным подавлением глюкагона после внутривенного введения глюкозы (16). Это говорит о том, что диабетическая гиперглюкагонемия не может быть объяснена резистентностью альфа-клеток к глюкозе и/или инсулину. Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Это говорит о том, что диабетическая гиперглюкагонемия не может быть объяснена резистентностью альфа-клеток к глюкозе и/или инсулину. Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Рисунок 7.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 2 типа и с нормальной физиологией (здоровые субъекты). Диабет 2 типа характеризуется повышенным уровнем глюкагона в плазме натощак и нарушением подавления уровня глюкагона в плазме в ответ на пероральное введение глюкозы.
Глюкагон при диабете 1 типа
Традиционно диабетическая гипергликемия 1 типа объяснялась селективной потерей массы бета-клеток и, как следствие, снижением секреции инсулина. Однако новые данные указывают на то, что глюкагон играет важную роль в патофизиологии диабета 1 типа. Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57).
Однако новые данные указывают на то, что глюкагон играет важную роль в патофизиологии диабета 1 типа. Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы. Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы. Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Рисунок 8.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 1 типа и с нормальной физиологией (здоровые субъекты). Диабет 1 типа характеризуется повышенными концентрациями глюкагона в ответ на прием пищи или пероральный прием глюкозы.
Гипогликемия является частым и опасным побочным эффектом инсулинотерапии при диабете 1 типа и представляет собой обычное препятствие для достижения гликемического контроля (60). В нормальных физиологических условиях гипогликемия предотвращается несколькими механизмами: 1) снижением секреции инсулина бета-клетками, что снижает поглощение глюкозы периферическими тканями; 2) повышенная секреция глюкагона альфа-клетками, увеличивающая выход глюкозы печенью; и 3) повышенная симпатическая нервная реакция и адреномедуллярная секреция адреналина. Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
В нормальных физиологических условиях гипогликемия предотвращается несколькими механизмами: 1) снижением секреции инсулина бета-клетками, что снижает поглощение глюкозы периферическими тканями; 2) повышенная секреция глюкагона альфа-клетками, увеличивающая выход глюкозы печенью; и 3) повышенная симпатическая нервная реакция и адреномедуллярная секреция адреналина. Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Глюкагон при ожирении и стеатозе печени
Нарушение регуляции секреции глюкагона наблюдается не только у пациентов с сахарным диабетом 2 типа, но и у лиц с толерантностью к нормоглюкозе с ожирением (64) и у пациентов с неалкогольной жировой болезнью печени (НАЖБП) (65, 66).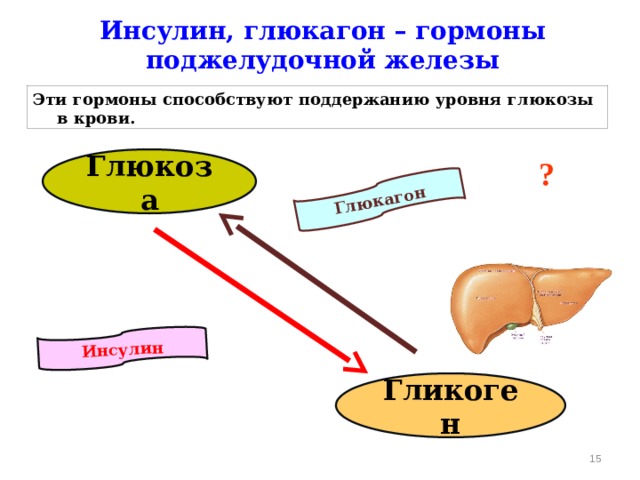 Это говорит о том, что нарушение регуляции секреции глюкагона может быть связано скорее со стеатозом печени, чем с нарушением регуляции метаболизма глюкозы. Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
Это говорит о том, что нарушение регуляции секреции глюкагона может быть связано скорее со стеатозом печени, чем с нарушением регуляции метаболизма глюкозы. Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
PERSPECTIVES
Влияние гиперглюкагонемии на ожирение и НАЖБП возродило научный интерес к действиям глюкагона и роли глюкагона в патофизиологии этих метаболических нарушений. Очевидно, что глюкагон может представлять собой потенциальную мишень для лечения ожирения и НАЖБП.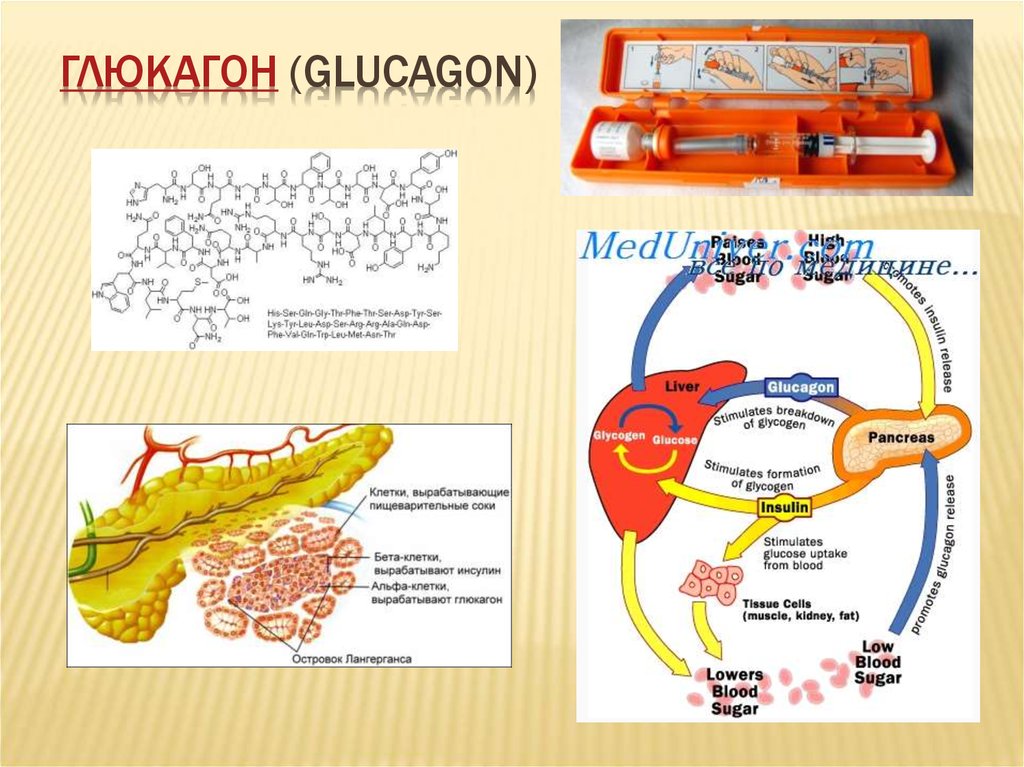 Простым способом сдерживания нежелательного гипергликемического эффекта глюкагона при реализации его действия на липолиз и расход энергии может быть совместное лечение с сахароснижающим препаратом. Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
Простым способом сдерживания нежелательного гипергликемического эффекта глюкагона при реализации его действия на липолиз и расход энергии может быть совместное лечение с сахароснижающим препаратом. Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
РЕЗЮМЕ И ВЫВОДЫ
Глюкагон представляет собой глюкорегуляторный пептидный гормон, который противодействует действию инсулина, стимулируя выработку глюкозы в печени и тем самым повышая уровень глюкозы в крови. Кроме того, глюкагон опосредует несколько метаболических эффектов, не связанных с глюкозой, важных для поддержания энергетического баланса всего организма в периоды ограниченного поступления питательных веществ. Эти действия включают мобилизацию энергетических ресурсов посредством печеночного липолиза и кетогенеза; стимуляция метаболизма аминокислот в печени (и связанного с этим уреагенеза). Кроме того, было показано, что глюкагон увеличивает расход энергии и подавляет потребление пищи, но остается неясным, участвует ли эндогенный глюкагон в регуляции этих процессов. Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
Кроме того, было показано, что глюкагон увеличивает расход энергии и подавляет потребление пищи, но остается неясным, участвует ли эндогенный глюкагон в регуляции этих процессов. Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
ПРИЗНАТЕЛЬНОСТЬ
, создано с использованием шаблонов от Servier Medical Arts, Les Laboratoires Servier (https://smart.servier.com/). Используется по лицензии Creative Commons License 3.0.
ССЫЛКИ
- 1.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697.
 [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
[Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]- 2.
Кимбалл С.П., Мурлин-младший. Водные экстракты поджелудочной железы III. Некоторые реакции преципитации инсулина. Дж. Биол. хим. 1923; 58 (1): 337–346.
- 3.
Бромер В.В., Шинн Л.Г., Штауб А., Беренс ОК. Аминокислотная последовательность глюкагона. Диабет. 1957; 6 (3): 234–238. [PubMed: 13427628]
- 4.
Блэкман Б. Использование глюкагона в терапии инсулиновой комы. Psychiatr Q. 1961; 35: 482–487. [PubMed: 13869689]
- 5.
Эскибель А.Дж., Курланд А.А., Мендельсон Д. Использование глюкагона для прерывания инсулиновой комы. Dis Nerv Syst. 1958;19(11):485–486. [PubMed: 13586175]
- 6.
Unger RH, Eisentraut AM. МАККОЛ М.С., Мэдисон Л.Л. Антитела к глюкагону и иммуноанализ на глюкагон. Дж. Клин. Инвестировать. 1961; 40: 1280–1289. [Статья бесплатно PMC: PMC2
] [PubMed: 13779204]- 7.

Unger RH, Orci L. Существенная роль глюкагона в патогенезе сахарного диабета. Ланцет. 1975;1(7897):14–16. [PubMed: 46337]
- 8.
Drucker DJ, Asa S. Экспрессия гена глюкагона в мозге позвоночных. Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 2
4]
- 9.
Мойсов С., Генрих Г., Уилсон И.Б., Раваццола М., Орси Л., Хабенер Дж.Ф. Экспрессия гена препроглюкагона в поджелудочной железе и кишечнике диверсифицируется на уровне посттрансляционного процессинга. Дж. Биол. хим. 1986;261(25):11880–11889. [PubMed: 3528148]
- 10.
Герич Дж. Э., Лоренци М., Хейн С., Густафсон Г., Гийемин Р., Форшам Р. Х. Доказательства физиологической роли глюкагона поджелудочной железы в гомеостазе глюкозы у человека: исследования соматостатина. Метаб. клин. Эксп. 1975;24(2):175–182. [PubMed: 1113681]
- 11.
Громада Дж., Франклин И., Воллхейм CB. Альфа-клетки эндокринной поджелудочной железы: 35 лет исследований, но загадка остается.
 Эндокр. 2007;28(1):84–116. [PubMed: 17261637]
Эндокр. 2007;28(1):84–116. [PubMed: 17261637]- 12.
Müller TD, Finan B, Clemmensen C, DiMarchi RD, Tschöp MH. Новая биология и фармакология глюкагона. Физиологические обзоры. 2017;97(2):721–766. [PubMed: 28275047]
- 13.
Wewer Albrechtsen NJ, Kuhre RE, Pedersen J, Knop FK, Holst JJ. Биология глюкагона и последствия гиперглюкагонемии. Биомаркеры в медицине. 2016;10(11):1141–1151. [PubMed: 27611762]
- 14.
Громада Дж., Шабоссо П., Раттер Г.А. α-клетка при сахарном диабете. Нат Рев Эндокринол. 2018. [PubMed: 30310153] [Перекрестная ссылка]
- 15.
Hughes JW, Ustione A, Lavagnino Z, Piston DW. Регуляция секреции островкового глюкагона: Помимо кальция. Диабет, ожирение и обмен веществ. 20 (С2): 127–136. [Статья бесплатно PMC: PMC6148361] [PubMed: 30230183]
- 16.
Knop FK, Vilsbøll T, Madsbad S, Holst JJ, Krarup T. Несоответствующее подавление глюкагона во время OGTT, но не во время изогликемического внутривенного введения.
 инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]
инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]- 17.
Лунд А., Баггер Дж.И., Альбрехтсен Н.Дж.В., Кристенсен М., Грондаль М., Хартманн Б., Мэтисен Э.Р., Хансен К.П., Сторкхольм Дж.Х., Холл Г., ван, Рехфельд Д.Ф., Хорнбург Д.Ф. , Мейснер Ф., Манн М., Ларсен С., Холст Дж. Дж., Вилсбёлль Т., Кноп Ф. К. Доказательства внепанкреатической секреции глюкагона у человека. Диабет. 2016;65(3):585–597. [PubMed: 26672094]
- 18.
Миячи А., Кобаяши М., Миено Э., Гото М., Фурусава К., Инагаки Т., Китамура Т. Точный аналитический метод определения уровня глюкагона в плазме человека с использованием жидкостной хроматографии и масс-спектрометрии высокого разрешения : сравнение с коммерчески доступными иммуноанализами. Анальный биоанальный хим. 2017;409(25): 5911–5918. [PubMed: 28801845]
- 19.
Hansen JS, Pedersen BK, Xu G, Lehmann R, Weigert C, Plomgaard P.
 Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа . Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]
Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа . Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]- 20.
Schwartz NS, Clutter WE, Shah SD, Cryer PE. Гликемические пороги для активации систем контррегуляции глюкозы выше, чем пороги для симптомов. Джей Клин Инвест. 1987;79(3):777–781. [Статья бесплатно PMC: PMC424197] [PubMed: 3546378]
- 21.
Свобода М., Тастеной М., Вертонген П., Робберехт П. Относительный количественный анализ мРНК рецептора глюкагона в тканях крыс. Мол. Клетка. Эндокринол. 1994;105(2):131–137. [PubMed: 7859919]
- 22.
Сандовал Д.А., Д’Алессио Д.А. Физиология пептидов проглюкагона: роль глюкагона и GLP-1 в норме и болезни. Физиол. 2015; 95 (2): 513–548. [В паблике: 25834231]
- 23.
Посписилик Дж.А., Хинке С.А., Педерсон Р.А., Хоффманн Т., Роше Ф., Шленциг Д.
 , Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141. [PubMed: 11111019]
, Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141. [PubMed: 11111019]- 24.
Pontiroli AE, Calderara A, Perfetti MG, Bareggi SR. Фармакокинетика интраназального, внутримышечного и внутривенного глюкагона у здоровых людей и больных сахарным диабетом. Евро. Дж. Клин. Фармакол. 1993;45(6):555–558. [PubMed: 8157042]
- 25.
Лунд А., Баггер Дж.И., Альбрехтсен Н.В., Кристенсен М., Грондаль М., Хансен С.П., Сторкхольм Дж.Х., Холст Дж.Дж., Вилсбёлл Т., Кноп Ф.К. Повышенное содержание жира в печени у пациентов с тотальной панкреэктомией. Диабет. 2017;67 Дополнение 1:2600. -паб.
- 26.
Унгер Р.Х. Физиология и патофизиология глюкагона в свете новых достижений. Диабетология. 1985;28(8):574–578. [PubMed: 3
- 6]
- 27.
Миллер Р.А., Бирнбаум М.Дж. Глюкагон: острые действия на печеночный метаболизм.
 Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]
Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]- 28.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени. Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
- 29.
Руи Л. Энергетический обмен в печени. сост. физиол. 2014;4(1):177–19.7. [Бесплатная статья PMC: PMC4050641] [PubMed: 246]
- 30.
Geisler CE, Renquist BJ. Накопление липидов в печени: причина и следствие нарушения регуляции глюкорегуляторных гормонов. J Эндокринол. 2017;234(1):R1–R21. [PubMed: 28428362]
- 31.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 32.
Longuet C, Sinclair EM, Maida A, Baggio LL, Maziarz M, Charron MJ, Drucker DJ.
 Рецептор глюкагона необходим для адаптивного метаболического ответа на голодание. Клеточный метаболизм. 2008;8(5):359–371. [Бесплатная статья PMC: PMC2593715] [PubMed: 1
Рецептор глюкагона необходим для адаптивного метаболического ответа на голодание. Клеточный метаболизм. 2008;8(5):359–371. [Бесплатная статья PMC: PMC2593715] [PubMed: 168]
- 33.
Wang H, Zhao M, Sud N, Christian P, Shen J, Song Y, Pashaj A, Zhang K, Carr T, Su Q. Глюкагон регулирует метаболизм липидов в печени посредством передачи сигналов цАМФ и Insig-2: значение для патогенеза гипертриглицеридемии и стеатоза печени. Научный доклад 2016; 6: 32246. [Бесплатная статья PMC: PMC5007496] [PubMed: 27582413]
- 34.
Galsgaard KD, Pedersen J, Knop FK, Holst JJ, Wewer Albrechtsen NJ. Сигнализация рецептора глюкагона и метаболизм липидов. Фронт Физиол. 2019;10 [Бесплатная статья PMC: PMC64
- ] [PubMed: 31068828] [CrossRef]
- 35.
Holst JJ, Albrechtsen NJW, Pedersen J, Knop FK. Глюкагон и аминокислоты связаны циклом взаимной обратной связи: ось печень-α-клетка. Диабет. 2017;66(2):235–240. [PubMed: 28108603]
- 36.

Hamberg O, Vilstrup H. Регуляция синтеза мочевины глюкозой и глюкагоном у здорового человека. Клин Нутр. 1994;13(3):183–191. [PubMed: 16843380]
- 37.
Соллоуэй М.Дж., Маджиди А., Гу С., Истхэм-Андерсон Дж., Кларк Х.Дж., Клявин Н., Завала-Солорио Дж., Кейтс Л., Фридман Б., Брауэр М., Ван Дж., Фин О., Колумам Г., Стерн Х., Лоу Дж. Б., Петерсон А. С., Аллан Б. Б. Глюкагон связывает катаболизм аминокислот в печени с mTOR-зависимой регуляцией массы α-клеток. Cell Rep. 2015;12(3):495–510. [PubMed: 26166562]
- 38.
Bagger JI, Holst JJ, Hartmann B, Andersen B, Knop FK, Vilsbøll T. Влияние оксинтомодулина, глюкагона, GLP-1 и комбинированной инфузии глюкагона + GLP-1 на Потребление пищи, аппетит и расход энергии в состоянии покоя. J Clin Endocrinol Metab. 2015;100(12):4541–4552. [PubMed: 26445112]
- 39.
Geary N, Kissileff HR, Pi-Sunyer FX, Hinton V. Индивидуальные, но не одновременные инфузии глюкагона и холецистокинина подавляют прием пищи у мужчин.
 Являюсь. Дж. Физиол. 1992; 262 (6 ч. 2): R975–980. [PubMed: 1621876]
Являюсь. Дж. Физиол. 1992; 262 (6 ч. 2): R975–980. [PubMed: 1621876]- 40.
Langhans W, Zeiger U, Scharrer E, Geary N. Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]
- 41.
Le Sauter J, Noh U, Geary N. Инфузия антител к глюкагону в порт печени увеличивает количество спонтанного приема пищи у крыс. Являюсь. Дж. Физиол. 1991; 261 (1 часть 2): R162–165. [PubMed: 1858943]
- 42.
Наир К.С. Гиперглюкагонемия увеличивает скорость метаболизма в покое у человека при дефиците инсулина. J Clin Endocrinol Metab. 1987;64(5):896–901. [PubMed: 2881943]
- 43.
Салем В., Иззи-Энгбея С., Коэлло С., Томас Д.Б., Чемберс Э.С., Комнинос А.Н., Бакли А., Вин З., Аль-Наххас А., Рабинер Э.А., Ганн Р.Н., Бадж Х., Саймондс М.Е., Блум С.Р., Тан Т.М., Дхилло В.С. Глюкагон увеличивает расход энергии независимо от активации бурой жировой ткани у человека.
 Сахарный диабет Ожирение Metab. 2016;18(1):72–81. [Бесплатная статья PMC: PMC4710848] [PubMed: 26434748]
Сахарный диабет Ожирение Metab. 2016;18(1):72–81. [Бесплатная статья PMC: PMC4710848] [PubMed: 26434748]- 44.
Tan TM, Field BCT, McCullough KA, Troke RC, Chambers ES, Salem V, Gonzalez Maffe J, Baynes KCR, De Silva A, Viardot A, Alsafi A, Frost GS, Ghatei MA, Bloom СР. Совместное введение глюкагоноподобного пептида-1 во время инфузии глюкагона у людей приводит к увеличению расхода энергии и уменьшению гипергликемии. Диабет. 2013;62(4):1131–1138. [PMC бесплатная статья: PMC3609580] [PubMed: 23248172]
- 45.
Habegger KM, Stemmer K, Cheng C, Müller TD, Heppner KM, Ottaway N, Holland J, Hembree JL, Smiley D, Gelfanov V, Кришна Р., Арафат А.М., Конкар А., Белли С., Каппс М., Вудс С.К., Хофманн С.М., Д’Алессио Д., Пфлюгер П.Т., Перес-Тильве Д., Сили Р.Дж., Кониши М., Ито Н., Харитоненков А., Спрангер Дж., ДиМарчи РД, Чеп МХ. Фактор роста фибробластов 21 опосредует специфические действия глюкагона. Диабет. 2013;62(5):1453–1463. [Бесплатная статья PMC: PMC3636653] [PubMed: 23305646]
- 46.

Ceriello A, Genovese S, Mannucci E, Gronda E. Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]
- 47.
Graudins A, Lee HM, Druda D. Передозировка антагонистов кальциевых каналов и бета-блокаторов: антидоты и дополнительная терапия. Бр Дж Клин Фармакол. 2016;81(3):453–461. [Бесплатная статья PMC: PMC4767195] [PubMed: 26344579]
- 48.
Мейдал Петерсен К., Бегевиг С., Холст Дж. Дж., Кноп Ф. К., Кристенсен М. Б. Гемодинамические эффекты глюкагона — обзор литературы. Дж. Клин. Эндокринол. Метаб. 2018. [PubMed: 29546411] [CrossRef]
- 49.
Thuesen L, Christiansen JS, Sørensen KE, Orskov H, Henningsen P. Внутривенное введение низких доз глюкагона не влияет на сократимость миокарда у здорового человека. Эхокардиографическое исследование. Сканд. Дж. Клин. лаборатория Инвестировать. 1988;48(1):71–75.
 [PubMed: 3064277]
[PubMed: 3064277]- 50.
Казда СМ. Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]
- 51.
Лунд А., Баггер Дж.И., Кристенсен М., Грондаль М., ван Холл Г., Холст Дж.Дж., Вильсбёлл Т., Кноп Ф.К. Более высокая продукция эндогенной глюкозы во время ПГТТ по сравнению с изогликемическим внутривенным вливанием глюкозы. J Clin Endocrinol Metab. 2016;101(11):4377–4384. [В паблике: 27533305]
- 52.
Reaven GM, Chen YD, Golay A, Swislocki AL, Jaspan JB. Документирование гиперглюкагонемии в течение дня у пациентов без ожирения и ожирения с инсулиннезависимым сахарным диабетом. Дж. Клин. Эндокринол. Метаб. 1987;64(1):106–110. [PubMed: 3536980]
- 53.
Даннинг Б.Е., Герих Дж.Е. Роль нарушения регуляции альфа-клеток в голодании и постпрандиальной гипергликемии при диабете 2 типа и терапевтических последствиях.
 Эндокр. 2007;28(3):253–283. [В паблике: 17409288]
Эндокр. 2007;28(3):253–283. [В паблике: 17409288]- 54.
Hamaguchi T, Fukushima H, Uehara M, Wada S, Shirotani T, Kishikawa H, Ichinose K, Yamaguchi K, Shichiri M. Аномальный ответ глюкагона на аргинин и его нормализация у пациентов с ожирением и гиперинсулинемией с непереносимость глюкозы: важность действия инсулина на альфа-клетки поджелудочной железы. Диабетология. 1991;34(11):801–806. [PubMed: 1769438]
- 55.
Кноп Ф.К. EJE PRIZE 2018: Интуитивное мнение о глюкагоне. Евро. Дж. Эндокринол. 2018;178(6):R267–R280. [В паблике: 29678923]
- 56.
Лунд А., Вилсбёлл Т., Баггер Дж.И., Холст Дж.Дж., Кноп Ф.К. Отдельное и комбинированное влияние кишечных гормонов, ГИП, ГПП-1 и ГПП-2, на секрецию глюкагона при диабете 2 типа. Являюсь. Дж. Физиол. Эндокринол. Метаб. 2011; 300(6):E1038–1046. [PubMed: 21386059]
- 57.
Cryer PE. Миниобзор: Глюкагон в патогенезе гипогликемии и гипергликемии при диабете.
 Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]
Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]- 58.
Li K, Song W, Wu X, Gu D, Zang P, Gu P, Lu B, Shao J. Ассоциации уровня глюкагона в сыворотке крови с гликемической изменчивостью при диабете 1 типа с разной продолжительностью заболевания . Эндокринный. 2018;61(3):473–481. [PubMed: 292]
- 59.
Заяц К.Дж., Вилсбёлл Т., Холст Дж.Дж., Кноп Ф.К. Неадекватная реакция глюкагона после перорального введения по сравнению с изогликемическим внутривенным введением глюкозы у пациентов с диабетом 1 типа. Американский журнал физиологии-эндокринологии и метаболизма. 2010;298 (4): E832–E837. [PubMed: 20103744]
- 60.
Исследовательская группа по контролю диабета и осложнений. Натан Д.М., Генут С., Лачин Дж., Клири П., Кроффорд О., Дэвис М., Рэнд Л., Зиберт С. Влияние интенсивного лечения диабета на развитие и прогрессирование долгосрочных осложнений при инсулинозависимом сахарном диабете.
 Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]
Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]- 61.
Cryer PE, Gerich JE. Контррегуляция глюкозы, гипогликемия и интенсивная инсулинотерапия при сахарном диабете. Н. англ. Дж. Мед. 1985;313(4):232–241. [PubMed: 2861565]
- 62.
Sprague JE, Arbeláez AM. Контррегуляторные реакции глюкозы на гипогликемию. Pediatr Endocrinol Rev. 2011;9(1):463–475. [Бесплатная статья PMC: PMC3755377] [PubMed: 22783644]
- 63.
Yosten GLC. Дисфункция альфа-клеток при сахарном диабете 1 типа. Пептиды. 2018;100:54–60. [PubMed: 29412832]
- 64.
Knop FK, Aaboe K, Vilsbøll T, Vølund A, Holst JJ, Krarup T, Madsbad S. Нарушение инкретинового эффекта и гиперглюкагонемия натощак, характерные для пациентов с диабетом 2 типа, являются ранними признаками дисметаболизма. при ожирении. Сахарный диабет Ожирение Metab. 2012;14(6):500–510. [В паблике: 22171657]
- 65.
Albrechtsen NJW, Junker AE, Christensen M, Hædersdal S, Wibrand F, Lund AM, Galsgaard KD, Holst JJ, Knop FK, Vilsbøll T.
 Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]
Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]- 66.
Junker AE, Gluud L, Holst JJ, Knop FK, Vilsbøll T. Диабетические и недиабетические пациенты с неалкогольной жировой болезнью печени имеют нарушенный инкретиновый эффект и гиперглюкагонемию натощак. J Интерн Мед. 2016;279(5): 485–493. [PubMed: 26728692]
- 67.
Suppli MP, Lund A, Bagger JI, Vilsbøll T, Knop FK. Участие индуцированной стеатозом резистентности к глюкагону в гиперглюкагонемии. Мед. Гипотезы. 2016;86:100–103. [PubMed: 26547273]
- 68.
Tillner J, Posch MG, Wagner F, Teichert L, Hijazi Y, Einig C, Keil S, Haack T, Wagner M, Bossart M, Larsen PJ. Новый двойной глюкагоноподобный пептид и агонист рецептора глюкагона SAR425899: результаты рандомизированных плацебо-контролируемых испытаний, проведенных впервые на людях и на пациентах.
 Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300
Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300- ] [CrossRef]
- 69.
Эмбери П., Паркер В.Е., Стамволл М., Пош М.Г., Хайзе Т., Плам-Мёршель Л., Цай Л.Ф., Робертсон Д., Джайн М., Петроне М., Рондиноне С., Хиршберг Б. , Jermutus L. MEDI0382, двойной агонист GLP-1 и рецептора глюкагона, у пациентов с ожирением или избыточным весом с диабетом 2 типа: рандомизированное, контролируемое, двойное слепое исследование с возрастающей дозой и фаза 2а. Ланцет. 2018;391(10140):2607–2618. [PubMed: 29945727]
Физиология глюкагона — Эндотекст — Книжная полка NCBI
РЕЗЮМЕ
Глюкагон представляет собой пептидный гормон, секретируемый альфа-клетками островков Лангерганса поджелудочной железы. Гипогликемия является физиологически наиболее мощным секреторным стимулом, и наиболее известным действием глюкагона является стимуляция продукции глюкозы в печени и, таким образом, поддержание адекватных концентраций глюкозы в плазме. Однако глюкагон также участвует в метаболизме липидов и аминокислот в печени и может увеличивать расход энергии в состоянии покоя. Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
ВВЕДЕНИЕ
Глюкагон, секретируемый альфа-клетками поджелудочной железы в островке Лангерганса, играет важную роль в поддержании гомеостаза глюкозы путем стимуляции продукции глюкозы в печени (1). Таким образом, в отличие от глюкозодепонирующего характера действия инсулина, глюкагон действует как глюкозомобилизующий гормон. В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5).
В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5). Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
СТРУКТУРА И СИНТЕЗ ГЛЮКАГОНА
Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, преимущественно секретируемый альфа-клетками поджелудочной железы. Он получен из предшественника проглюкагона, который может превращаться в ряд родственных пептидных гормонов (12). Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Рисунок 1.
Тканеспецифический процессинг проглюкагона. В поджелудочной железе проглюкагон процессируется в глюкагон, родственный глицентину полипептид поджелудочной железы (GRPP), промежуточный пептид 1 (IP1) и основной фрагмент проглюкагона (MPGF) с помощью фермента процессинга прогормонконвертазы 2 (PC2). В кишечнике и в головном мозге проглюкагон процессируется прогормонконвертазой 1/3 (PC1/3) в глюкагоноподобный пептид 1 (ГПП-1), глюкагоноподобный пептид 2 (ГПП-2), оксинтомодулин, промежуточный пептид 2 ( IP2) и глицентин.
СЕКРЕЦИЯ ГЛЮКАГОНА
Глюкагон секретируется в ответ на гипогликемию, длительное голодание, физические упражнения и прием пищи, богатой белком (10). Высвобождение глюкагона регулируется эндокринными и паракринными путями; по питательным веществам; и вегетативной нервной системой (11). Секреция глюкагона происходит как экзоцитоз запасенных пептидных везикул, инициируемый секреторными стимулами альфа-клетки. Стимулирующие регуляторы высвобождения глюкагона включают гипогликемию, аминокислоты и глюкозозависимый инсулинотропный пептид (ГИП) гормона кишечника, тогда как гипергликемия и ГПП-1 ингибируют высвобождение глюкагона. Кроме того, высвобождение глюкагона ингибируется паракринным образом такими факторами, как соматостатин, инсулин, цинк и, возможно, амилин. Глюкагон может косвенно регулировать собственную секрецию через стимулирующее действие на бета-клетки, чтобы они секретировали инсулин (12,13). В отличие от глюкозы, неглюкозные регуляторы секреции глюкагона, по-видимому, опосредуют свое действие через изменения уровней цАМФ, а не через кальций-зависимый путь, описанный ниже (14,15).
Регуляция секреции глюкагона глюкозой
Наиболее мощным регулятором секреции глюкагона является циркулирующая глюкоза. Гипогликемия стимулирует альфа-клетки поджелудочной железы к высвобождению глюкагона, а гипергликемия ингибирует секрецию глюкагона (11). Клеточный механизм этой глюкозозависимой регуляции секреции глюкагона включает поглощение глюкозы переносчиком глюкозы 1 (GLUT1) в клеточной мембране альфа-клеток поджелудочной железы и последующий гликолиз, который в конечном итоге генерирует аденозинтрифосфат (АТФ) в митохондриях альфа-клетки. . Таким образом, уровень внутриклеточного АТФ в альфа-клетке отражает уровень глюкозы в плазме. Гипогликемия и, как следствие, низкие внутриклеточные уровни АТФ в альфа-клетках закрывают АТФ-чувствительные калиевые каналы (K ATP -каналы), в результате чего отток калия (K + ) снижается. Это вызывает деполяризацию клеточной мембраны, которая, в свою очередь, открывает потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Рисунок 2.
Глюкозозависимая секреция глюкагона альфа-клеткой. При гипогликемии концентрация внутриклеточной глюкозы падает с последующим снижением гликолиз-генерируемого аденозинтрифосфата (АТФ) в митохондриях клетки. Это закрывает АТФ-чувствительный калий (K + ) и внутриклеточная концентрация K + повышается, что деполяризует клеточную мембрану, таким образом открывая потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Концентрация глюкагона в кровотоке
В нормальной физиологии концентрация глюкагона в кровотоке находится в пикомолярном диапазоне. В состоянии натощак при уровне глюкозы в плазме около 5 ммоль/л глюкагон секретируется на базальном уровне, что приводит к концентрации в плазме ниже 20 пмоль/л (16–18). Базальная секреция глюкагона уравновешивает эффект базальной секреции инсулина, что приводит к устойчивому состоянию между поглощением глюкозы и эндогенной выработкой глюкозы натощак; то есть стабильные концентрации глюкозы в крови. Во время физической нагрузки или в случае гипогликемии уровень циркулирующего глюкагона может резко увеличиться в 3-4 раза по сравнению с базальным уровнем, увеличивая соотношение глюкагона и инсулина (12,19).,20) ().
Рисунок 3.
Концентрации глюкагона в ответ на гипогликемию, эугликемию и гипергликемию.
СИГНАЛИЗАЦИЯ РЕЦЕПТОРА ГЛЮКАГОНА
Действие глюкагона опосредовано связыванием и активацией рецептора глюкагона. Рецептор глюкагона представляет собой семь трансмембранных рецепторов, связанных с G-белком (1), преимущественно экспрессируемых в печени, но также обнаруживаемых в различных количествах в почках, сердце (спорно), надпочечниках, жировой ткани (спорно), желудочно-кишечном тракте и поджелудочной железе ( 21). Основной способ внутриклеточной передачи сигналов включает активацию G с и G q . Активация G s стимулирует аденилатциклазу, которая продуцирует циклический аденозинмонофосфат (цАМФ), который активирует протеинкиназу А (ПКА). Активированный PKA мигрирует в ядро и активирует факторы транскрипции, такие как белок, связывающий элемент ответа цАМФ (CREB), посредством фосфорилирования. Это позволяет CREB связываться с ответными элементами генов-мишеней, что приводит к рекрутированию коактиваторов и, в конечном итоге, к экспрессии генов. Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Рисунок 4.
Примеры двух наиболее хорошо описанных внутриклеточных путей, участвующих в глюкагон-индуцированной регуляции экспрессии генов-мишеней: путей PKA и IP 3 . AC, аденилатциклаза; CRTC2, коактиватор транскрипции, регулируемый CREB; CREB, белок, связывающий элемент ответа цАМФ; IP 3, инозитол-1,4,5-трифосфат; PIP 2 , фосфатидилинозитол-4,5-бисфосфат; PKA, протеинкиназа А; PLC, фосфолипаза C.
ДЕГРАДАЦИЯ И ЭЛИМИНАЦИЯ ГЛЮКАГОНА
Разложению глюкагона в основном способствует рецептор-опосредованный эндоцитоз и протеолиз с помощью вездесущего фермента дипептидилпептидазы 4 (22,23). В соответствии с относительной экспрессией рецепторов, печень и почки, по-видимому, представляют собой два основных органа, удаляющих глюкагон из кровообращения. Сообщается, что период полураспада глюкагона в плазме у человека составляет от четырех до семи минут (24, 25).
ДЕЙСТВИЕ ГЛЮКАГОНА
Глюкагон увеличивает выработку глюкозы в печени
Глюкагон регулирует концентрацию глюкозы в плазме во время голодания, физической нагрузки и гипогликемии, увеличивая выход глюкозы печенью в кровоток. В частности, глюкагон способствует превращению гликогена в глюкозу в печени (гликогенолиз), стимулирует синтез глюкозы de novo (глюконеогенез) и ингибирует расщепление глюкозы (гликолиз) и образование гликогена (гликогенез) (26). Производство глюкозы в печени быстро увеличивается в ответ на физиологическое повышение уровня глюкагона; достигается за счет стимуляции гликогенолиза с незначительными острыми изменениями глюконеогенеза (27,28). Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Рисунок 5.
Регуляция метаболизма глюкозы глюкагоном в печени. Глюкагон увеличивает выработку глюкозы в печени, стимулируя гликогенолиз и гликогеногенез (зеленые стрелки), ингибируя гликолиз и гликогенез (красные стрелки).
Глюкагон стимулирует расщепление жирных кислот и ингибирует липогенез в печени
Глюкагон способствует образованию неуглеводных источников энергии в виде липидов и кетоновых тел. Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Глюкагон снижает потребление пищи
Было показано, что однократное введение глюкагона снижает потребление пищи и уменьшает чувство голода (38,39). И наоборот, предпрандиальное ингибирование передачи сигналов глюкагона увеличивает потребление пищи у крыс (40, 41), что свидетельствует о роли глюкагона в регуляции аппетита. Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Глюкагон увеличивает расход энергии
В дополнение к потенциальному влиянию глюкагона на потребление пищи данные свидетельствуют о том, что глюкагон способствует отрицательному энергетическому балансу, стимулируя расход энергии. У людей этот эффект наблюдался в исследованиях, в которых введение глюкагона приводило к увеличению расхода энергии в состоянии покоя (42–44). Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Глюкагон может регулировать частоту сердечных сокращений и сократительную способность
Введение высоких доз глюкагона увеличивает частоту сердечных сокращений и сократительную способность сердца (46). Фактически, инфузия глюкагона в фармакологических дозах (миллиграмм) часто используется при лечении острой сердечной депрессии, вызванной передозировкой антагонистов кальциевых каналов или бета-блокаторов (47), несмотря на ограниченные данные (48). Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Рисунок 6.

Органоспецифическое действие глюкагона. ГИП, глюкозозависимый инсулинотропный полипептид
ГЛЮКАГОН ПАТОФИЗИОЛОГИЯ
Глюкагон при диабете 2 типа
У пациентов с диабетом 2 типа наблюдается нарушение регуляции секреции глюкагона, что в значительной степени способствует диабетической гипергликемии. В частности, диабет 2 типа характеризуется повышенным уровнем глюкагона во время голодания, в то время как подавление глюкагона в ответ на пероральный прием глюкозы нарушено или даже парадоксально повышено (16, 51, 52). Механизмы гиперглюкагонемии до конца не изучены, но обычно объясняются уменьшением подавляющего действия инсулина на альфа-клетки из-за гипоинсулинемии и резистентности к инсулину на уровне альфа-клеток (53, 54). Интересно, что пациенты с диабетом 2 типа, у которых наблюдается гиперглюкагонемический ответ на пероральное введение глюкозы, реагируют нормальным подавлением глюкагона после внутривенного введения глюкозы (16). Это говорит о том, что диабетическая гиперглюкагонемия не может быть объяснена резистентностью альфа-клеток к глюкозе и/или инсулину. Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Рисунок 7.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 2 типа и с нормальной физиологией (здоровые субъекты). Диабет 2 типа характеризуется повышенным уровнем глюкагона в плазме натощак и нарушением подавления уровня глюкагона в плазме в ответ на пероральное введение глюкозы.
Глюкагон при диабете 1 типа
Традиционно диабетическая гипергликемия 1 типа объяснялась селективной потерей массы бета-клеток и, как следствие, снижением секреции инсулина. Однако новые данные указывают на то, что глюкагон играет важную роль в патофизиологии диабета 1 типа. Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы.
Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы. Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Рисунок 8.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 1 типа и с нормальной физиологией (здоровые субъекты). Диабет 1 типа характеризуется повышенными концентрациями глюкагона в ответ на прием пищи или пероральный прием глюкозы.
Гипогликемия является частым и опасным побочным эффектом инсулинотерапии при диабете 1 типа и представляет собой обычное препятствие для достижения гликемического контроля (60). В нормальных физиологических условиях гипогликемия предотвращается несколькими механизмами: 1) снижением секреции инсулина бета-клетками, что снижает поглощение глюкозы периферическими тканями; 2) повышенная секреция глюкагона альфа-клетками, увеличивающая выход глюкозы печенью; и 3) повышенная симпатическая нервная реакция и адреномедуллярная секреция адреналина. Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Глюкагон при ожирении и стеатозе печени
Нарушение регуляции секреции глюкагона наблюдается не только у пациентов с сахарным диабетом 2 типа, но и у лиц с толерантностью к нормоглюкозе с ожирением (64) и у пациентов с неалкогольной жировой болезнью печени (НАЖБП) (65, 66). Это говорит о том, что нарушение регуляции секреции глюкагона может быть связано скорее со стеатозом печени, чем с нарушением регуляции метаболизма глюкозы. Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
PERSPECTIVES
Влияние гиперглюкагонемии на ожирение и НАЖБП возродило научный интерес к действиям глюкагона и роли глюкагона в патофизиологии этих метаболических нарушений. Очевидно, что глюкагон может представлять собой потенциальную мишень для лечения ожирения и НАЖБП. Простым способом сдерживания нежелательного гипергликемического эффекта глюкагона при реализации его действия на липолиз и расход энергии может быть совместное лечение с сахароснижающим препаратом. Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
РЕЗЮМЕ И ВЫВОДЫ
Глюкагон представляет собой глюкорегуляторный пептидный гормон, который противодействует действию инсулина, стимулируя выработку глюкозы в печени и тем самым повышая уровень глюкозы в крови. Кроме того, глюкагон опосредует несколько метаболических эффектов, не связанных с глюкозой, важных для поддержания энергетического баланса всего организма в периоды ограниченного поступления питательных веществ. Эти действия включают мобилизацию энергетических ресурсов посредством печеночного липолиза и кетогенеза; стимуляция метаболизма аминокислот в печени (и связанного с этим уреагенеза). Кроме того, было показано, что глюкагон увеличивает расход энергии и подавляет потребление пищи, но остается неясным, участвует ли эндогенный глюкагон в регуляции этих процессов. Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
ПРИЗНАТЕЛЬНОСТЬ
, создано с использованием шаблонов от Servier Medical Arts, Les Laboratoires Servier (https://smart.servier.com/). Используется по лицензии Creative Commons License 3.0.
ССЫЛКИ
- 1.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 2.
Кимбалл С.П., Мурлин-младший. Водные экстракты поджелудочной железы III. Некоторые реакции преципитации инсулина.
 Дж. Биол. хим. 1923; 58 (1): 337–346.
Дж. Биол. хим. 1923; 58 (1): 337–346.- 3.
Бромер В.В., Шинн Л.Г., Штауб А., Беренс ОК. Аминокислотная последовательность глюкагона. Диабет. 1957; 6 (3): 234–238. [PubMed: 13427628]
- 4.
Блэкман Б. Использование глюкагона в терапии инсулиновой комы. Psychiatr Q. 1961; 35: 482–487. [PubMed: 13869689]
- 5.
Эскибель А.Дж., Курланд А.А., Мендельсон Д. Использование глюкагона для прерывания инсулиновой комы. Dis Nerv Syst. 1958;19(11):485–486. [PubMed: 13586175]
- 6.
Unger RH, Eisentraut AM. МАККОЛ М.С., Мэдисон Л.Л. Антитела к глюкагону и иммуноанализ на глюкагон. Дж. Клин. Инвестировать. 1961; 40: 1280–1289. [Статья бесплатно PMC: PMC2
] [PubMed: 13779204]- 7.
Unger RH, Orci L. Существенная роль глюкагона в патогенезе сахарного диабета. Ланцет. 1975;1(7897):14–16. [PubMed: 46337]
- 8.
Drucker DJ, Asa S. Экспрессия гена глюкагона в мозге позвоночных.
 Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 2
Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 24]
- 9.
Мойсов С., Генрих Г., Уилсон И.Б., Раваццола М., Орси Л., Хабенер Дж.Ф. Экспрессия гена препроглюкагона в поджелудочной железе и кишечнике диверсифицируется на уровне посттрансляционного процессинга. Дж. Биол. хим. 1986;261(25):11880–11889. [PubMed: 3528148]
- 10.
Герич Дж. Э., Лоренци М., Хейн С., Густафсон Г., Гийемин Р., Форшам Р. Х. Доказательства физиологической роли глюкагона поджелудочной железы в гомеостазе глюкозы у человека: исследования соматостатина. Метаб. клин. Эксп. 1975;24(2):175–182. [PubMed: 1113681]
- 11.
Громада Дж., Франклин И., Воллхейм CB. Альфа-клетки эндокринной поджелудочной железы: 35 лет исследований, но загадка остается. Эндокр. 2007;28(1):84–116. [PubMed: 17261637]
- 12.
Müller TD, Finan B, Clemmensen C, DiMarchi RD, Tschöp MH. Новая биология и фармакология глюкагона. Физиологические обзоры.
 2017;97(2):721–766. [PubMed: 28275047]
2017;97(2):721–766. [PubMed: 28275047]- 13.
Wewer Albrechtsen NJ, Kuhre RE, Pedersen J, Knop FK, Holst JJ. Биология глюкагона и последствия гиперглюкагонемии. Биомаркеры в медицине. 2016;10(11):1141–1151. [PubMed: 27611762]
- 14.
Громада Дж., Шабоссо П., Раттер Г.А. α-клетка при сахарном диабете. Нат Рев Эндокринол. 2018. [PubMed: 30310153] [Перекрестная ссылка]
- 15.
Hughes JW, Ustione A, Lavagnino Z, Piston DW. Регуляция секреции островкового глюкагона: Помимо кальция. Диабет, ожирение и обмен веществ. 20 (С2): 127–136. [Статья бесплатно PMC: PMC6148361] [PubMed: 30230183]
- 16.
Knop FK, Vilsbøll T, Madsbad S, Holst JJ, Krarup T. Несоответствующее подавление глюкагона во время OGTT, но не во время изогликемического внутривенного введения. инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]
- 17.

Лунд А., Баггер Дж.И., Альбрехтсен Н.Дж.В., Кристенсен М., Грондаль М., Хартманн Б., Мэтисен Э.Р., Хансен К.П., Сторкхольм Дж.Х., Холл Г., ван, Рехфельд Д.Ф., Хорнбург Д.Ф. , Мейснер Ф., Манн М., Ларсен С., Холст Дж. Дж., Вилсбёлль Т., Кноп Ф. К. Доказательства внепанкреатической секреции глюкагона у человека. Диабет. 2016;65(3):585–597. [PubMed: 26672094]
- 18.
Миячи А., Кобаяши М., Миено Э., Гото М., Фурусава К., Инагаки Т., Китамура Т. Точный аналитический метод определения уровня глюкагона в плазме человека с использованием жидкостной хроматографии и масс-спектрометрии высокого разрешения : сравнение с коммерчески доступными иммуноанализами. Анальный биоанальный хим. 2017;409(25): 5911–5918. [PubMed: 28801845]
- 19.
Hansen JS, Pedersen BK, Xu G, Lehmann R, Weigert C, Plomgaard P. Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа .
 Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]
Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]- 20.
Schwartz NS, Clutter WE, Shah SD, Cryer PE. Гликемические пороги для активации систем контррегуляции глюкозы выше, чем пороги для симптомов. Джей Клин Инвест. 1987;79(3):777–781. [Статья бесплатно PMC: PMC424197] [PubMed: 3546378]
- 21.
Свобода М., Тастеной М., Вертонген П., Робберехт П. Относительный количественный анализ мРНК рецептора глюкагона в тканях крыс. Мол. Клетка. Эндокринол. 1994;105(2):131–137. [PubMed: 7859919]
- 22.
Сандовал Д.А., Д’Алессио Д.А. Физиология пептидов проглюкагона: роль глюкагона и GLP-1 в норме и болезни. Физиол. 2015; 95 (2): 513–548. [В паблике: 25834231]
- 23.
Посписилик Дж.А., Хинке С.А., Педерсон Р.А., Хоффманн Т., Роше Ф., Шленциг Д., Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141.
 [PubMed: 11111019]
[PubMed: 11111019]- 24.
Pontiroli AE, Calderara A, Perfetti MG, Bareggi SR. Фармакокинетика интраназального, внутримышечного и внутривенного глюкагона у здоровых людей и больных сахарным диабетом. Евро. Дж. Клин. Фармакол. 1993;45(6):555–558. [PubMed: 8157042]
- 25.
Лунд А., Баггер Дж.И., Альбрехтсен Н.В., Кристенсен М., Грондаль М., Хансен С.П., Сторкхольм Дж.Х., Холст Дж.Дж., Вилсбёлл Т., Кноп Ф.К. Повышенное содержание жира в печени у пациентов с тотальной панкреэктомией. Диабет. 2017;67 Дополнение 1:2600. -паб.
- 26.
Унгер Р.Х. Физиология и патофизиология глюкагона в свете новых достижений. Диабетология. 1985;28(8):574–578. [PubMed: 3
- 6]
- 27.
Миллер Р.А., Бирнбаум М.Дж. Глюкагон: острые действия на печеночный метаболизм. Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]
- 28.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени.
 Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]- 29.
Руи Л. Энергетический обмен в печени. сост. физиол. 2014;4(1):177–19.7. [Бесплатная статья PMC: PMC4050641] [PubMed: 246]
- 30.
Geisler CE, Renquist BJ. Накопление липидов в печени: причина и следствие нарушения регуляции глюкорегуляторных гормонов. J Эндокринол. 2017;234(1):R1–R21. [PubMed: 28428362]
- 31.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 32.
Longuet C, Sinclair EM, Maida A, Baggio LL, Maziarz M, Charron MJ, Drucker DJ. Рецептор глюкагона необходим для адаптивного метаболического ответа на голодание. Клеточный метаболизм. 2008;8(5):359–371. [Бесплатная статья PMC: PMC2593715] [PubMed: 1
68]
- 33.

Wang H, Zhao M, Sud N, Christian P, Shen J, Song Y, Pashaj A, Zhang K, Carr T, Su Q. Глюкагон регулирует метаболизм липидов в печени посредством передачи сигналов цАМФ и Insig-2: значение для патогенеза гипертриглицеридемии и стеатоза печени. Научный доклад 2016; 6: 32246. [Бесплатная статья PMC: PMC5007496] [PubMed: 27582413]
- 34.
Galsgaard KD, Pedersen J, Knop FK, Holst JJ, Wewer Albrechtsen NJ. Сигнализация рецептора глюкагона и метаболизм липидов. Фронт Физиол. 2019;10 [Бесплатная статья PMC: PMC64
- ] [PubMed: 31068828] [CrossRef]
- 35.
Holst JJ, Albrechtsen NJW, Pedersen J, Knop FK. Глюкагон и аминокислоты связаны циклом взаимной обратной связи: ось печень-α-клетка. Диабет. 2017;66(2):235–240. [PubMed: 28108603]
- 36.
Hamberg O, Vilstrup H. Регуляция синтеза мочевины глюкозой и глюкагоном у здорового человека. Клин Нутр. 1994;13(3):183–191. [PubMed: 16843380]
- 37.

Соллоуэй М.Дж., Маджиди А., Гу С., Истхэм-Андерсон Дж., Кларк Х.Дж., Клявин Н., Завала-Солорио Дж., Кейтс Л., Фридман Б., Брауэр М., Ван Дж., Фин О., Колумам Г., Стерн Х., Лоу Дж. Б., Петерсон А. С., Аллан Б. Б. Глюкагон связывает катаболизм аминокислот в печени с mTOR-зависимой регуляцией массы α-клеток. Cell Rep. 2015;12(3):495–510. [PubMed: 26166562]
- 38.
Bagger JI, Holst JJ, Hartmann B, Andersen B, Knop FK, Vilsbøll T. Влияние оксинтомодулина, глюкагона, GLP-1 и комбинированной инфузии глюкагона + GLP-1 на Потребление пищи, аппетит и расход энергии в состоянии покоя. J Clin Endocrinol Metab. 2015;100(12):4541–4552. [PubMed: 26445112]
- 39.
Geary N, Kissileff HR, Pi-Sunyer FX, Hinton V. Индивидуальные, но не одновременные инфузии глюкагона и холецистокинина подавляют прием пищи у мужчин. Являюсь. Дж. Физиол. 1992; 262 (6 ч. 2): R975–980. [PubMed: 1621876]
- 40.
Langhans W, Zeiger U, Scharrer E, Geary N.
 Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]
Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]- 41.
Le Sauter J, Noh U, Geary N. Инфузия антител к глюкагону в порт печени увеличивает количество спонтанного приема пищи у крыс. Являюсь. Дж. Физиол. 1991; 261 (1 часть 2): R162–165. [PubMed: 1858943]
- 42.
Наир К.С. Гиперглюкагонемия увеличивает скорость метаболизма в покое у человека при дефиците инсулина. J Clin Endocrinol Metab. 1987;64(5):896–901. [PubMed: 2881943]
- 43.
Салем В., Иззи-Энгбея С., Коэлло С., Томас Д.Б., Чемберс Э.С., Комнинос А.Н., Бакли А., Вин З., Аль-Наххас А., Рабинер Э.А., Ганн Р.Н., Бадж Х., Саймондс М.Е., Блум С.Р., Тан Т.М., Дхилло В.С. Глюкагон увеличивает расход энергии независимо от активации бурой жировой ткани у человека. Сахарный диабет Ожирение Metab. 2016;18(1):72–81. [Бесплатная статья PMC: PMC4710848] [PubMed: 26434748]
- 44.

Tan TM, Field BCT, McCullough KA, Troke RC, Chambers ES, Salem V, Gonzalez Maffe J, Baynes KCR, De Silva A, Viardot A, Alsafi A, Frost GS, Ghatei MA, Bloom СР. Совместное введение глюкагоноподобного пептида-1 во время инфузии глюкагона у людей приводит к увеличению расхода энергии и уменьшению гипергликемии. Диабет. 2013;62(4):1131–1138. [PMC бесплатная статья: PMC3609580] [PubMed: 23248172]
- 45.
Habegger KM, Stemmer K, Cheng C, Müller TD, Heppner KM, Ottaway N, Holland J, Hembree JL, Smiley D, Gelfanov V, Кришна Р., Арафат А.М., Конкар А., Белли С., Каппс М., Вудс С.К., Хофманн С.М., Д’Алессио Д., Пфлюгер П.Т., Перес-Тильве Д., Сили Р.Дж., Кониши М., Ито Н., Харитоненков А., Спрангер Дж., ДиМарчи РД, Чеп МХ. Фактор роста фибробластов 21 опосредует специфические действия глюкагона. Диабет. 2013;62(5):1453–1463. [Бесплатная статья PMC: PMC3636653] [PubMed: 23305646]
- 46.
Ceriello A, Genovese S, Mannucci E, Gronda E.
 Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]
Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]- 47.
Graudins A, Lee HM, Druda D. Передозировка антагонистов кальциевых каналов и бета-блокаторов: антидоты и дополнительная терапия. Бр Дж Клин Фармакол. 2016;81(3):453–461. [Бесплатная статья PMC: PMC4767195] [PubMed: 26344579]
- 48.
Мейдал Петерсен К., Бегевиг С., Холст Дж. Дж., Кноп Ф. К., Кристенсен М. Б. Гемодинамические эффекты глюкагона — обзор литературы. Дж. Клин. Эндокринол. Метаб. 2018. [PubMed: 29546411] [CrossRef]
- 49.
Thuesen L, Christiansen JS, Sørensen KE, Orskov H, Henningsen P. Внутривенное введение низких доз глюкагона не влияет на сократимость миокарда у здорового человека. Эхокардиографическое исследование. Сканд. Дж. Клин. лаборатория Инвестировать. 1988;48(1):71–75. [PubMed: 3064277]
- 50.
Казда СМ.
 Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]
Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]- 51.
Лунд А., Баггер Дж.И., Кристенсен М., Грондаль М., ван Холл Г., Холст Дж.Дж., Вильсбёлл Т., Кноп Ф.К. Более высокая продукция эндогенной глюкозы во время ПГТТ по сравнению с изогликемическим внутривенным вливанием глюкозы. J Clin Endocrinol Metab. 2016;101(11):4377–4384. [В паблике: 27533305]
- 52.
Reaven GM, Chen YD, Golay A, Swislocki AL, Jaspan JB. Документирование гиперглюкагонемии в течение дня у пациентов без ожирения и ожирения с инсулиннезависимым сахарным диабетом. Дж. Клин. Эндокринол. Метаб. 1987;64(1):106–110. [PubMed: 3536980]
- 53.
Даннинг Б.Е., Герих Дж.Е. Роль нарушения регуляции альфа-клеток в голодании и постпрандиальной гипергликемии при диабете 2 типа и терапевтических последствиях.
 Эндокр. 2007;28(3):253–283. [В паблике: 17409288]
Эндокр. 2007;28(3):253–283. [В паблике: 17409288]- 54.
Hamaguchi T, Fukushima H, Uehara M, Wada S, Shirotani T, Kishikawa H, Ichinose K, Yamaguchi K, Shichiri M. Аномальный ответ глюкагона на аргинин и его нормализация у пациентов с ожирением и гиперинсулинемией с непереносимость глюкозы: важность действия инсулина на альфа-клетки поджелудочной железы. Диабетология. 1991;34(11):801–806. [PubMed: 1769438]
- 55.
Кноп Ф.К. EJE PRIZE 2018: Интуитивное мнение о глюкагоне. Евро. Дж. Эндокринол. 2018;178(6):R267–R280. [В паблике: 29678923]
- 56.
Лунд А., Вилсбёлл Т., Баггер Дж.И., Холст Дж.Дж., Кноп Ф.К. Отдельное и комбинированное влияние кишечных гормонов, ГИП, ГПП-1 и ГПП-2, на секрецию глюкагона при диабете 2 типа. Являюсь. Дж. Физиол. Эндокринол. Метаб. 2011; 300(6):E1038–1046. [PubMed: 21386059]
- 57.
Cryer PE. Миниобзор: Глюкагон в патогенезе гипогликемии и гипергликемии при диабете.
 Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]
Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]- 58.
Li K, Song W, Wu X, Gu D, Zang P, Gu P, Lu B, Shao J. Ассоциации уровня глюкагона в сыворотке крови с гликемической изменчивостью при диабете 1 типа с разной продолжительностью заболевания . Эндокринный. 2018;61(3):473–481. [PubMed: 292]
- 59.
Заяц К.Дж., Вилсбёлл Т., Холст Дж.Дж., Кноп Ф.К. Неадекватная реакция глюкагона после перорального введения по сравнению с изогликемическим внутривенным введением глюкозы у пациентов с диабетом 1 типа. Американский журнал физиологии-эндокринологии и метаболизма. 2010;298 (4): E832–E837. [PubMed: 20103744]
- 60.
Исследовательская группа по контролю диабета и осложнений. Натан Д.М., Генут С., Лачин Дж., Клири П., Кроффорд О., Дэвис М., Рэнд Л., Зиберт С. Влияние интенсивного лечения диабета на развитие и прогрессирование долгосрочных осложнений при инсулинозависимом сахарном диабете.
 Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]
Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]- 61.
Cryer PE, Gerich JE. Контррегуляция глюкозы, гипогликемия и интенсивная инсулинотерапия при сахарном диабете. Н. англ. Дж. Мед. 1985;313(4):232–241. [PubMed: 2861565]
- 62.
Sprague JE, Arbeláez AM. Контррегуляторные реакции глюкозы на гипогликемию. Pediatr Endocrinol Rev. 2011;9(1):463–475. [Бесплатная статья PMC: PMC3755377] [PubMed: 22783644]
- 63.
Yosten GLC. Дисфункция альфа-клеток при сахарном диабете 1 типа. Пептиды. 2018;100:54–60. [PubMed: 29412832]
- 64.
Knop FK, Aaboe K, Vilsbøll T, Vølund A, Holst JJ, Krarup T, Madsbad S. Нарушение инкретинового эффекта и гиперглюкагонемия натощак, характерные для пациентов с диабетом 2 типа, являются ранними признаками дисметаболизма. при ожирении. Сахарный диабет Ожирение Metab. 2012;14(6):500–510. [В паблике: 22171657]
- 65.
Albrechtsen NJW, Junker AE, Christensen M, Hædersdal S, Wibrand F, Lund AM, Galsgaard KD, Holst JJ, Knop FK, Vilsbøll T.
 Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]
Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]- 66.
Junker AE, Gluud L, Holst JJ, Knop FK, Vilsbøll T. Диабетические и недиабетические пациенты с неалкогольной жировой болезнью печени имеют нарушенный инкретиновый эффект и гиперглюкагонемию натощак. J Интерн Мед. 2016;279(5): 485–493. [PubMed: 26728692]
- 67.
Suppli MP, Lund A, Bagger JI, Vilsbøll T, Knop FK. Участие индуцированной стеатозом резистентности к глюкагону в гиперглюкагонемии. Мед. Гипотезы. 2016;86:100–103. [PubMed: 26547273]
- 68.
Tillner J, Posch MG, Wagner F, Teichert L, Hijazi Y, Einig C, Keil S, Haack T, Wagner M, Bossart M, Larsen PJ. Новый двойной глюкагоноподобный пептид и агонист рецептора глюкагона SAR425899: результаты рандомизированных плацебо-контролируемых испытаний, проведенных впервые на людях и на пациентах.
 Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300
Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300- ] [CrossRef]
- 69.
Эмбери П., Паркер В.Е., Стамволл М., Пош М.Г., Хайзе Т., Плам-Мёршель Л., Цай Л.Ф., Робертсон Д., Джайн М., Петроне М., Рондиноне С., Хиршберг Б. , Jermutus L. MEDI0382, двойной агонист GLP-1 и рецептора глюкагона, у пациентов с ожирением или избыточным весом с диабетом 2 типа: рандомизированное, контролируемое, двойное слепое исследование с возрастающей дозой и фаза 2а. Ланцет. 2018;391(10140):2607–2618. [PubMed: 29945727]
Физиология глюкагона — Эндотекст — Книжная полка NCBI
РЕЗЮМЕ
Глюкагон представляет собой пептидный гормон, секретируемый альфа-клетками островков Лангерганса поджелудочной железы. Гипогликемия является физиологически наиболее мощным секреторным стимулом, и наиболее известным действием глюкагона является стимуляция продукции глюкозы в печени и, таким образом, поддержание адекватных концентраций глюкозы в плазме. Однако глюкагон также участвует в метаболизме липидов и аминокислот в печени и может увеличивать расход энергии в состоянии покоя. Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
ВВЕДЕНИЕ
Глюкагон, секретируемый альфа-клетками поджелудочной железы в островке Лангерганса, играет важную роль в поддержании гомеостаза глюкозы путем стимуляции продукции глюкозы в печени (1). Таким образом, в отличие от глюкозодепонирующего характера действия инсулина, глюкагон действует как глюкозомобилизующий гормон. В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5).
В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5). Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
СТРУКТУРА И СИНТЕЗ ГЛЮКАГОНА
Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, преимущественно секретируемый альфа-клетками поджелудочной железы. Он получен из предшественника проглюкагона, который может превращаться в ряд родственных пептидных гормонов (12). Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Рисунок 1.
Тканеспецифический процессинг проглюкагона. В поджелудочной железе проглюкагон процессируется в глюкагон, родственный глицентину полипептид поджелудочной железы (GRPP), промежуточный пептид 1 (IP1) и основной фрагмент проглюкагона (MPGF) с помощью фермента процессинга прогормонконвертазы 2 (PC2). В кишечнике и в головном мозге проглюкагон процессируется прогормонконвертазой 1/3 (PC1/3) в глюкагоноподобный пептид 1 (ГПП-1), глюкагоноподобный пептид 2 (ГПП-2), оксинтомодулин, промежуточный пептид 2 ( IP2) и глицентин.
СЕКРЕЦИЯ ГЛЮКАГОНА
Глюкагон секретируется в ответ на гипогликемию, длительное голодание, физические упражнения и прием пищи, богатой белком (10). Высвобождение глюкагона регулируется эндокринными и паракринными путями; по питательным веществам; и вегетативной нервной системой (11). Секреция глюкагона происходит как экзоцитоз запасенных пептидных везикул, инициируемый секреторными стимулами альфа-клетки. Стимулирующие регуляторы высвобождения глюкагона включают гипогликемию, аминокислоты и глюкозозависимый инсулинотропный пептид (ГИП) гормона кишечника, тогда как гипергликемия и ГПП-1 ингибируют высвобождение глюкагона. Кроме того, высвобождение глюкагона ингибируется паракринным образом такими факторами, как соматостатин, инсулин, цинк и, возможно, амилин. Глюкагон может косвенно регулировать собственную секрецию через стимулирующее действие на бета-клетки, чтобы они секретировали инсулин (12,13). В отличие от глюкозы, неглюкозные регуляторы секреции глюкагона, по-видимому, опосредуют свое действие через изменения уровней цАМФ, а не через кальций-зависимый путь, описанный ниже (14,15).
Регуляция секреции глюкагона глюкозой
Наиболее мощным регулятором секреции глюкагона является циркулирующая глюкоза. Гипогликемия стимулирует альфа-клетки поджелудочной железы к высвобождению глюкагона, а гипергликемия ингибирует секрецию глюкагона (11). Клеточный механизм этой глюкозозависимой регуляции секреции глюкагона включает поглощение глюкозы переносчиком глюкозы 1 (GLUT1) в клеточной мембране альфа-клеток поджелудочной железы и последующий гликолиз, который в конечном итоге генерирует аденозинтрифосфат (АТФ) в митохондриях альфа-клетки. . Таким образом, уровень внутриклеточного АТФ в альфа-клетке отражает уровень глюкозы в плазме. Гипогликемия и, как следствие, низкие внутриклеточные уровни АТФ в альфа-клетках закрывают АТФ-чувствительные калиевые каналы (K ATP -каналы), в результате чего отток калия (K + ) снижается. Это вызывает деполяризацию клеточной мембраны, которая, в свою очередь, открывает потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Рисунок 2.
Глюкозозависимая секреция глюкагона альфа-клеткой. При гипогликемии концентрация внутриклеточной глюкозы падает с последующим снижением гликолиз-генерируемого аденозинтрифосфата (АТФ) в митохондриях клетки. Это закрывает АТФ-чувствительный калий (K + ) и внутриклеточная концентрация K + повышается, что деполяризует клеточную мембрану, таким образом открывая потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Концентрация глюкагона в кровотоке
В нормальной физиологии концентрация глюкагона в кровотоке находится в пикомолярном диапазоне. В состоянии натощак при уровне глюкозы в плазме около 5 ммоль/л глюкагон секретируется на базальном уровне, что приводит к концентрации в плазме ниже 20 пмоль/л (16–18). Базальная секреция глюкагона уравновешивает эффект базальной секреции инсулина, что приводит к устойчивому состоянию между поглощением глюкозы и эндогенной выработкой глюкозы натощак; то есть стабильные концентрации глюкозы в крови. Во время физической нагрузки или в случае гипогликемии уровень циркулирующего глюкагона может резко увеличиться в 3-4 раза по сравнению с базальным уровнем, увеличивая соотношение глюкагона и инсулина (12,19).,20) ().
Рисунок 3.
Концентрации глюкагона в ответ на гипогликемию, эугликемию и гипергликемию.
СИГНАЛИЗАЦИЯ РЕЦЕПТОРА ГЛЮКАГОНА
Действие глюкагона опосредовано связыванием и активацией рецептора глюкагона. Рецептор глюкагона представляет собой семь трансмембранных рецепторов, связанных с G-белком (1), преимущественно экспрессируемых в печени, но также обнаруживаемых в различных количествах в почках, сердце (спорно), надпочечниках, жировой ткани (спорно), желудочно-кишечном тракте и поджелудочной железе ( 21). Основной способ внутриклеточной передачи сигналов включает активацию G с и G q . Активация G s стимулирует аденилатциклазу, которая продуцирует циклический аденозинмонофосфат (цАМФ), который активирует протеинкиназу А (ПКА). Активированный PKA мигрирует в ядро и активирует факторы транскрипции, такие как белок, связывающий элемент ответа цАМФ (CREB), посредством фосфорилирования. Это позволяет CREB связываться с ответными элементами генов-мишеней, что приводит к рекрутированию коактиваторов и, в конечном итоге, к экспрессии генов. Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Рисунок 4.
Примеры двух наиболее хорошо описанных внутриклеточных путей, участвующих в глюкагон-индуцированной регуляции экспрессии генов-мишеней: путей PKA и IP 3 . AC, аденилатциклаза; CRTC2, коактиватор транскрипции, регулируемый CREB; CREB, белок, связывающий элемент ответа цАМФ; IP 3, инозитол-1,4,5-трифосфат; PIP 2 , фосфатидилинозитол-4,5-бисфосфат; PKA, протеинкиназа А; PLC, фосфолипаза C.
ДЕГРАДАЦИЯ И ЭЛИМИНАЦИЯ ГЛЮКАГОНА
Разложению глюкагона в основном способствует рецептор-опосредованный эндоцитоз и протеолиз с помощью вездесущего фермента дипептидилпептидазы 4 (22,23). В соответствии с относительной экспрессией рецепторов, печень и почки, по-видимому, представляют собой два основных органа, удаляющих глюкагон из кровообращения. Сообщается, что период полураспада глюкагона в плазме у человека составляет от четырех до семи минут (24, 25).
ДЕЙСТВИЕ ГЛЮКАГОНА
Глюкагон увеличивает выработку глюкозы в печени
Глюкагон регулирует концентрацию глюкозы в плазме во время голодания, физической нагрузки и гипогликемии, увеличивая выход глюкозы печенью в кровоток. В частности, глюкагон способствует превращению гликогена в глюкозу в печени (гликогенолиз), стимулирует синтез глюкозы de novo (глюконеогенез) и ингибирует расщепление глюкозы (гликолиз) и образование гликогена (гликогенез) (26). Производство глюкозы в печени быстро увеличивается в ответ на физиологическое повышение уровня глюкагона; достигается за счет стимуляции гликогенолиза с незначительными острыми изменениями глюконеогенеза (27,28). Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Рисунок 5.
Регуляция метаболизма глюкозы глюкагоном в печени. Глюкагон увеличивает выработку глюкозы в печени, стимулируя гликогенолиз и гликогеногенез (зеленые стрелки), ингибируя гликолиз и гликогенез (красные стрелки).
Глюкагон стимулирует расщепление жирных кислот и ингибирует липогенез в печени
Глюкагон способствует образованию неуглеводных источников энергии в виде липидов и кетоновых тел. Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Глюкагон снижает потребление пищи
Было показано, что однократное введение глюкагона снижает потребление пищи и уменьшает чувство голода (38,39). И наоборот, предпрандиальное ингибирование передачи сигналов глюкагона увеличивает потребление пищи у крыс (40, 41), что свидетельствует о роли глюкагона в регуляции аппетита. Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Глюкагон увеличивает расход энергии
В дополнение к потенциальному влиянию глюкагона на потребление пищи данные свидетельствуют о том, что глюкагон способствует отрицательному энергетическому балансу, стимулируя расход энергии. У людей этот эффект наблюдался в исследованиях, в которых введение глюкагона приводило к увеличению расхода энергии в состоянии покоя (42–44). Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Глюкагон может регулировать частоту сердечных сокращений и сократительную способность
Введение высоких доз глюкагона увеличивает частоту сердечных сокращений и сократительную способность сердца (46). Фактически, инфузия глюкагона в фармакологических дозах (миллиграмм) часто используется при лечении острой сердечной депрессии, вызванной передозировкой антагонистов кальциевых каналов или бета-блокаторов (47), несмотря на ограниченные данные (48). Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Рисунок 6.

Органоспецифическое действие глюкагона. ГИП, глюкозозависимый инсулинотропный полипептид
ГЛЮКАГОН ПАТОФИЗИОЛОГИЯ
Глюкагон при диабете 2 типа
У пациентов с диабетом 2 типа наблюдается нарушение регуляции секреции глюкагона, что в значительной степени способствует диабетической гипергликемии. В частности, диабет 2 типа характеризуется повышенным уровнем глюкагона во время голодания, в то время как подавление глюкагона в ответ на пероральный прием глюкозы нарушено или даже парадоксально повышено (16, 51, 52). Механизмы гиперглюкагонемии до конца не изучены, но обычно объясняются уменьшением подавляющего действия инсулина на альфа-клетки из-за гипоинсулинемии и резистентности к инсулину на уровне альфа-клеток (53, 54). Интересно, что пациенты с диабетом 2 типа, у которых наблюдается гиперглюкагонемический ответ на пероральное введение глюкозы, реагируют нормальным подавлением глюкагона после внутривенного введения глюкозы (16). Это говорит о том, что диабетическая гиперглюкагонемия не может быть объяснена резистентностью альфа-клеток к глюкозе и/или инсулину. Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Рисунок 7.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 2 типа и с нормальной физиологией (здоровые субъекты). Диабет 2 типа характеризуется повышенным уровнем глюкагона в плазме натощак и нарушением подавления уровня глюкагона в плазме в ответ на пероральное введение глюкозы.
Глюкагон при диабете 1 типа
Традиционно диабетическая гипергликемия 1 типа объяснялась селективной потерей массы бета-клеток и, как следствие, снижением секреции инсулина. Однако новые данные указывают на то, что глюкагон играет важную роль в патофизиологии диабета 1 типа. Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы.
Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы. Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Рисунок 8.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 1 типа и с нормальной физиологией (здоровые субъекты). Диабет 1 типа характеризуется повышенными концентрациями глюкагона в ответ на прием пищи или пероральный прием глюкозы.
Гипогликемия является частым и опасным побочным эффектом инсулинотерапии при диабете 1 типа и представляет собой обычное препятствие для достижения гликемического контроля (60). В нормальных физиологических условиях гипогликемия предотвращается несколькими механизмами: 1) снижением секреции инсулина бета-клетками, что снижает поглощение глюкозы периферическими тканями; 2) повышенная секреция глюкагона альфа-клетками, увеличивающая выход глюкозы печенью; и 3) повышенная симпатическая нервная реакция и адреномедуллярная секреция адреналина. Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Глюкагон при ожирении и стеатозе печени
Нарушение регуляции секреции глюкагона наблюдается не только у пациентов с сахарным диабетом 2 типа, но и у лиц с толерантностью к нормоглюкозе с ожирением (64) и у пациентов с неалкогольной жировой болезнью печени (НАЖБП) (65, 66). Это говорит о том, что нарушение регуляции секреции глюкагона может быть связано скорее со стеатозом печени, чем с нарушением регуляции метаболизма глюкозы. Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
PERSPECTIVES
Влияние гиперглюкагонемии на ожирение и НАЖБП возродило научный интерес к действиям глюкагона и роли глюкагона в патофизиологии этих метаболических нарушений. Очевидно, что глюкагон может представлять собой потенциальную мишень для лечения ожирения и НАЖБП. Простым способом сдерживания нежелательного гипергликемического эффекта глюкагона при реализации его действия на липолиз и расход энергии может быть совместное лечение с сахароснижающим препаратом. Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
РЕЗЮМЕ И ВЫВОДЫ
Глюкагон представляет собой глюкорегуляторный пептидный гормон, который противодействует действию инсулина, стимулируя выработку глюкозы в печени и тем самым повышая уровень глюкозы в крови. Кроме того, глюкагон опосредует несколько метаболических эффектов, не связанных с глюкозой, важных для поддержания энергетического баланса всего организма в периоды ограниченного поступления питательных веществ. Эти действия включают мобилизацию энергетических ресурсов посредством печеночного липолиза и кетогенеза; стимуляция метаболизма аминокислот в печени (и связанного с этим уреагенеза). Кроме того, было показано, что глюкагон увеличивает расход энергии и подавляет потребление пищи, но остается неясным, участвует ли эндогенный глюкагон в регуляции этих процессов. Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
ПРИЗНАТЕЛЬНОСТЬ
, создано с использованием шаблонов от Servier Medical Arts, Les Laboratoires Servier (https://smart.servier.com/). Используется по лицензии Creative Commons License 3.0.
ССЫЛКИ
- 1.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 2.
Кимбалл С.П., Мурлин-младший. Водные экстракты поджелудочной железы III. Некоторые реакции преципитации инсулина.
 Дж. Биол. хим. 1923; 58 (1): 337–346.
Дж. Биол. хим. 1923; 58 (1): 337–346.- 3.
Бромер В.В., Шинн Л.Г., Штауб А., Беренс ОК. Аминокислотная последовательность глюкагона. Диабет. 1957; 6 (3): 234–238. [PubMed: 13427628]
- 4.
Блэкман Б. Использование глюкагона в терапии инсулиновой комы. Psychiatr Q. 1961; 35: 482–487. [PubMed: 13869689]
- 5.
Эскибель А.Дж., Курланд А.А., Мендельсон Д. Использование глюкагона для прерывания инсулиновой комы. Dis Nerv Syst. 1958;19(11):485–486. [PubMed: 13586175]
- 6.
Unger RH, Eisentraut AM. МАККОЛ М.С., Мэдисон Л.Л. Антитела к глюкагону и иммуноанализ на глюкагон. Дж. Клин. Инвестировать. 1961; 40: 1280–1289. [Статья бесплатно PMC: PMC2
] [PubMed: 13779204]- 7.
Unger RH, Orci L. Существенная роль глюкагона в патогенезе сахарного диабета. Ланцет. 1975;1(7897):14–16. [PubMed: 46337]
- 8.
Drucker DJ, Asa S. Экспрессия гена глюкагона в мозге позвоночных.
 Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 2
Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 24]
- 9.
Мойсов С., Генрих Г., Уилсон И.Б., Раваццола М., Орси Л., Хабенер Дж.Ф. Экспрессия гена препроглюкагона в поджелудочной железе и кишечнике диверсифицируется на уровне посттрансляционного процессинга. Дж. Биол. хим. 1986;261(25):11880–11889. [PubMed: 3528148]
- 10.
Герич Дж. Э., Лоренци М., Хейн С., Густафсон Г., Гийемин Р., Форшам Р. Х. Доказательства физиологической роли глюкагона поджелудочной железы в гомеостазе глюкозы у человека: исследования соматостатина. Метаб. клин. Эксп. 1975;24(2):175–182. [PubMed: 1113681]
- 11.
Громада Дж., Франклин И., Воллхейм CB. Альфа-клетки эндокринной поджелудочной железы: 35 лет исследований, но загадка остается. Эндокр. 2007;28(1):84–116. [PubMed: 17261637]
- 12.
Müller TD, Finan B, Clemmensen C, DiMarchi RD, Tschöp MH. Новая биология и фармакология глюкагона. Физиологические обзоры.
 2017;97(2):721–766. [PubMed: 28275047]
2017;97(2):721–766. [PubMed: 28275047]- 13.
Wewer Albrechtsen NJ, Kuhre RE, Pedersen J, Knop FK, Holst JJ. Биология глюкагона и последствия гиперглюкагонемии. Биомаркеры в медицине. 2016;10(11):1141–1151. [PubMed: 27611762]
- 14.
Громада Дж., Шабоссо П., Раттер Г.А. α-клетка при сахарном диабете. Нат Рев Эндокринол. 2018. [PubMed: 30310153] [Перекрестная ссылка]
- 15.
Hughes JW, Ustione A, Lavagnino Z, Piston DW. Регуляция секреции островкового глюкагона: Помимо кальция. Диабет, ожирение и обмен веществ. 20 (С2): 127–136. [Статья бесплатно PMC: PMC6148361] [PubMed: 30230183]
- 16.
Knop FK, Vilsbøll T, Madsbad S, Holst JJ, Krarup T. Несоответствующее подавление глюкагона во время OGTT, но не во время изогликемического внутривенного введения. инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]
- 17.

Лунд А., Баггер Дж.И., Альбрехтсен Н.Дж.В., Кристенсен М., Грондаль М., Хартманн Б., Мэтисен Э.Р., Хансен К.П., Сторкхольм Дж.Х., Холл Г., ван, Рехфельд Д.Ф., Хорнбург Д.Ф. , Мейснер Ф., Манн М., Ларсен С., Холст Дж. Дж., Вилсбёлль Т., Кноп Ф. К. Доказательства внепанкреатической секреции глюкагона у человека. Диабет. 2016;65(3):585–597. [PubMed: 26672094]
- 18.
Миячи А., Кобаяши М., Миено Э., Гото М., Фурусава К., Инагаки Т., Китамура Т. Точный аналитический метод определения уровня глюкагона в плазме человека с использованием жидкостной хроматографии и масс-спектрометрии высокого разрешения : сравнение с коммерчески доступными иммуноанализами. Анальный биоанальный хим. 2017;409(25): 5911–5918. [PubMed: 28801845]
- 19.
Hansen JS, Pedersen BK, Xu G, Lehmann R, Weigert C, Plomgaard P. Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа .
 Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]
Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]- 20.
Schwartz NS, Clutter WE, Shah SD, Cryer PE. Гликемические пороги для активации систем контррегуляции глюкозы выше, чем пороги для симптомов. Джей Клин Инвест. 1987;79(3):777–781. [Статья бесплатно PMC: PMC424197] [PubMed: 3546378]
- 21.
Свобода М., Тастеной М., Вертонген П., Робберехт П. Относительный количественный анализ мРНК рецептора глюкагона в тканях крыс. Мол. Клетка. Эндокринол. 1994;105(2):131–137. [PubMed: 7859919]
- 22.
Сандовал Д.А., Д’Алессио Д.А. Физиология пептидов проглюкагона: роль глюкагона и GLP-1 в норме и болезни. Физиол. 2015; 95 (2): 513–548. [В паблике: 25834231]
- 23.
Посписилик Дж.А., Хинке С.А., Педерсон Р.А., Хоффманн Т., Роше Ф., Шленциг Д., Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141.
 [PubMed: 11111019]
[PubMed: 11111019]- 24.
Pontiroli AE, Calderara A, Perfetti MG, Bareggi SR. Фармакокинетика интраназального, внутримышечного и внутривенного глюкагона у здоровых людей и больных сахарным диабетом. Евро. Дж. Клин. Фармакол. 1993;45(6):555–558. [PubMed: 8157042]
- 25.
Лунд А., Баггер Дж.И., Альбрехтсен Н.В., Кристенсен М., Грондаль М., Хансен С.П., Сторкхольм Дж.Х., Холст Дж.Дж., Вилсбёлл Т., Кноп Ф.К. Повышенное содержание жира в печени у пациентов с тотальной панкреэктомией. Диабет. 2017;67 Дополнение 1:2600. -паб.
- 26.
Унгер Р.Х. Физиология и патофизиология глюкагона в свете новых достижений. Диабетология. 1985;28(8):574–578. [PubMed: 3
- 6]
- 27.
Миллер Р.А., Бирнбаум М.Дж. Глюкагон: острые действия на печеночный метаболизм. Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]
- 28.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени.
 Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]- 29.
Руи Л. Энергетический обмен в печени. сост. физиол. 2014;4(1):177–19.7. [Бесплатная статья PMC: PMC4050641] [PubMed: 246]
- 30.
Geisler CE, Renquist BJ. Накопление липидов в печени: причина и следствие нарушения регуляции глюкорегуляторных гормонов. J Эндокринол. 2017;234(1):R1–R21. [PubMed: 28428362]
- 31.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 32.
Longuet C, Sinclair EM, Maida A, Baggio LL, Maziarz M, Charron MJ, Drucker DJ. Рецептор глюкагона необходим для адаптивного метаболического ответа на голодание. Клеточный метаболизм. 2008;8(5):359–371. [Бесплатная статья PMC: PMC2593715] [PubMed: 1
68]
- 33.

Wang H, Zhao M, Sud N, Christian P, Shen J, Song Y, Pashaj A, Zhang K, Carr T, Su Q. Глюкагон регулирует метаболизм липидов в печени посредством передачи сигналов цАМФ и Insig-2: значение для патогенеза гипертриглицеридемии и стеатоза печени. Научный доклад 2016; 6: 32246. [Бесплатная статья PMC: PMC5007496] [PubMed: 27582413]
- 34.
Galsgaard KD, Pedersen J, Knop FK, Holst JJ, Wewer Albrechtsen NJ. Сигнализация рецептора глюкагона и метаболизм липидов. Фронт Физиол. 2019;10 [Бесплатная статья PMC: PMC64
- ] [PubMed: 31068828] [CrossRef]
- 35.
Holst JJ, Albrechtsen NJW, Pedersen J, Knop FK. Глюкагон и аминокислоты связаны циклом взаимной обратной связи: ось печень-α-клетка. Диабет. 2017;66(2):235–240. [PubMed: 28108603]
- 36.
Hamberg O, Vilstrup H. Регуляция синтеза мочевины глюкозой и глюкагоном у здорового человека. Клин Нутр. 1994;13(3):183–191. [PubMed: 16843380]
- 37.

Соллоуэй М.Дж., Маджиди А., Гу С., Истхэм-Андерсон Дж., Кларк Х.Дж., Клявин Н., Завала-Солорио Дж., Кейтс Л., Фридман Б., Брауэр М., Ван Дж., Фин О., Колумам Г., Стерн Х., Лоу Дж. Б., Петерсон А. С., Аллан Б. Б. Глюкагон связывает катаболизм аминокислот в печени с mTOR-зависимой регуляцией массы α-клеток. Cell Rep. 2015;12(3):495–510. [PubMed: 26166562]
- 38.
Bagger JI, Holst JJ, Hartmann B, Andersen B, Knop FK, Vilsbøll T. Влияние оксинтомодулина, глюкагона, GLP-1 и комбинированной инфузии глюкагона + GLP-1 на Потребление пищи, аппетит и расход энергии в состоянии покоя. J Clin Endocrinol Metab. 2015;100(12):4541–4552. [PubMed: 26445112]
- 39.
Geary N, Kissileff HR, Pi-Sunyer FX, Hinton V. Индивидуальные, но не одновременные инфузии глюкагона и холецистокинина подавляют прием пищи у мужчин. Являюсь. Дж. Физиол. 1992; 262 (6 ч. 2): R975–980. [PubMed: 1621876]
- 40.
Langhans W, Zeiger U, Scharrer E, Geary N.
 Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]
Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]- 41.
Le Sauter J, Noh U, Geary N. Инфузия антител к глюкагону в порт печени увеличивает количество спонтанного приема пищи у крыс. Являюсь. Дж. Физиол. 1991; 261 (1 часть 2): R162–165. [PubMed: 1858943]
- 42.
Наир К.С. Гиперглюкагонемия увеличивает скорость метаболизма в покое у человека при дефиците инсулина. J Clin Endocrinol Metab. 1987;64(5):896–901. [PubMed: 2881943]
- 43.
Салем В., Иззи-Энгбея С., Коэлло С., Томас Д.Б., Чемберс Э.С., Комнинос А.Н., Бакли А., Вин З., Аль-Наххас А., Рабинер Э.А., Ганн Р.Н., Бадж Х., Саймондс М.Е., Блум С.Р., Тан Т.М., Дхилло В.С. Глюкагон увеличивает расход энергии независимо от активации бурой жировой ткани у человека. Сахарный диабет Ожирение Metab. 2016;18(1):72–81. [Бесплатная статья PMC: PMC4710848] [PubMed: 26434748]
- 44.

Tan TM, Field BCT, McCullough KA, Troke RC, Chambers ES, Salem V, Gonzalez Maffe J, Baynes KCR, De Silva A, Viardot A, Alsafi A, Frost GS, Ghatei MA, Bloom СР. Совместное введение глюкагоноподобного пептида-1 во время инфузии глюкагона у людей приводит к увеличению расхода энергии и уменьшению гипергликемии. Диабет. 2013;62(4):1131–1138. [PMC бесплатная статья: PMC3609580] [PubMed: 23248172]
- 45.
Habegger KM, Stemmer K, Cheng C, Müller TD, Heppner KM, Ottaway N, Holland J, Hembree JL, Smiley D, Gelfanov V, Кришна Р., Арафат А.М., Конкар А., Белли С., Каппс М., Вудс С.К., Хофманн С.М., Д’Алессио Д., Пфлюгер П.Т., Перес-Тильве Д., Сили Р.Дж., Кониши М., Ито Н., Харитоненков А., Спрангер Дж., ДиМарчи РД, Чеп МХ. Фактор роста фибробластов 21 опосредует специфические действия глюкагона. Диабет. 2013;62(5):1453–1463. [Бесплатная статья PMC: PMC3636653] [PubMed: 23305646]
- 46.
Ceriello A, Genovese S, Mannucci E, Gronda E.
 Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]
Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]- 47.
Graudins A, Lee HM, Druda D. Передозировка антагонистов кальциевых каналов и бета-блокаторов: антидоты и дополнительная терапия. Бр Дж Клин Фармакол. 2016;81(3):453–461. [Бесплатная статья PMC: PMC4767195] [PubMed: 26344579]
- 48.
Мейдал Петерсен К., Бегевиг С., Холст Дж. Дж., Кноп Ф. К., Кристенсен М. Б. Гемодинамические эффекты глюкагона — обзор литературы. Дж. Клин. Эндокринол. Метаб. 2018. [PubMed: 29546411] [CrossRef]
- 49.
Thuesen L, Christiansen JS, Sørensen KE, Orskov H, Henningsen P. Внутривенное введение низких доз глюкагона не влияет на сократимость миокарда у здорового человека. Эхокардиографическое исследование. Сканд. Дж. Клин. лаборатория Инвестировать. 1988;48(1):71–75. [PubMed: 3064277]
- 50.
Казда СМ.
 Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]
Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]- 51.
Лунд А., Баггер Дж.И., Кристенсен М., Грондаль М., ван Холл Г., Холст Дж.Дж., Вильсбёлл Т., Кноп Ф.К. Более высокая продукция эндогенной глюкозы во время ПГТТ по сравнению с изогликемическим внутривенным вливанием глюкозы. J Clin Endocrinol Metab. 2016;101(11):4377–4384. [В паблике: 27533305]
- 52.
Reaven GM, Chen YD, Golay A, Swislocki AL, Jaspan JB. Документирование гиперглюкагонемии в течение дня у пациентов без ожирения и ожирения с инсулиннезависимым сахарным диабетом. Дж. Клин. Эндокринол. Метаб. 1987;64(1):106–110. [PubMed: 3536980]
- 53.
Даннинг Б.Е., Герих Дж.Е. Роль нарушения регуляции альфа-клеток в голодании и постпрандиальной гипергликемии при диабете 2 типа и терапевтических последствиях.
 Эндокр. 2007;28(3):253–283. [В паблике: 17409288]
Эндокр. 2007;28(3):253–283. [В паблике: 17409288]- 54.
Hamaguchi T, Fukushima H, Uehara M, Wada S, Shirotani T, Kishikawa H, Ichinose K, Yamaguchi K, Shichiri M. Аномальный ответ глюкагона на аргинин и его нормализация у пациентов с ожирением и гиперинсулинемией с непереносимость глюкозы: важность действия инсулина на альфа-клетки поджелудочной железы. Диабетология. 1991;34(11):801–806. [PubMed: 1769438]
- 55.
Кноп Ф.К. EJE PRIZE 2018: Интуитивное мнение о глюкагоне. Евро. Дж. Эндокринол. 2018;178(6):R267–R280. [В паблике: 29678923]
- 56.
Лунд А., Вилсбёлл Т., Баггер Дж.И., Холст Дж.Дж., Кноп Ф.К. Отдельное и комбинированное влияние кишечных гормонов, ГИП, ГПП-1 и ГПП-2, на секрецию глюкагона при диабете 2 типа. Являюсь. Дж. Физиол. Эндокринол. Метаб. 2011; 300(6):E1038–1046. [PubMed: 21386059]
- 57.
Cryer PE. Миниобзор: Глюкагон в патогенезе гипогликемии и гипергликемии при диабете.
 Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]
Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]- 58.
Li K, Song W, Wu X, Gu D, Zang P, Gu P, Lu B, Shao J. Ассоциации уровня глюкагона в сыворотке крови с гликемической изменчивостью при диабете 1 типа с разной продолжительностью заболевания . Эндокринный. 2018;61(3):473–481. [PubMed: 292]
- 59.
Заяц К.Дж., Вилсбёлл Т., Холст Дж.Дж., Кноп Ф.К. Неадекватная реакция глюкагона после перорального введения по сравнению с изогликемическим внутривенным введением глюкозы у пациентов с диабетом 1 типа. Американский журнал физиологии-эндокринологии и метаболизма. 2010;298 (4): E832–E837. [PubMed: 20103744]
- 60.
Исследовательская группа по контролю диабета и осложнений. Натан Д.М., Генут С., Лачин Дж., Клири П., Кроффорд О., Дэвис М., Рэнд Л., Зиберт С. Влияние интенсивного лечения диабета на развитие и прогрессирование долгосрочных осложнений при инсулинозависимом сахарном диабете.
 Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]
Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]- 61.
Cryer PE, Gerich JE. Контррегуляция глюкозы, гипогликемия и интенсивная инсулинотерапия при сахарном диабете. Н. англ. Дж. Мед. 1985;313(4):232–241. [PubMed: 2861565]
- 62.
Sprague JE, Arbeláez AM. Контррегуляторные реакции глюкозы на гипогликемию. Pediatr Endocrinol Rev. 2011;9(1):463–475. [Бесплатная статья PMC: PMC3755377] [PubMed: 22783644]
- 63.
Yosten GLC. Дисфункция альфа-клеток при сахарном диабете 1 типа. Пептиды. 2018;100:54–60. [PubMed: 29412832]
- 64.
Knop FK, Aaboe K, Vilsbøll T, Vølund A, Holst JJ, Krarup T, Madsbad S. Нарушение инкретинового эффекта и гиперглюкагонемия натощак, характерные для пациентов с диабетом 2 типа, являются ранними признаками дисметаболизма. при ожирении. Сахарный диабет Ожирение Metab. 2012;14(6):500–510. [В паблике: 22171657]
- 65.
Albrechtsen NJW, Junker AE, Christensen M, Hædersdal S, Wibrand F, Lund AM, Galsgaard KD, Holst JJ, Knop FK, Vilsbøll T.
 Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]
Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]- 66.
Junker AE, Gluud L, Holst JJ, Knop FK, Vilsbøll T. Диабетические и недиабетические пациенты с неалкогольной жировой болезнью печени имеют нарушенный инкретиновый эффект и гиперглюкагонемию натощак. J Интерн Мед. 2016;279(5): 485–493. [PubMed: 26728692]
- 67.
Suppli MP, Lund A, Bagger JI, Vilsbøll T, Knop FK. Участие индуцированной стеатозом резистентности к глюкагону в гиперглюкагонемии. Мед. Гипотезы. 2016;86:100–103. [PubMed: 26547273]
- 68.
Tillner J, Posch MG, Wagner F, Teichert L, Hijazi Y, Einig C, Keil S, Haack T, Wagner M, Bossart M, Larsen PJ. Новый двойной глюкагоноподобный пептид и агонист рецептора глюкагона SAR425899: результаты рандомизированных плацебо-контролируемых испытаний, проведенных впервые на людях и на пациентах.
 Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300
Сахарный диабет Ожирение Metab. 2018.
[Пубмед: 300- ] [CrossRef]
- 69.
Эмбери П., Паркер В.Е., Стамволл М., Пош М.Г., Хайзе Т., Плам-Мёршель Л., Цай Л.Ф., Робертсон Д., Джайн М., Петроне М., Рондиноне С., Хиршберг Б. , Jermutus L. MEDI0382, двойной агонист GLP-1 и рецептора глюкагона, у пациентов с ожирением или избыточным весом с диабетом 2 типа: рандомизированное, контролируемое, двойное слепое исследование с возрастающей дозой и фаза 2а. Ланцет. 2018;391(10140):2607–2618. [PubMed: 29945727]
Физиология глюкагона — Эндотекст — Книжная полка NCBI
РЕЗЮМЕ
Глюкагон представляет собой пептидный гормон, секретируемый альфа-клетками островков Лангерганса поджелудочной железы. Гипогликемия является физиологически наиболее мощным секреторным стимулом, и наиболее известным действием глюкагона является стимуляция продукции глюкозы в печени и, таким образом, поддержание адекватных концентраций глюкозы в плазме. Однако глюкагон также участвует в метаболизме липидов и аминокислот в печени и может увеличивать расход энергии в состоянии покоя. Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
Основываясь на эффектах экзогенного глюкагона, вызывающих чувство сытости и снижающих потребление пищи, также была предложена роль глюкагона в регуляции аппетита. В этой главе представлен обзор структуры, секреции, деградации и элиминации глюкагона, а также рассмотрены действия глюкагона, включая его роль в метаболизме глюкозы и его влияние на липолиз, кетогенез, расход энергии, аппетит и прием пищи. Наконец, обсуждается роль глюкагона в патофизиологии диабета, ожирения и стеатоза печени, а также описываются новые методы лечения этих состояний на основе глюкагона. Для полного охвата всех смежных областей эндокринологии посетите наш БЕСПЛАТНЫЙ онлайн-текст WWW.ENDOTEXT.ORG.
ВВЕДЕНИЕ
Глюкагон, секретируемый альфа-клетками поджелудочной железы в островке Лангерганса, играет важную роль в поддержании гомеостаза глюкозы путем стимуляции продукции глюкозы в печени (1). Таким образом, в отличие от глюкозодепонирующего характера действия инсулина, глюкагон действует как глюкозомобилизующий гормон. В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5).
В соответствии с этими противоположными действиями высокие концентрации глюкозы в плазме, стимулирующие секрецию инсулина бета-клетками поджелудочной железы, ингибируют секрецию глюкагона, тогда как низкие концентрации глюкозы в плазме представляют собой один из наиболее мощных стимулов секреции глюкагона. Соответственно, нормальные концентрации глюкозы в плазме в значительной степени зависят от сбалансированной секреции инсулина и глюкагона бета-клетками и альфа-клетками поджелудочной железы соответственно. Гипергликемический эффект глюкагона был описан еще в 1922 Кимбалла и Мурлина, которые открыли гипергликемический фактор в экстрактах поджелудочной железы и назвали этот фактор « глюк оза назад нист», отсюда и название глюкагон (2). В 1950-х годах глюкагон был очищен и кристаллизован в Eli Lilly and Co., а вскоре после этого была определена аминокислотная последовательность пептида (3). Это привело к развитию медицинского применения глюкагона для лечения тяжелой индуцированной инсулином гипогликемии (4,5). Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
Разработка радиоиммуноанализа для обнаружения глюкагона в 1959 стимулировало дальнейшие исследования физиологии глюкагона и его роли в норме и заболевании (6). Было обнаружено, что у пациентов с диабетом наблюдается повышенный уровень глюкагона, что привело к «бигормональной гипотезе», утверждающей, что сочетание гипоинсулинемии и гиперглюкагонемии представляет собой центральную патофизиологическую детерминанту диабетической гипергликемии (7). С тех пор стало очевидно, что глюкагон действует не только за счет увеличения продукции глюкозы в печени, но и влияет на общий энергетический гомеостаз в периоды ограниченного снабжения энергией, стимулируя катаболизм липидов и белков, снижая аппетит и потребление пищи и увеличивая расход энергии.
СТРУКТУРА И СИНТЕЗ ГЛЮКАГОНА
Глюкагон представляет собой пептидный гормон, состоящий из 29 аминокислот, преимущественно секретируемый альфа-клетками поджелудочной железы. Он получен из предшественника проглюкагона, который может превращаться в ряд родственных пептидных гормонов (12). Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Проглюкагон экспрессируется в альфа-клетках островков поджелудочной железы, кишечных энтероэндокринных L-клетках и в незначительной степени в нейронах ствола головного мозга и гипоталамуса (8,9). Процессинг проглюкагона осуществляется ферментами процессинга прогормонконвертазы 1/3 (PC1/3) и прогормонконвертазы 2 (PC2) соответственно. В поджелудочной железе PC2 превращает проглюкагон в глюкагон, в то время как обработка проглюкагона в кишечнике и головном мозге осуществляется PC1, что приводит к образованию глюкагоноподобного пептида 1 (GLP-1) и глюкагоноподобного пептида 2 (GLP-2). 9).
Рисунок 1.
Тканеспецифический процессинг проглюкагона. В поджелудочной железе проглюкагон процессируется в глюкагон, родственный глицентину полипептид поджелудочной железы (GRPP), промежуточный пептид 1 (IP1) и основной фрагмент проглюкагона (MPGF) с помощью фермента процессинга прогормонконвертазы 2 (PC2). В кишечнике и в головном мозге проглюкагон процессируется прогормонконвертазой 1/3 (PC1/3) в глюкагоноподобный пептид 1 (ГПП-1), глюкагоноподобный пептид 2 (ГПП-2), оксинтомодулин, промежуточный пептид 2 ( IP2) и глицентин.
СЕКРЕЦИЯ ГЛЮКАГОНА
Глюкагон секретируется в ответ на гипогликемию, длительное голодание, физические упражнения и прием пищи, богатой белком (10). Высвобождение глюкагона регулируется эндокринными и паракринными путями; по питательным веществам; и вегетативной нервной системой (11). Секреция глюкагона происходит как экзоцитоз запасенных пептидных везикул, инициируемый секреторными стимулами альфа-клетки. Стимулирующие регуляторы высвобождения глюкагона включают гипогликемию, аминокислоты и глюкозозависимый инсулинотропный пептид (ГИП) гормона кишечника, тогда как гипергликемия и ГПП-1 ингибируют высвобождение глюкагона. Кроме того, высвобождение глюкагона ингибируется паракринным образом такими факторами, как соматостатин, инсулин, цинк и, возможно, амилин. Глюкагон может косвенно регулировать собственную секрецию через стимулирующее действие на бета-клетки, чтобы они секретировали инсулин (12,13). В отличие от глюкозы, неглюкозные регуляторы секреции глюкагона, по-видимому, опосредуют свое действие через изменения уровней цАМФ, а не через кальций-зависимый путь, описанный ниже (14,15).
Регуляция секреции глюкагона глюкозой
Наиболее мощным регулятором секреции глюкагона является циркулирующая глюкоза. Гипогликемия стимулирует альфа-клетки поджелудочной железы к высвобождению глюкагона, а гипергликемия ингибирует секрецию глюкагона (11). Клеточный механизм этой глюкозозависимой регуляции секреции глюкагона включает поглощение глюкозы переносчиком глюкозы 1 (GLUT1) в клеточной мембране альфа-клеток поджелудочной железы и последующий гликолиз, который в конечном итоге генерирует аденозинтрифосфат (АТФ) в митохондриях альфа-клетки. . Таким образом, уровень внутриклеточного АТФ в альфа-клетке отражает уровень глюкозы в плазме. Гипогликемия и, как следствие, низкие внутриклеточные уровни АТФ в альфа-клетках закрывают АТФ-чувствительные калиевые каналы (K ATP -каналы), в результате чего отток калия (K + ) снижается. Это вызывает деполяризацию клеточной мембраны, которая, в свою очередь, открывает потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Это увеличивает внутриклеточные уровни Ca 2+ , основного триггера для экзоцитоза гранул глюкагона из альфа-клеток (4). И наоборот, увеличение уровня циркулирующей глюкозы увеличивает приток глюкозы к альфа-клеткам, вызывая увеличение внутриклеточной концентрации АТФ, что открывает K АТП -каналы. Это приводит к мембранному потенциалу, который закрывает потенциалзависимые каналы Ca 2+ , тем самым предотвращая приток Ca 2+ и секрецию глюкагона (12).
Рисунок 2.
Глюкозозависимая секреция глюкагона альфа-клеткой. При гипогликемии концентрация внутриклеточной глюкозы падает с последующим снижением гликолиз-генерируемого аденозинтрифосфата (АТФ) в митохондриях клетки. Это закрывает АТФ-чувствительный калий (K + ) и внутриклеточная концентрация K + повышается, что деполяризует клеточную мембрану, таким образом открывая потенциалзависимые каналы Ca 2+ , обеспечивая приток Ca 2+ . Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Увеличение внутриклеточной концентрации Ca 2+ запускает секрецию глюкагона посредством экзоцитоза. ∆Vm, изменение мембранного потенциала (т.е. деполяризация клеточной мембраны).
Концентрация глюкагона в кровотоке
В нормальной физиологии концентрация глюкагона в кровотоке находится в пикомолярном диапазоне. В состоянии натощак при уровне глюкозы в плазме около 5 ммоль/л глюкагон секретируется на базальном уровне, что приводит к концентрации в плазме ниже 20 пмоль/л (16–18). Базальная секреция глюкагона уравновешивает эффект базальной секреции инсулина, что приводит к устойчивому состоянию между поглощением глюкозы и эндогенной выработкой глюкозы натощак; то есть стабильные концентрации глюкозы в крови. Во время физической нагрузки или в случае гипогликемии уровень циркулирующего глюкагона может резко увеличиться в 3-4 раза по сравнению с базальным уровнем, увеличивая соотношение глюкагона и инсулина (12,19).,20) ().
Рисунок 3.
Концентрации глюкагона в ответ на гипогликемию, эугликемию и гипергликемию.
СИГНАЛИЗАЦИЯ РЕЦЕПТОРА ГЛЮКАГОНА
Действие глюкагона опосредовано связыванием и активацией рецептора глюкагона. Рецептор глюкагона представляет собой семь трансмембранных рецепторов, связанных с G-белком (1), преимущественно экспрессируемых в печени, но также обнаруживаемых в различных количествах в почках, сердце (спорно), надпочечниках, жировой ткани (спорно), желудочно-кишечном тракте и поджелудочной железе ( 21). Основной способ внутриклеточной передачи сигналов включает активацию G с и G q . Активация G s стимулирует аденилатциклазу, которая продуцирует циклический аденозинмонофосфат (цАМФ), который активирует протеинкиназу А (ПКА). Активированный PKA мигрирует в ядро и активирует факторы транскрипции, такие как белок, связывающий элемент ответа цАМФ (CREB), посредством фосфорилирования. Это позволяет CREB связываться с ответными элементами генов-мишеней, что приводит к рекрутированию коактиваторов и, в конечном итоге, к экспрессии генов. Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Активация G q глюкагоном приводит к активации фосфолипазы С (PLC) и последующему увеличению инозитол-1,4,5-трифосфата (IP 3 ), что сигнализирует об усилении высвобождения кальция из эндоплазматического ретикулума. Это, в свою очередь, активирует нижестоящие сигнальные каскады, включая коактиватор транскрипции, регулируемый CREB (CRTC2), который усиливает экспрессию CREB-зависимых генов. В дополнение к пути CREB-CRTC2 глюкагон может передавать сигналы через различные другие пути, подробно рассмотренные в другом месте (1,12,22).
Рисунок 4.
Примеры двух наиболее хорошо описанных внутриклеточных путей, участвующих в глюкагон-индуцированной регуляции экспрессии генов-мишеней: путей PKA и IP 3 . AC, аденилатциклаза; CRTC2, коактиватор транскрипции, регулируемый CREB; CREB, белок, связывающий элемент ответа цАМФ; IP 3, инозитол-1,4,5-трифосфат; PIP 2 , фосфатидилинозитол-4,5-бисфосфат; PKA, протеинкиназа А; PLC, фосфолипаза C.
ДЕГРАДАЦИЯ И ЭЛИМИНАЦИЯ ГЛЮКАГОНА
Разложению глюкагона в основном способствует рецептор-опосредованный эндоцитоз и протеолиз с помощью вездесущего фермента дипептидилпептидазы 4 (22,23). В соответствии с относительной экспрессией рецепторов, печень и почки, по-видимому, представляют собой два основных органа, удаляющих глюкагон из кровообращения. Сообщается, что период полураспада глюкагона в плазме у человека составляет от четырех до семи минут (24, 25).
ДЕЙСТВИЕ ГЛЮКАГОНА
Глюкагон увеличивает выработку глюкозы в печени
Глюкагон регулирует концентрацию глюкозы в плазме во время голодания, физической нагрузки и гипогликемии, увеличивая выход глюкозы печенью в кровоток. В частности, глюкагон способствует превращению гликогена в глюкозу в печени (гликогенолиз), стимулирует синтез глюкозы de novo (глюконеогенез) и ингибирует расщепление глюкозы (гликолиз) и образование гликогена (гликогенез) (26). Производство глюкозы в печени быстро увеличивается в ответ на физиологическое повышение уровня глюкагона; достигается за счет стимуляции гликогенолиза с незначительными острыми изменениями глюконеогенеза (27,28). Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Эта способность глюкагона имеет решающее значение для спасающего жизнь контррегуляторного ответа на тяжелую гипогликемию. Кроме того, это ключевой фактор в обеспечении адекватной циркулирующей глюкозы для функции мозга и для работы мышц во время упражнений (28). При длительном голодании запасы гликогена истощаются, и вступает в действие глюконеогенез (29).). Гипергликемическое свойство глюкагона усиливается, когда уровень гликогена в печени высок, и уменьшается, когда уровень гликогена в печени низкий, в условиях голодания или заболеваний печени, таких как цирроз (12).
Рисунок 5.
Регуляция метаболизма глюкозы глюкагоном в печени. Глюкагон увеличивает выработку глюкозы в печени, стимулируя гликогенолиз и гликогеногенез (зеленые стрелки), ингибируя гликолиз и гликогенез (красные стрелки).
Глюкагон стимулирует расщепление жирных кислот и ингибирует липогенез в печени
Глюкагон способствует образованию неуглеводных источников энергии в виде липидов и кетоновых тел. Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Таким образом, глюкагон способствует стабильному энергетическому гомеостазу в условиях, когда поступление энергии ограничено (голодание) или в состояниях с повышенным потреблением энергии (например, при физической нагрузке или воздействии холода) (12). В частности, во время потребности в энергии глюкагон усиливает расщепление жирных кислот до молекул ацетил-коэнзима А (бета-окисление) в печени. Эти промежуточные продукты либо восстанавливаются с образованием АТФ в цикле трикарбоновых кислот, либо превращаются в кетоновые тела (кетогенез) — процесс, также стимулируемый глюкагоном. (30–34). Кроме того, передача сигналов глюкагона ингибирует de novo липогенез путем инактивации фермента, который катализирует первую стадию синтеза жирных кислот из других субстратов, таких как углеводы (34).
Глюкагон снижает потребление пищи
Было показано, что однократное введение глюкагона снижает потребление пищи и уменьшает чувство голода (38,39). И наоборот, предпрандиальное ингибирование передачи сигналов глюкагона увеличивает потребление пищи у крыс (40, 41), что свидетельствует о роли глюкагона в регуляции аппетита. Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Несколько нелогично, что глюкагон должен снижать потребление пищи, учитывая, что уровни глюкагона обычно повышаются натощак и снижаются во время еды. Таким образом, наблюдаемый эффект при введении глюкагона (в супрафизиологических концентрациях) может быть частично обусловлен перекрестной реактивностью с рецептором GLP-1 (что обычно приводит к подавлению приема пищи) (12). Механизм потенциального снижения аппетита глюкагоном до конца не ясен, но он может быть связан с метаболическими изменениями в печени, вызванными глюкагоном, или с глюкагоном, действующим непосредственно в центральной нервной системе (31).
Глюкагон увеличивает расход энергии
В дополнение к потенциальному влиянию глюкагона на потребление пищи данные свидетельствуют о том, что глюкагон способствует отрицательному энергетическому балансу, стимулируя расход энергии. У людей этот эффект наблюдался в исследованиях, в которых введение глюкагона приводило к увеличению расхода энергии в состоянии покоя (42–44). Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Однако влияние эндогенного глюкагона на расход энергии в покое остается неясным. Кроме того, точные механизмы увеличения расхода энергии в покое, вызванного экзогенным глюкагоном, еще предстоит определить. Было высказано предположение, что глюкагон активирует бурую жировую ткань (12), однако недавно это было подвергнуто сомнению в исследовании 9.0406 in vivo , в котором не было обнаружено прямого воздействия глюкагона на бурую жировую ткань (43). Исследования на грызунах показывают, что действия глюкагона по увеличению расхода энергии могут быть частично косвенно опосредованы фактором роста фибробластов 21 (FGF21), поскольку вызванное глюкагоном увеличение расхода энергии устраняется у животных с делецией рецептора FGF21 (45).
Глюкагон может регулировать частоту сердечных сокращений и сократительную способность
Введение высоких доз глюкагона увеличивает частоту сердечных сокращений и сократительную способность сердца (46). Фактически, инфузия глюкагона в фармакологических дозах (миллиграмм) часто используется при лечении острой сердечной депрессии, вызванной передозировкой антагонистов кальциевых каналов или бета-блокаторов (47), несмотря на ограниченные данные (48). Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Для сравнения, концентрации глюкагона в пределах нормального физиологического диапазона, по-видимому, не влияют на частоту сердечных сокращений или сократительную способность (49).) и любая физиологическая роль эндогенного глюкагона в регуляции частоты пульса остается под вопросом. Это подтверждается исследованиями, изучающими влияние антагонистов рецепторов глюкагона на лечение диабета 2 типа, при которых не наблюдалось влияния на частоту пульса (50). Тем не менее, остается неизвестным, оказывают ли повышенные концентрации глюкагона устойчивый эффект на сердце. Следует отметить, что в большинстве исследований используются болюсные инъекции глюкагона, которые вызывают только временное увеличение частоты сердечных сокращений и сократительной способности (потенциально отражая быстрое выведение глюкагона из кровотока) (48). В совокупности остается неясным, имеет ли глюкагон место при лечении сердечной недостаточности или обладает кардиозащитным эффектом у здоровых людей.
Рисунок 6.

Органоспецифическое действие глюкагона. ГИП, глюкозозависимый инсулинотропный полипептид
ГЛЮКАГОН ПАТОФИЗИОЛОГИЯ
Глюкагон при диабете 2 типа
У пациентов с диабетом 2 типа наблюдается нарушение регуляции секреции глюкагона, что в значительной степени способствует диабетической гипергликемии. В частности, диабет 2 типа характеризуется повышенным уровнем глюкагона во время голодания, в то время как подавление глюкагона в ответ на пероральный прием глюкозы нарушено или даже парадоксально повышено (16, 51, 52). Механизмы гиперглюкагонемии до конца не изучены, но обычно объясняются уменьшением подавляющего действия инсулина на альфа-клетки из-за гипоинсулинемии и резистентности к инсулину на уровне альфа-клеток (53, 54). Интересно, что пациенты с диабетом 2 типа, у которых наблюдается гиперглюкагонемический ответ на пероральное введение глюкозы, реагируют нормальным подавлением глюкагона после внутривенного введения глюкозы (16). Это говорит о том, что диабетическая гиперглюкагонемия не может быть объяснена резистентностью альфа-клеток к глюкозе и/или инсулину. Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Соответственно, важную роль могут играть гормоны, выделяемые желудочно-кишечным трактом (55, 56). Недавно было подтверждено, что глюкагон может секретироваться экстрапанкреатической тканью (продемонстрировано в экспериментах с полностью удаленной поджелудочной железой) (17). Это подтверждает мнение о том, что постпрандиальная гиперсекреция глюкагона у пациентов с СД 2 типа может иметь внепанкреатическое происхождение.
Рисунок 7.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 2 типа и с нормальной физиологией (здоровые субъекты). Диабет 2 типа характеризуется повышенным уровнем глюкагона в плазме натощак и нарушением подавления уровня глюкагона в плазме в ответ на пероральное введение глюкозы.
Глюкагон при диабете 1 типа
Традиционно диабетическая гипергликемия 1 типа объяснялась селективной потерей массы бета-клеток и, как следствие, снижением секреции инсулина. Однако новые данные указывают на то, что глюкагон играет важную роль в патофизиологии диабета 1 типа. Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы.
Нарушение секреции глюкагона, характерное для пациентов с диабетом 1 типа, связано с двумя клиническими проявлениями: постпрандиальной гиперглюкагонемией и нарушением контррегуляции глюкагона по отношению к гипогликемии (57). Данные о концентрации глюкагона в плазме натощак при диабете 1 типа противоречивы (57, 58). Таким образом, общее представление о том, что гиперсекреция глюкагона играет роль в гипергликемии при диабете 1 типа, в основном основано на повышенных постпрандиальных концентрациях глюкагона (57). Объяснение этому неясно, хотя обычное объяснение состоит в том, что при диабете 1 типа постпрандиальное повышение уровня глюкозы в плазме не сопровождается увеличением секреции инсулина бета-клетками, которое в нормальных физиологических условиях подавляло бы секрецию глюкагона. Отсутствие этого сдерживающего сигнала от эндогенного инсулина может привести к увеличению секреции глюкагона альфа-клетками после еды (12, 57). Однако, как и при диабете 2 типа, субъекты с диабетом 1 типа сохраняют способность подавлять глюкагон после внутривенного введения глюкозы. Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Это свидетельствует о том, что неадекватная секреция глюкагона при диабете 1 типа возникает как следствие перорального приема, возможно, посредством глюкагонотропной передачи сигналов из кишечника или из-за секреции глюкагона непосредственно из кишечника, а не как следствие дисфункции альфа-клеток, чувствительных к гипергликемии и/или или отсутствие паракринного ингибирования инсулином (17,55,59).
Рисунок 8.
Схематическое изображение концентрации глюкагона в плазме у пациентов с диабетом 1 типа и с нормальной физиологией (здоровые субъекты). Диабет 1 типа характеризуется повышенными концентрациями глюкагона в ответ на прием пищи или пероральный прием глюкозы.
Гипогликемия является частым и опасным побочным эффектом инсулинотерапии при диабете 1 типа и представляет собой обычное препятствие для достижения гликемического контроля (60). В нормальных физиологических условиях гипогликемия предотвращается несколькими механизмами: 1) снижением секреции инсулина бета-клетками, что снижает поглощение глюкозы периферическими тканями; 2) повышенная секреция глюкагона альфа-клетками, увеличивающая выход глюкозы печенью; и 3) повышенная симпатическая нервная реакция и адреномедуллярная секреция адреналина. Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Последний будет стимулировать выработку глюкозы печенью и вызывать клинические симптомы, которые позволяют человеку распознать гипогликемию и, в конечном итоге, проглотить углеводы (57, 61, 62). При диабете 1 типа инсулин-индуцированная гипогликемия не вызывает адекватной реакции глюкагона, что ставит под угрозу контррегуляцию инсулин-индуцированной гипогликемии; явление, которое, по-видимому, ухудшается с увеличением продолжительности диабета 1 типа. Этот дефект, вероятно, связан с комбинацией дефектных альфа-клеток и сниженной массой альфа-клеток (57, 63).
Глюкагон при ожирении и стеатозе печени
Нарушение регуляции секреции глюкагона наблюдается не только у пациентов с сахарным диабетом 2 типа, но и у лиц с толерантностью к нормоглюкозе с ожирением (64) и у пациентов с неалкогольной жировой болезнью печени (НАЖБП) (65, 66). Это говорит о том, что нарушение регуляции секреции глюкагона может быть связано скорее со стеатозом печени, чем с нарушением регуляции метаболизма глюкозы. Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
Интересно, что гиперглюкагонемия натощак, по-видимому, связана с циркулирующими аминокислотами в дополнение к содержанию жира в печени (65). Эта гипераминоацидемия предполагает, что нарушение оборота аминокислот в печени и последующее повышение уровня циркулирующих аминокислот представляют собой обратную связь с альфа-клеткой, которая секретирует больше глюкагона с увеличением оборота аминокислот в печени и уреагенеза, необходимого для выведения токсического аммиака из организма. Эта петля обратной связи предлагается как «ось печень-альфа-клетка» (35, 55, 65, 67).
PERSPECTIVES
Влияние гиперглюкагонемии на ожирение и НАЖБП возродило научный интерес к действиям глюкагона и роли глюкагона в патофизиологии этих метаболических нарушений. Очевидно, что глюкагон может представлять собой потенциальную мишень для лечения ожирения и НАЖБП. Простым способом сдерживания нежелательного гипергликемического эффекта глюкагона при реализации его действия на липолиз и расход энергии может быть совместное лечение с сахароснижающим препаратом. Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
Это можно сделать, имитируя кишечный гормон оксинтомодулин, который действует как лиганд как для глюкагона, так и для рецептора GLP-1. Соответственно, лечение двойными агонистами рецепторов глюкагона/ГПП-1 у пациентов с диабетом 2 типа и ожирением улучшает гликемический контроль, снижает массу тела (68) и облегчает течение НАЖБП (69).).
РЕЗЮМЕ И ВЫВОДЫ
Глюкагон представляет собой глюкорегуляторный пептидный гормон, который противодействует действию инсулина, стимулируя выработку глюкозы в печени и тем самым повышая уровень глюкозы в крови. Кроме того, глюкагон опосредует несколько метаболических эффектов, не связанных с глюкозой, важных для поддержания энергетического баланса всего организма в периоды ограниченного поступления питательных веществ. Эти действия включают мобилизацию энергетических ресурсов посредством печеночного липолиза и кетогенеза; стимуляция метаболизма аминокислот в печени (и связанного с этим уреагенеза). Кроме того, было показано, что глюкагон увеличивает расход энергии и подавляет потребление пищи, но остается неясным, участвует ли эндогенный глюкагон в регуляции этих процессов. Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
Глюкагон играет важную роль в патофизиологии диабета, поскольку повышенные уровни глюкагона, наблюдаемые у этих пациентов, стимулируют выработку глюкозы печенью, тем самым способствуя диабетической гипергликемии. Исследования роли глюкагона в неглюкозном метаболизме и метаболической физиологии и патофизиологических процессах продолжаются и могут выявить новые цели лечения, основанные на действиях глюкагона.
ПРИЗНАТЕЛЬНОСТЬ
, создано с использованием шаблонов от Servier Medical Arts, Les Laboratoires Servier (https://smart.servier.com/). Используется по лицензии Creative Commons License 3.0.
ССЫЛКИ
- 1.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 2.
Кимбалл С.П., Мурлин-младший. Водные экстракты поджелудочной железы III. Некоторые реакции преципитации инсулина.
 Дж. Биол. хим. 1923; 58 (1): 337–346.
Дж. Биол. хим. 1923; 58 (1): 337–346.- 3.
Бромер В.В., Шинн Л.Г., Штауб А., Беренс ОК. Аминокислотная последовательность глюкагона. Диабет. 1957; 6 (3): 234–238. [PubMed: 13427628]
- 4.
Блэкман Б. Использование глюкагона в терапии инсулиновой комы. Psychiatr Q. 1961; 35: 482–487. [PubMed: 13869689]
- 5.
Эскибель А.Дж., Курланд А.А., Мендельсон Д. Использование глюкагона для прерывания инсулиновой комы. Dis Nerv Syst. 1958;19(11):485–486. [PubMed: 13586175]
- 6.
Unger RH, Eisentraut AM. МАККОЛ М.С., Мэдисон Л.Л. Антитела к глюкагону и иммуноанализ на глюкагон. Дж. Клин. Инвестировать. 1961; 40: 1280–1289. [Статья бесплатно PMC: PMC2
] [PubMed: 13779204]- 7.
Unger RH, Orci L. Существенная роль глюкагона в патогенезе сахарного диабета. Ланцет. 1975;1(7897):14–16. [PubMed: 46337]
- 8.
Drucker DJ, Asa S. Экспрессия гена глюкагона в мозге позвоночных.
 Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 2
Дж. Биол. хим. 1988;263(27):13475–13478. [PubMed: 24]
- 9.
Мойсов С., Генрих Г., Уилсон И.Б., Раваццола М., Орси Л., Хабенер Дж.Ф. Экспрессия гена препроглюкагона в поджелудочной железе и кишечнике диверсифицируется на уровне посттрансляционного процессинга. Дж. Биол. хим. 1986;261(25):11880–11889. [PubMed: 3528148]
- 10.
Герич Дж. Э., Лоренци М., Хейн С., Густафсон Г., Гийемин Р., Форшам Р. Х. Доказательства физиологической роли глюкагона поджелудочной железы в гомеостазе глюкозы у человека: исследования соматостатина. Метаб. клин. Эксп. 1975;24(2):175–182. [PubMed: 1113681]
- 11.
Громада Дж., Франклин И., Воллхейм CB. Альфа-клетки эндокринной поджелудочной железы: 35 лет исследований, но загадка остается. Эндокр. 2007;28(1):84–116. [PubMed: 17261637]
- 12.
Müller TD, Finan B, Clemmensen C, DiMarchi RD, Tschöp MH. Новая биология и фармакология глюкагона. Физиологические обзоры.
 2017;97(2):721–766. [PubMed: 28275047]
2017;97(2):721–766. [PubMed: 28275047]- 13.
Wewer Albrechtsen NJ, Kuhre RE, Pedersen J, Knop FK, Holst JJ. Биология глюкагона и последствия гиперглюкагонемии. Биомаркеры в медицине. 2016;10(11):1141–1151. [PubMed: 27611762]
- 14.
Громада Дж., Шабоссо П., Раттер Г.А. α-клетка при сахарном диабете. Нат Рев Эндокринол. 2018. [PubMed: 30310153] [Перекрестная ссылка]
- 15.
Hughes JW, Ustione A, Lavagnino Z, Piston DW. Регуляция секреции островкового глюкагона: Помимо кальция. Диабет, ожирение и обмен веществ. 20 (С2): 127–136. [Статья бесплатно PMC: PMC6148361] [PubMed: 30230183]
- 16.
Knop FK, Vilsbøll T, Madsbad S, Holst JJ, Krarup T. Несоответствующее подавление глюкагона во время OGTT, но не во время изогликемического внутривенного введения. инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]
- 17.

Лунд А., Баггер Дж.И., Альбрехтсен Н.Дж.В., Кристенсен М., Грондаль М., Хартманн Б., Мэтисен Э.Р., Хансен К.П., Сторкхольм Дж.Х., Холл Г., ван, Рехфельд Д.Ф., Хорнбург Д.Ф. , Мейснер Ф., Манн М., Ларсен С., Холст Дж. Дж., Вилсбёлль Т., Кноп Ф. К. Доказательства внепанкреатической секреции глюкагона у человека. Диабет. 2016;65(3):585–597. [PubMed: 26672094]
- 18.
Миячи А., Кобаяши М., Миено Э., Гото М., Фурусава К., Инагаки Т., Китамура Т. Точный аналитический метод определения уровня глюкагона в плазме человека с использованием жидкостной хроматографии и масс-спектрометрии высокого разрешения : сравнение с коммерчески доступными иммуноанализами. Анальный биоанальный хим. 2017;409(25): 5911–5918. [PubMed: 28801845]
- 19.
Hansen JS, Pedersen BK, Xu G, Lehmann R, Weigert C, Plomgaard P. Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа .
 Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]
Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]- 20.
Schwartz NS, Clutter WE, Shah SD, Cryer PE. Гликемические пороги для активации систем контррегуляции глюкозы выше, чем пороги для симптомов. Джей Клин Инвест. 1987;79(3):777–781. [Статья бесплатно PMC: PMC424197] [PubMed: 3546378]
- 21.
Свобода М., Тастеной М., Вертонген П., Робберехт П. Относительный количественный анализ мРНК рецептора глюкагона в тканях крыс. Мол. Клетка. Эндокринол. 1994;105(2):131–137. [PubMed: 7859919]
- 22.
Сандовал Д.А., Д’Алессио Д.А. Физиология пептидов проглюкагона: роль глюкагона и GLP-1 в норме и болезни. Физиол. 2015; 95 (2): 513–548. [В паблике: 25834231]
- 23.
Посписилик Дж.А., Хинке С.А., Педерсон Р.А., Хоффманн Т., Роше Ф., Шленциг Д., Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141.
 [PubMed: 11111019]
[PubMed: 11111019]- 24.
Pontiroli AE, Calderara A, Perfetti MG, Bareggi SR. Фармакокинетика интраназального, внутримышечного и внутривенного глюкагона у здоровых людей и больных сахарным диабетом. Евро. Дж. Клин. Фармакол. 1993;45(6):555–558. [PubMed: 8157042]
- 25.
Лунд А., Баггер Дж.И., Альбрехтсен Н.В., Кристенсен М., Грондаль М., Хансен С.П., Сторкхольм Дж.Х., Холст Дж.Дж., Вилсбёлл Т., Кноп Ф.К. Повышенное содержание жира в печени у пациентов с тотальной панкреэктомией. Диабет. 2017;67 Дополнение 1:2600. -паб.
- 26.
Унгер Р.Х. Физиология и патофизиология глюкагона в свете новых достижений. Диабетология. 1985;28(8):574–578. [PubMed: 3
- 6]
- 27.
Миллер Р.А., Бирнбаум М.Дж. Глюкагон: острые действия на печеночный метаболизм. Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]
- 28.
Ramnanan CJ, Edgerton DS, Kraft G, Cherrington AD. Физиологическое действие глюкагона на метаболизм глюкозы в печени.
 Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]
Сахарный диабет Ожирение Metab. 2011; 13 Дополнение 1:118–125. [Бесплатная статья PMC: PMC5371022] [PubMed: 21824265]- 29.
Руи Л. Энергетический обмен в печени. сост. физиол. 2014;4(1):177–19.7. [Бесплатная статья PMC: PMC4050641] [PubMed: 246]
- 30.
Geisler CE, Renquist BJ. Накопление липидов в печени: причина и следствие нарушения регуляции глюкорегуляторных гормонов. J Эндокринол. 2017;234(1):R1–R21. [PubMed: 28428362]
- 31.
Хабеггер К.М., Хеппнер К.М., Гири Н., Бартнесс Т.Дж., ДиМарчи Р., Чеп М.Х. Пересмотр метаболических действий глюкагона. Нат Рев Эндокринол. 2010;6(12):689–697. [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
- 32.
Longuet C, Sinclair EM, Maida A, Baggio LL, Maziarz M, Charron MJ, Drucker DJ. Рецептор глюкагона необходим для адаптивного метаболического ответа на голодание. Клеточный метаболизм. 2008;8(5):359–371. [Бесплатная статья PMC: PMC2593715] [PubMed: 1
68]
- 33.

Wang H, Zhao M, Sud N, Christian P, Shen J, Song Y, Pashaj A, Zhang K, Carr T, Su Q. Глюкагон регулирует метаболизм липидов в печени посредством передачи сигналов цАМФ и Insig-2: значение для патогенеза гипертриглицеридемии и стеатоза печени. Научный доклад 2016; 6: 32246. [Бесплатная статья PMC: PMC5007496] [PubMed: 27582413]
- 34.
Galsgaard KD, Pedersen J, Knop FK, Holst JJ, Wewer Albrechtsen NJ. Сигнализация рецептора глюкагона и метаболизм липидов. Фронт Физиол. 2019;10 [Бесплатная статья PMC: PMC64
- ] [PubMed: 31068828] [CrossRef]
- 35.
Holst JJ, Albrechtsen NJW, Pedersen J, Knop FK. Глюкагон и аминокислоты связаны циклом взаимной обратной связи: ось печень-α-клетка. Диабет. 2017;66(2):235–240. [PubMed: 28108603]
- 36.
Hamberg O, Vilstrup H. Регуляция синтеза мочевины глюкозой и глюкагоном у здорового человека. Клин Нутр. 1994;13(3):183–191. [PubMed: 16843380]
- 37.

Соллоуэй М.Дж., Маджиди А., Гу С., Истхэм-Андерсон Дж., Кларк Х.Дж., Клявин Н., Завала-Солорио Дж., Кейтс Л., Фридман Б., Брауэр М., Ван Дж., Фин О., Колумам Г., Стерн Х., Лоу Дж. Б., Петерсон А. С., Аллан Б. Б. Глюкагон связывает катаболизм аминокислот в печени с mTOR-зависимой регуляцией массы α-клеток. Cell Rep. 2015;12(3):495–510. [PubMed: 26166562]
- 38.
Bagger JI, Holst JJ, Hartmann B, Andersen B, Knop FK, Vilsbøll T. Влияние оксинтомодулина, глюкагона, GLP-1 и комбинированной инфузии глюкагона + GLP-1 на Потребление пищи, аппетит и расход энергии в состоянии покоя. J Clin Endocrinol Metab. 2015;100(12):4541–4552. [PubMed: 26445112]
- 39.
Geary N, Kissileff HR, Pi-Sunyer FX, Hinton V. Индивидуальные, но не одновременные инфузии глюкагона и холецистокинина подавляют прием пищи у мужчин. Являюсь. Дж. Физиол. 1992; 262 (6 ч. 2): R975–980. [PubMed: 1621876]
- 40.
Langhans W, Zeiger U, Scharrer E, Geary N.
 Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]
Стимуляция питания у крыс внутрибрюшинной инъекцией антител к глюкагону. Наука. 1982; 218(4575):894–896. [PubMed: 7134979]- 41.
Le Sauter J, Noh U, Geary N. Инфузия антител к глюкагону в порт печени увеличивает количество спонтанного приема пищи у крыс. Являюсь. Дж. Физиол. 1991; 261 (1 часть 2): R162–165. [PubMed: 1858943]
- 42.
Наир К.С. Гиперглюкагонемия увеличивает скорость метаболизма в покое у человека при дефиците инсулина. J Clin Endocrinol Metab. 1987;64(5):896–901. [PubMed: 2881943]
- 43.
Салем В., Иззи-Энгбея С., Коэлло С., Томас Д.Б., Чемберс Э.С., Комнинос А.Н., Бакли А., Вин З., Аль-Наххас А., Рабинер Э.А., Ганн Р.Н., Бадж Х., Саймондс М.Е., Блум С.Р., Тан Т.М., Дхилло В.С. Глюкагон увеличивает расход энергии независимо от активации бурой жировой ткани у человека. Сахарный диабет Ожирение Metab. 2016;18(1):72–81. [Бесплатная статья PMC: PMC4710848] [PubMed: 26434748]
- 44.

Tan TM, Field BCT, McCullough KA, Troke RC, Chambers ES, Salem V, Gonzalez Maffe J, Baynes KCR, De Silva A, Viardot A, Alsafi A, Frost GS, Ghatei MA, Bloom СР. Совместное введение глюкагоноподобного пептида-1 во время инфузии глюкагона у людей приводит к увеличению расхода энергии и уменьшению гипергликемии. Диабет. 2013;62(4):1131–1138. [PMC бесплатная статья: PMC3609580] [PubMed: 23248172]
- 45.
Habegger KM, Stemmer K, Cheng C, Müller TD, Heppner KM, Ottaway N, Holland J, Hembree JL, Smiley D, Gelfanov V, Кришна Р., Арафат А.М., Конкар А., Белли С., Каппс М., Вудс С.К., Хофманн С.М., Д’Алессио Д., Пфлюгер П.Т., Перес-Тильве Д., Сили Р.Дж., Кониши М., Ито Н., Харитоненков А., Спрангер Дж., ДиМарчи РД, Чеп МХ. Фактор роста фибробластов 21 опосредует специфические действия глюкагона. Диабет. 2013;62(5):1453–1463. [Бесплатная статья PMC: PMC3636653] [PubMed: 23305646]
- 46.
Ceriello A, Genovese S, Mannucci E, Gronda E.
 Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]
Глюкагон и сердце при диабете 2 типа: новые перспективы. Сердечно-сосудистый Диабетол. 2016;15(1):123. [Статья бесплатно PMC: PMC5002329] [PubMed: 27568179]- 47.
Graudins A, Lee HM, Druda D. Передозировка антагонистов кальциевых каналов и бета-блокаторов: антидоты и дополнительная терапия. Бр Дж Клин Фармакол. 2016;81(3):453–461. [Бесплатная статья PMC: PMC4767195] [PubMed: 26344579]
- 48.
Мейдал Петерсен К., Бегевиг С., Холст Дж. Дж., Кноп Ф. К., Кристенсен М. Б. Гемодинамические эффекты глюкагона — обзор литературы. Дж. Клин. Эндокринол. Метаб. 2018. [PubMed: 29546411] [CrossRef]
- 49.
Thuesen L, Christiansen JS, Sørensen KE, Orskov H, Henningsen P. Внутривенное введение низких доз глюкагона не влияет на сократимость миокарда у здорового человека. Эхокардиографическое исследование. Сканд. Дж. Клин. лаборатория Инвестировать. 1988;48(1):71–75. [PubMed: 3064277]
- 50.
Казда СМ.
 Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]
Лечение антагонистом рецептора глюкагона LY2409021 повышает амбулаторное артериальное давление у пациентов с диабетом 2 типа. ДИАБЕТ ОЖИРЕНИЕ И МЕТАБОЛИЗМ. 2017;19(8):1071–1077. [PubMed: 281]- 51.
Лунд А., Баггер Дж.И., Кристенсен М., Грондаль М., ван Холл Г., Холст Дж.Дж., Вильсбёлл Т., Кноп Ф.К. Более высокая продукция эндогенной глюкозы во время ПГТТ по сравнению с изогликемическим внутривенным вливанием глюкозы. J Clin Endocrinol Metab. 2016;101(11):4377–4384. [В паблике: 27533305]
- 52.
Reaven GM, Chen YD, Golay A, Swislocki AL, Jaspan JB. Документирование гиперглюкагонемии в течение дня у пациентов без ожирения и ожирения с инсулиннезависимым сахарным диабетом. Дж. Клин. Эндокринол. Метаб. 1987;64(1):106–110. [PubMed: 3536980]
- 53.
Даннинг Б.Е., Герих Дж.Е. Роль нарушения регуляции альфа-клеток в голодании и постпрандиальной гипергликемии при диабете 2 типа и терапевтических последствиях.
 Эндокр. 2007;28(3):253–283. [В паблике: 17409288]
Эндокр. 2007;28(3):253–283. [В паблике: 17409288]- 54.
Hamaguchi T, Fukushima H, Uehara M, Wada S, Shirotani T, Kishikawa H, Ichinose K, Yamaguchi K, Shichiri M. Аномальный ответ глюкагона на аргинин и его нормализация у пациентов с ожирением и гиперинсулинемией с непереносимость глюкозы: важность действия инсулина на альфа-клетки поджелудочной железы. Диабетология. 1991;34(11):801–806. [PubMed: 1769438]
- 55.
Кноп Ф.К. EJE PRIZE 2018: Интуитивное мнение о глюкагоне. Евро. Дж. Эндокринол. 2018;178(6):R267–R280. [В паблике: 29678923]
- 56.
Лунд А., Вилсбёлл Т., Баггер Дж.И., Холст Дж.Дж., Кноп Ф.К. Отдельное и комбинированное влияние кишечных гормонов, ГИП, ГПП-1 и ГПП-2, на секрецию глюкагона при диабете 2 типа. Являюсь. Дж. Физиол. Эндокринол. Метаб. 2011; 300(6):E1038–1046. [PubMed: 21386059]
- 57.
Cryer PE. Миниобзор: Глюкагон в патогенезе гипогликемии и гипергликемии при диабете.
 Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]
Эндокринология. 2012;153(3):1039–1048. [Бесплатная статья PMC: PMC3281526] [PubMed: 22166985]- 58.
Li K, Song W, Wu X, Gu D, Zang P, Gu P, Lu B, Shao J. Ассоциации уровня глюкагона в сыворотке крови с гликемической изменчивостью при диабете 1 типа с разной продолжительностью заболевания . Эндокринный. 2018;61(3):473–481. [PubMed: 292]
- 59.
Заяц К.Дж., Вилсбёлл Т., Холст Дж.Дж., Кноп Ф.К. Неадекватная реакция глюкагона после перорального введения по сравнению с изогликемическим внутривенным введением глюкозы у пациентов с диабетом 1 типа. Американский журнал физиологии-эндокринологии и метаболизма. 2010;298 (4): E832–E837. [PubMed: 20103744]
- 60.
Исследовательская группа по контролю диабета и осложнений. Натан Д.М., Генут С., Лачин Дж., Клири П., Кроффорд О., Дэвис М., Рэнд Л., Зиберт С. Влияние интенсивного лечения диабета на развитие и прогрессирование долгосрочных осложнений при инсулинозависимом сахарном диабете.
 Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]
Н. англ. Дж. Мед. 1993;329(14):977–986. [PubMed: 8366922]- 61.
Cryer PE, Gerich JE. Контррегуляция глюкозы, гипогликемия и интенсивная инсулинотерапия при сахарном диабете. Н. англ. Дж. Мед. 1985;313(4):232–241. [PubMed: 2861565]
- 62.
Sprague JE, Arbeláez AM. Контррегуляторные реакции глюкозы на гипогликемию. Pediatr Endocrinol Rev. 2011;9(1):463–475. [Бесплатная статья PMC: PMC3755377] [PubMed: 22783644]
- 63.
Yosten GLC. Дисфункция альфа-клеток при сахарном диабете 1 типа. Пептиды. 2018;100:54–60. [PubMed: 29412832]
- 64.
Knop FK, Aaboe K, Vilsbøll T, Vølund A, Holst JJ, Krarup T, Madsbad S. Нарушение инкретинового эффекта и гиперглюкагонемия натощак, характерные для пациентов с диабетом 2 типа, являются ранними признаками дисметаболизма. при ожирении. Сахарный диабет Ожирение Metab. 2012;14(6):500–510. [В паблике: 22171657]
- 65.
Albrechtsen NJW, Junker AE, Christensen M, Hædersdal S, Wibrand F, Lund AM, Galsgaard KD, Holst JJ, Knop FK, Vilsbøll T.
 Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]
Гиперглюкагонемия коррелирует с уровнями аминокислот с неразветвленной цепью в плазме. у пациентов с заболеваниями печени независимо от сахарного диабета 2 типа. Американский журнал физиологии — физиология желудочно-кишечного тракта и печени, 2017 г.: ajpgi.00216.2017. [PubMed: 28971838]- 66.
Junker AE, Gluud L, Holst JJ, Knop FK, Vilsbøll T. Диабетические и недиабетические пациенты с неалкогольной жировой болезнью печени имеют нарушенный инкретиновый эффект и гиперглюкагонемию натощак. J Интерн Мед. 2016;279(5): 485–493. [PubMed: 26728692]
- 67.
Suppli MP, Lund A, Bagger JI, Vilsbøll T, Knop FK. Участие индуцированной стеатозом резистентности к глюкагону в гиперглюкагонемии. Мед. Гипотезы. 2016;86:100–103. [PubMed: 26547273]
- 68.
Tillner J, Posch MG, Wagner F, Teichert L, Hijazi Y, Einig C, Keil S, Haack T, Wagner M, Bossart M, Larsen PJ. Новый двойной глюкагоноподобный пептид и агонист рецептора глюкагона SAR425899: результаты рандомизированных плацебо-контролируемых испытаний, проведенных впервые на людях и на пациентах.




 рисунок 5). Потяните за поршень, чтобы набрать глюкагон в шприц. Обязательно наберите в шприц все лекарство из флакона.
рисунок 5). Потяните за поршень, чтобы набрать глюкагон в шприц. Обязательно наберите в шприц все лекарство из флакона.


 Они также должны придерживаться строго ограниченной диеты.
Они также должны придерживаться строго ограниченной диеты.


 Этот процесс называется гликогенолизом.
Этот процесс называется гликогенолизом.

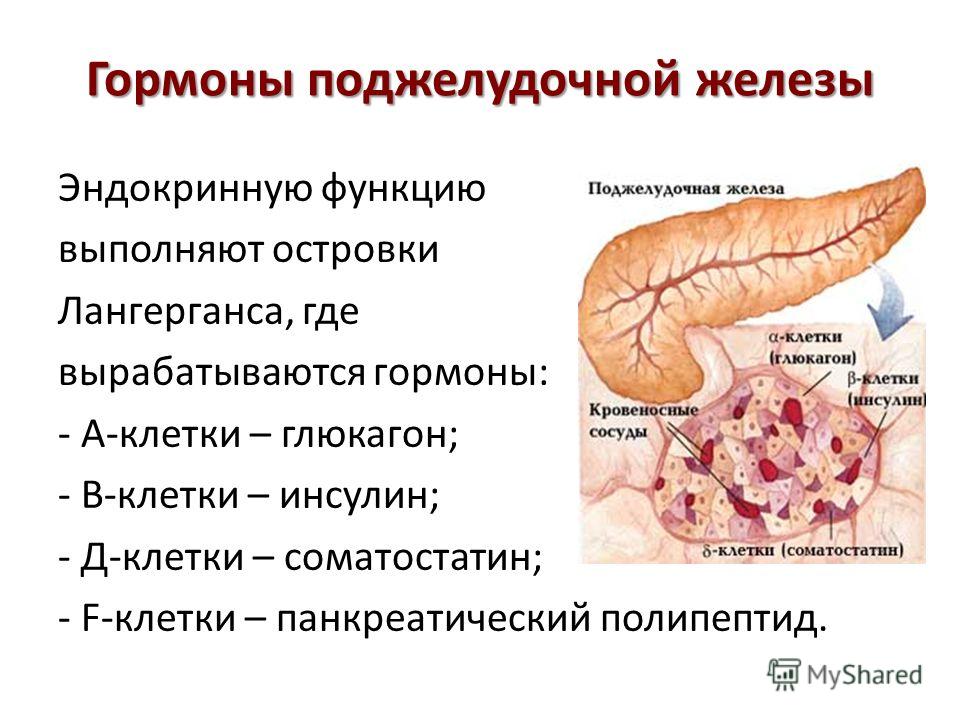 [Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]
[Бесплатная статья PMC: PMC3563428] [PubMed: 20957001]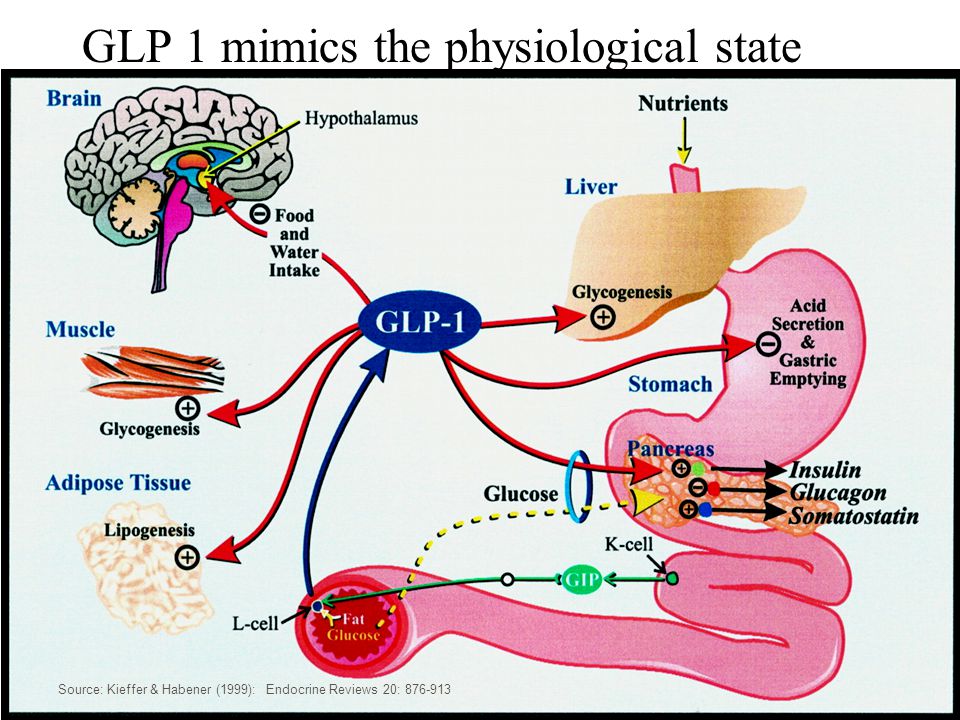
 Эндокр. 2007;28(1):84–116. [PubMed: 17261637]
Эндокр. 2007;28(1):84–116. [PubMed: 17261637] инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124]
инфузия глюкозы способствует уменьшению инкретинового эффекта при сахарном диабете 2 типа. Диабетология. 2007;50(4):797–805. [PubMed: 17225124] Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа . Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]
Индуцированная физической нагрузкой секреция FGF21 и фоллистатина блокируется зажимом поджелудочной железы и нарушается при диабете 2 типа . Дж. Клин. Эндокринол. Метаб. 2016;101(7):2816–2825. [PubMed: 27163358]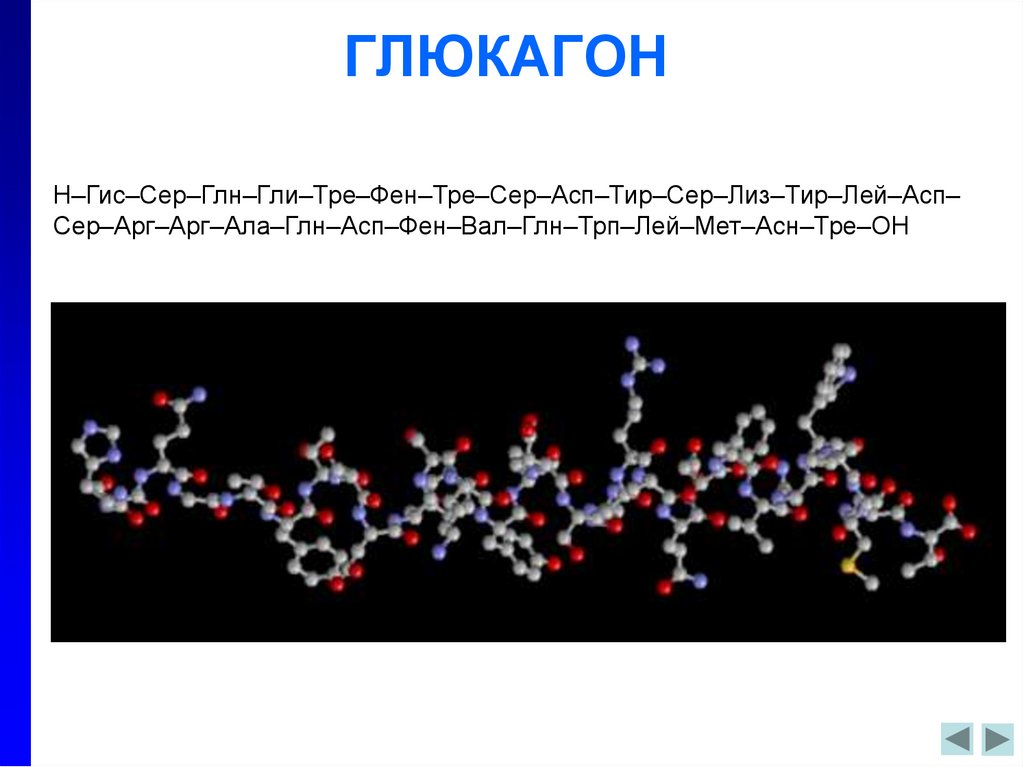 , Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141. [PubMed: 11111019]
, Глунд К., Хайзер У., Макинтош С.Х.С., Демут Х.У. Метаболизм глюкагона дипептидилпептидазой IV (CD26). Регуляторные пептиды. 2001;96(3):133–141. [PubMed: 11111019]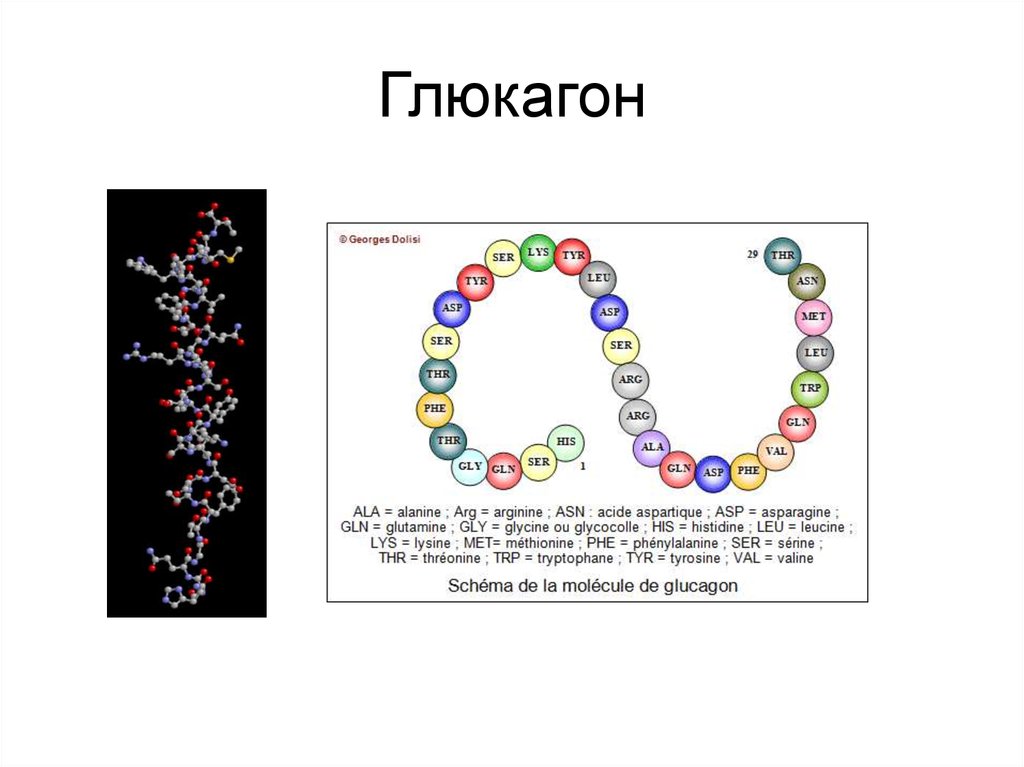 Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]
Диабетология. 2016;59(7):1376–1381. [PubMed: 27115415]