Где вырабатывается глюкагон: Глюкагон и альфа-клетки — новая терапевтическая мишень в лечении сахарного диабета | Петунина
Глюкагон и альфа-клетки — новая терапевтическая мишень в лечении сахарного диабета | Петунина
Согласно бигормональной гипотезе, предложенной в 1975 г. R. Unger, ключевыми гормонами, регулирующими углеводный обмен, являются инсулин и глюкагон. Несмотря на то, что функция глюкагона в регуляции гомеостаза глюкозы у здоровых людей изучена достаточно, его роль в развитии сахарного диабета 2 типа (СД2) остается недооцененной. Множество исследований последнего десятилетия показали, что ключевая роль в развитии гипергликемии натощак и постпрандиально у пациентов с СД2 принадлежит именно глюкагону. Патофизиология СД2 характеризуется не только инсулинорезистентностью и нарушением секреции инсулина, но и гиперглюкагонемией натощак, нарушением подавления выработки глюкагона при пероральном поступлении глюкозы, а также гиперпродукцией глюкагона в ответ на прием пищи.
Структура островков Лангерганса
Островки, впервые обнаруженные Лангергансом в 1869 г., содержат 5 различных типов клеток, каждый из которых продуцирует свой собственный гормон. У мышей β-клетки, продуцирующие инсулин, занимают 60–80% от клеток, составляющих островок, и локализуются в его ядре, тогда как остальные клетки располагаются в так называемом покровном слое. Это α-клетки, секретирующие глюкагон (занимают 10–20% от клеток островков), δ-клетки, секретирующие соматостатин, рр-клетки, производящие панкреатический пептид, и ε-клетки, продуцирующие грелин [1]. У человека α-, рр-, δ- и ε-клетки обнаруживаются как на периферии, так и в центре островков. Такая разница в строении островков поджелудочной железы у человека и грызунов объясняется особенностями паракринной регуляции.
У мышей β-клетки, продуцирующие инсулин, занимают 60–80% от клеток, составляющих островок, и локализуются в его ядре, тогда как остальные клетки располагаются в так называемом покровном слое. Это α-клетки, секретирующие глюкагон (занимают 10–20% от клеток островков), δ-клетки, секретирующие соматостатин, рр-клетки, производящие панкреатический пептид, и ε-клетки, продуцирующие грелин [1]. У человека α-, рр-, δ- и ε-клетки обнаруживаются как на периферии, так и в центре островков. Такая разница в строении островков поджелудочной железы у человека и грызунов объясняется особенностями паракринной регуляции.
Удобной моделью для изучения развития и дифференцировки эндокринных клеток поджелудочной железы послужили мыши. Первые гормонпродуцирующие клетки были обнаружены у них на 9-й день эмбрионального развития, большинство этих клеток было глюкагонпродуцирующими. Первые инсулинпродуцирующие клетки были обнаружены на 10-й день, причем это были клетки, производившие инсулин и глюкагон одновременно.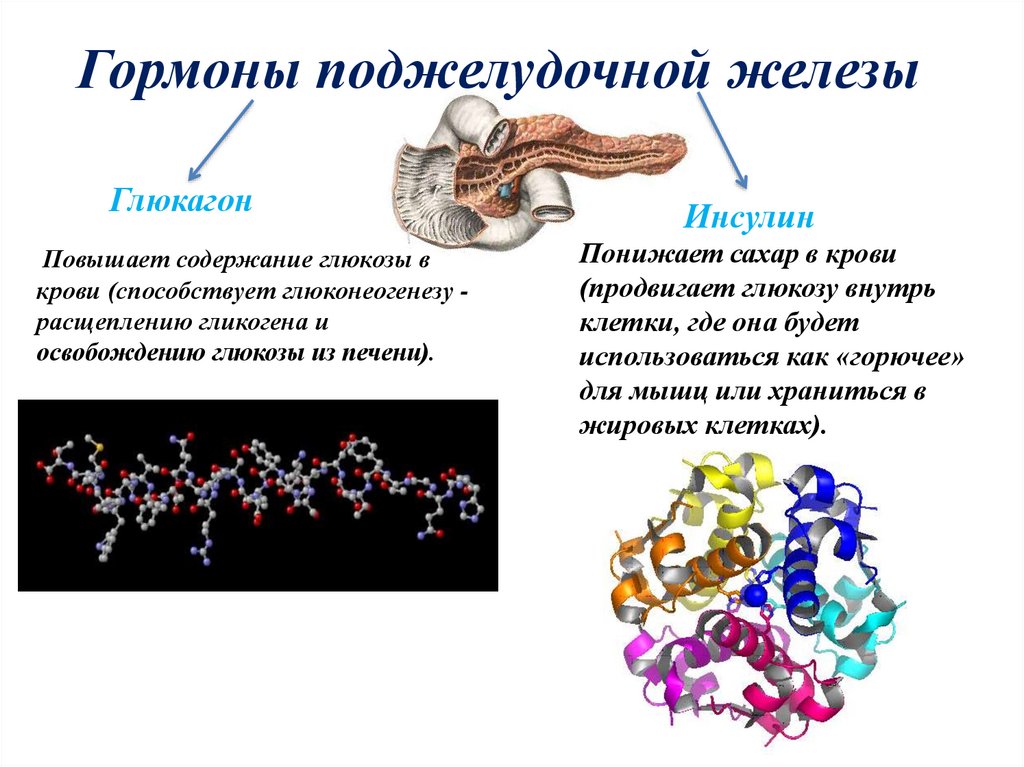 На 13-й день была обнаружена вторая генерация гормонпродуцирующих клеток, и она уже включала глюкагон-, инсулин-, соматостатин-, грелин- и РР‑продуцирующие клетки. Миграция и дифференцировка клеток с образованием компактных структур (островков Лангерганса) происходила в период с 16-го дня и до рождения [2].
На 13-й день была обнаружена вторая генерация гормонпродуцирующих клеток, и она уже включала глюкагон-, инсулин-, соматостатин-, грелин- и РР‑продуцирующие клетки. Миграция и дифференцировка клеток с образованием компактных структур (островков Лангерганса) происходила в период с 16-го дня и до рождения [2].
Эндокринные клетки поджелудочной железы у человека дифференцируются из предшественников протоковых клеток. Популяция эндокринных клеток начинает расширяться в раннем постнатальном периоде. Во взрослом состоянии последующая пролиферация, вероятно, включает репликацию существующих островковых клеток и их новообразование [3].
Дифференцировка α- и β-клеток
α-Клетки вместе с энтероцитами, бокаловидными клетками и клетками Паннета происходят из общих мультипотентных клеток в кишечных криптах, формирующихся из эндодермы. После дифференцировки всех этих клеток из предшественницы происходит их миграция на верхушку кишечной ворсинки, затем они возвращаются обратно, цикл повторяется каждые 3–4 дня [4]. Дифференцировка α-клеток происходит под влиянием большого количества факторов (рис. 1).
Дифференцировка α-клеток происходит под влиянием большого количества факторов (рис. 1).
Основные гены, участвующие в дифференцировке эндокринных клеток поджелудочной железы, относятся к кластеру хоумбокс-содержащих генов (Pdx1+ – Pancreas duodenum homeobox-1, Arx – Aristaless related homeobox, Pax4 Paired homeobox gene 4, FoxA2 – forkhead homeobox A2, FoxA1 – forkhead homeobox A1, Pax 6 – paired homeobox 6, Isl-1 – ISL LIM homeobox 1, Nkx2.2 Nk 2 homeobox-2, Nkx6.1 Nk 6 homeobox-1).
У мышей Pdx1-ген активируется в клетках-предшественницах первичной кишки на 8–9-й день эмбриогенеза. В начале развития он экспрессируется во всех клетках эпителиального ростка. В поздние периоды развития плода и у взрослых высокий уровень экспрессии Pdx1 сохраняется только в β- и δ-клетках, а также некоторых протоковых клетках. В экспериментах с моделированием нарушения экспрессии Pdx1 обнаруживалось увеличение количества α-клеток. Происходит ли это вследствие уменьшения подавления β-клетками развития α-клеток или из-за преобразования β-клеток в α-клетки, пока неизвестно.
Pdx1-клетки дифференцируются в Нейрогенин 3+ (Ngn3+ или Neurog 3) эндокринные клетки-предшественники. Клетки, экспрессирующие Ngn3+, в большом количестве обнаруживаются только в период эмбрионального развития. Эти клетки не продуцируют ни глюкагон, ни инсулин, но способствуют росту всех эндокринных клеток поджелудочной железы [2]. Различные наблюдения показали, что Ngn3+-экспрессирующие клетки-предшественницы проходят через различные этапы развития. Так, молодые Ngn3+ экспрессирующие клетки увеличивают рост исключительно α-клеток, тогда как на поздних стадиях развития эти клетки увеличивают рост β-, РР- и δ-клеток [1].
Далее целый ряд факторов транскрипции направляет формирующиеся эндокринные клетки по четырем основным путям развития. Эти факторы могут быть разделены на ранние (такие как Nkx2.2, Nkx6.1, Pax4 или Arx), которые соэкспрессируются вместе с Ngn3 в эндокринных клетках-предшественницах, и поздние факторы (включая, Pax6, Isl1,MafA или Pdx1), которые обнаруживаются в более зрелых клетках [5]. Остановимся на некоторых из них более подробно.
Остановимся на некоторых из них более подробно.
Гены Arx и Pax-4
Гены Arx и Pax-4 имеют специфическое действие на пролиферацию клеток островков. Arx необходим для развития α-клеток и достаточной промоции α- и РР‑линий во время морфогенеза поджелудочной железы, Pax-4 ген способствует гибели β- и δ-клеток, приводя к уменьшению их количества и увеличению количества α-клеток. Интересным открытием является то, что нарушенное действие Arx на β-клетки у взрослых может привести к их перерождению в клетки, проявляющие свойства α- и РР-клеток. Локальная же экспрессия Pax-4 в развивающейся поджелудочной железе мышей приводит к тому, что в увеличенных островках Лангерганса формируются клетки, проявляющие свойства β-клеток. Более того, нарушение его экспрессии ведет к тому, что количество α-клеток соответствует увеличению инсулин-продуцирующих клеток. Эксперименты на родственных линиях демонстрируют превращение глюкагон-продуцирующих клеток в инсулин-продуцирующие, которые проявляют все остальные свойства истинных β-клеток.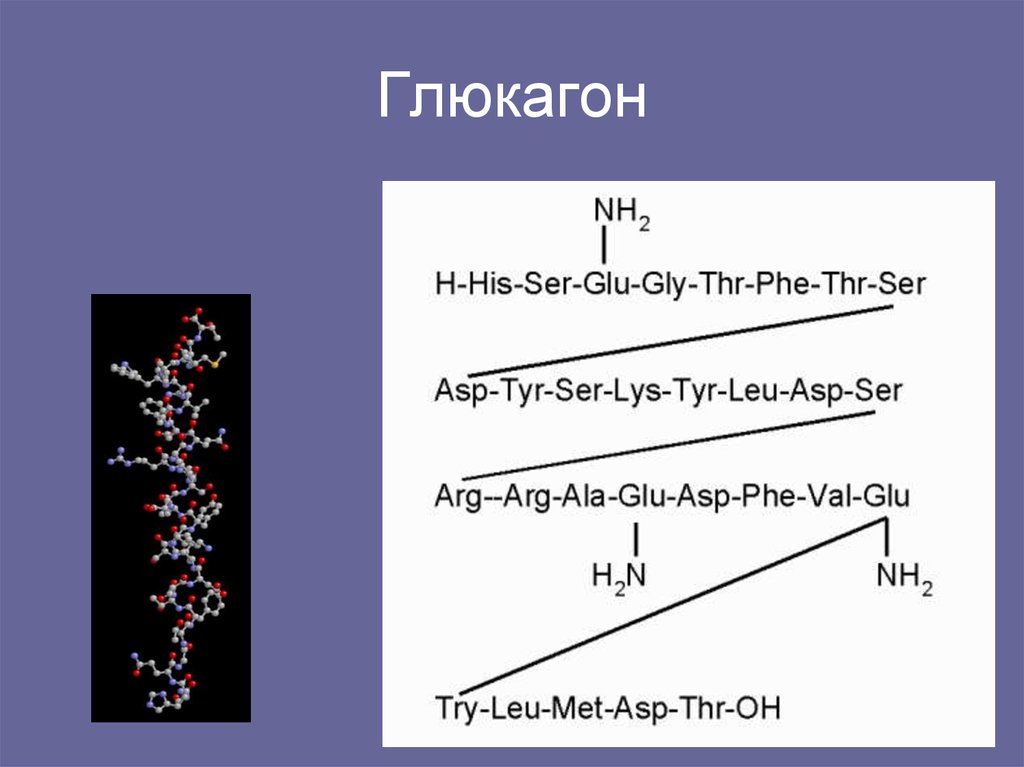 Было продемонстрировано, что долговременное превращение α-клеток в β-подобные клетки, индуцированное нарушенной экспрессией Pax4, приводит к стимуляции новообразования α-клеток. Это происходит по механизму продолжительной активации клеток-предшественниц, расположенных в выстилке протоков, которые реактивируются экспрессией Ngn3. Этот повторяющийся цикл приводит к гиперплазии островков. Интересно, что такой процесс у молодых животных с химически индуцированным СД является достаточным, чтобы обратить болезнь вспять [6].
Было продемонстрировано, что долговременное превращение α-клеток в β-подобные клетки, индуцированное нарушенной экспрессией Pax4, приводит к стимуляции новообразования α-клеток. Это происходит по механизму продолжительной активации клеток-предшественниц, расположенных в выстилке протоков, которые реактивируются экспрессией Ngn3. Этот повторяющийся цикл приводит к гиперплазии островков. Интересно, что такой процесс у молодых животных с химически индуцированным СД является достаточным, чтобы обратить болезнь вспять [6].
Ген Pax-6
Ген Pax-6 экспрессируется во всех эндокринных клетках поджелудочной железы и требуется для экспрессии генов, обеспечивающих функции α-, β- и δ-клеток [7]. Pax-6 играет решающую роль в экспрессии гена глюкагона (Gcg) и регуляции превращения проглюкагона в глюкагон в α-клетках. После подавления или удаления Pax-6 у мышей, уровень мРНК глюкагона сильно снижается. Отмечается, что Pax-6 необходим для дифференцировки L-клеток кишечника и экспрессии Gcg-гена в этих клетках. Предполагается, что продукция глюкагоноподобного пептида-1 (GLP-1) также может зависеть от Pax-6 [8].
Предполагается, что продукция глюкагоноподобного пептида-1 (GLP-1) также может зависеть от Pax-6 [8].
Структура гена глюкагона
Ген глюкагона (Gcg) экспрессируется в α-клетках эндокринной части поджелудочной железы, но также его экспрессия возможна и в L-клетках кишечника, и в специфических областях головного мозга. Сигнальный пептид отщепляется от препроглюкагона, далее кодируется Gcg мРНК для получения проглюкагона, который является предшественником для образования пептидов (включая глюкагон, глюкагонподобные пептиды 1 и 2).
Глюкагон образуется в α-клетках поджелудочной железы путем расщепления проглюкагона прогормон-конвертазой-2 (Pcsk2), в то время как глюкагонoподобные пептиды (GLPp-1, GLP-2) синтезируются одновременно в L-клетках кишечника и в некоторых клетках ЦНС путем расщепления прогормон-конвертазой-1 (Pcsk1). Таким образом, большая часть проглюкагона преобразуется в глюкагон. Тем не менее, в некоторых ситуациях, к примеру, при повреждении β-клеток, GLP-1 может обнаруживаться в клетках островков одновременно с глюкагоном. При альтернативном или неполном расщеплении проглюкагона могут образовываться некоторые другие пептиды, например, глицентин и оксинтомодулин, которые были описаны, но их физиологическая роль до сих пор мало изучена [9, 10] (рис. 2).
При альтернативном или неполном расщеплении проглюкагона могут образовываться некоторые другие пептиды, например, глицентин и оксинтомодулин, которые были описаны, но их физиологическая роль до сих пор мало изучена [9, 10] (рис. 2).
Гипотезы регуляции экспрессии гена глюкагона
Предполагается, что экспрессия гена глюкагона происходит по умолчанию: при отсутствии специфических факторов, таких как Pdx1, Pax4 и Nkx6.1, достаточно наличия других островковых факторов для экспрессии гена глюкагона и для дифференцировки α-клеток. Тем не менее, у мутантных мышей с недостатком Pax6, FoxA 2 или Arx α-клетки отсутствовали или были представлены в небольшом количестве. Это подтверждает, что перечисленные факторы наиболее важны для дифференцировки α-клеток [8].
Другими важными факторами транскрипции являются гены FoxA1 и FoxA2, представленные в α-клетках и в период развития, и во взрослом состоянии. Исследования на мутантных мышах показали, что FoxA1 участвует в транскрипции гена глюкагона, в то время как FoxA2 в большей степени участвует в дифференцировке α-клеток.
Maf B (musculoaponeurotic fibrosarcoma oncogene homolog B) экспрессируется у взрослых исключительно в α-клетках, однако в период развития встречается и в α-, и в β-клетках. Эксперименты на мышах, лишенных MafB, показали, что этот фактор регулирует основные этапы дифференцировки обоих типов клеток: и инсулин-, и глюкагонпродуцирующих [8].
Регуляция секреции глюкагона
Предполагают, что периферическая концентрация глюкагона неточно отражает истинную секрецию α-клеток вследствие печеночного клиренса. Тем не менее, эти данные являются спорными. Концентрация глюкагона натощак довольно низкая и равна 10 пмоль/л. Являясь частью регуляции углеводного обмена, секреция глюкагона зависит от концентрации глюкозы в плазме. При падении уровня глюкозы до 2–3 ммоль/л, концентрация глюкагона возрастает до 40 пмоль/л и снижается до 1–2 пмоль/л, когда уровень глюкозы повышается до 10–12 ммоль/л [11]. Новые работы демонстрируют комплексные, но несколько усложненные регуляторные механизмы, моделирующие глюкагоновый ответ α-клеток, с участием панкреатических и эндокринных гормонов (инсулин, соматостатин, эпинефрин, инкретины), Zn2+, питательных веществ, центральной и автономной нервной систем [12].
Роль инсулина
Различные исследования in vivo и in vitro доказали, что инсулин подавляет выработку глюкагона. Исследования на αIRKO мышах доказали, что in vivo регулирующее действие инсулина необыкновенно важно для реализации функции α-клеток. Несмотря на то, что у нокаут-мышей глюкагоновый ответ на фоне голодной гипогликемии, сопровождающейся гипоинсулинемией, был значительно снижен, подопытные демонстрировали усиление глюкагонового ответа на гипогликемию, вызванную гиперинсулинемией. Напротив, в контрольной группе глюкагоновая секреция была выше в первом случае и подавлялась во втором [12]. Это доказывает, что αIRKO мыши не способны чувствовать вариации уровня инсулина и, соответственно, адаптировать секрецию глюкагона. Интересно, что стрептозотоцин-индуцированная (STZ) гипергликемия, вторичная по отношению к гипоинсулинемии, вызывала похожее повышение уровня глюкагона в плазме крови как в группе контроля, так и у αIRKO мышей. Затем мышей, находившихся под воздействием STZ, пролечили флоридунином, на фоне чего уровень глюкагона снизился до значений, сравнимых со значениями у мышей с нормогликемией, не подвергавшихся воздействию. Это исследование доказывает, что in vivo гипергликемия стимулирует секрецию глюкагона α-клетками без участия инсулина, а внутриостровковый эффект инсулина играет центральную роль в физиологическом подавлении секреции глюкагона в ответ на гипергликемию. Это также демонстрирует, что гипогликемия может стимулировать секрецию глюкагона независимо от инсулина, так как в обеих группах (контрольной и αIRKO) происходило значительное увеличение секреции глюкагона на фоне гиперинсулинемии выше физиологических значений. Важно отметить, что этот феномен может быть частично обусловлен действием других веществ, влияющих на секрецию глюкагона, таких как глютамат, нейротрансмиттеры [12].
Это исследование доказывает, что in vivo гипергликемия стимулирует секрецию глюкагона α-клетками без участия инсулина, а внутриостровковый эффект инсулина играет центральную роль в физиологическом подавлении секреции глюкагона в ответ на гипергликемию. Это также демонстрирует, что гипогликемия может стимулировать секрецию глюкагона независимо от инсулина, так как в обеих группах (контрольной и αIRKO) происходило значительное увеличение секреции глюкагона на фоне гиперинсулинемии выше физиологических значений. Важно отметить, что этот феномен может быть частично обусловлен действием других веществ, влияющих на секрецию глюкагона, таких как глютамат, нейротрансмиттеры [12].
Роль инкретинов
Инкретины – гормоны, выделяемые эндокринными клетками кишечника, которые усиливают глюкозозависимую секрецию инсулина, обеспечивая тем самым «инкретиновый эффект» – разницу в уровне секреции инсулина в ответ на внутривенное и пероральное поступление глюкозы. У млекопитащих известны следующие инкретины: глюкозозависимый инсулинотропный пептид (GIP) и GLP-1, 2. GIP и GLP-1 закодированы индивидуальной генной последовательностью в геноме человека. GIP-ген кодирует исключительно GIP и экспрессируется в K-клетках кишечника. GLP-1 кодируется геном проглюкагона (Gcg). У млекопитающих существует также GLP-2, который регулирует пролиферацию клеток кишечника, участвует в их функционировании, а также способствует делению клеток костной ткани и нейропротекции. Интересно, что в то время как действие глюкагона одинаковое у всех живых организмов, действие GLP-1 сильно различается у млекопитающих и рыб, а GLP-2 определяется только у млекопитающих. Функционирование GIP-гена было описано у ограниченного количества видов млекопитающих и у некоторых других видов позвоночных, обладающих геном, подобным GIP. Оба гена, GIP и Gcg, существуют в геноме млекопитающих в единственном числе и занимают в нем стабильное положение, в строго определенном порядке [10].
GIP и GLP-1 закодированы индивидуальной генной последовательностью в геноме человека. GIP-ген кодирует исключительно GIP и экспрессируется в K-клетках кишечника. GLP-1 кодируется геном проглюкагона (Gcg). У млекопитающих существует также GLP-2, который регулирует пролиферацию клеток кишечника, участвует в их функционировании, а также способствует делению клеток костной ткани и нейропротекции. Интересно, что в то время как действие глюкагона одинаковое у всех живых организмов, действие GLP-1 сильно различается у млекопитающих и рыб, а GLP-2 определяется только у млекопитающих. Функционирование GIP-гена было описано у ограниченного количества видов млекопитающих и у некоторых других видов позвоночных, обладающих геном, подобным GIP. Оба гена, GIP и Gcg, существуют в геноме млекопитающих в единственном числе и занимают в нем стабильное положение, в строго определенном порядке [10].
СД2 проявляется характерными нарушениями в секреции глюкагона. Очень часто у пациентов отмечается гиперглюкагонемия натощак и избыточный ответ на пищевую нагрузку, в то время как у здоровых людей и внутривенное, и пероральное введение глюкозы приводит к одинаковой супрессии выработки глюкагона. Пациенты же с СД2 демонстрируют парадоксальное увеличение выделения глюкагона, отсутствие его подавления при пероральной нагрузке глюкозой в первые 45–60 минут и супрессию после внутривенного введения глюкозы. Похожие наблюдения были сделаны у пациентов с СД 1 типа (СД1) при резком снижении количества β-клеток. Полагают, что эта разница может быть результатом нарушения взаимодействия между α- и β-клетками внутри островков или же результатом инсулинорезистентности α-клеток.
Пациенты же с СД2 демонстрируют парадоксальное увеличение выделения глюкагона, отсутствие его подавления при пероральной нагрузке глюкозой в первые 45–60 минут и супрессию после внутривенного введения глюкозы. Похожие наблюдения были сделаны у пациентов с СД 1 типа (СД1) при резком снижении количества β-клеток. Полагают, что эта разница может быть результатом нарушения взаимодействия между α- и β-клетками внутри островков или же результатом инсулинорезистентности α-клеток.
В последнее время доказано, что GLP-1-индуцированная стимуляция инсулина и подавление глюкагона в равной степени способствуют эффекту снижения гликемии у пациентов с СД [13]. Поэтому особое значение в лечении СД2 приобретают новые группы препаратов, основанные на воспроизведении эффектов GLP-1: это агонисты GLP-1 и ингибиторы дипептидилпептидазы (ДПП-4). Ряд клинических исследований доказал эффективное подавление секреции глюкагона и, соответственно, подавление гиперпродукции глюкозы печенью, при назначении ингибиторов ДПП-4 [14] (рис.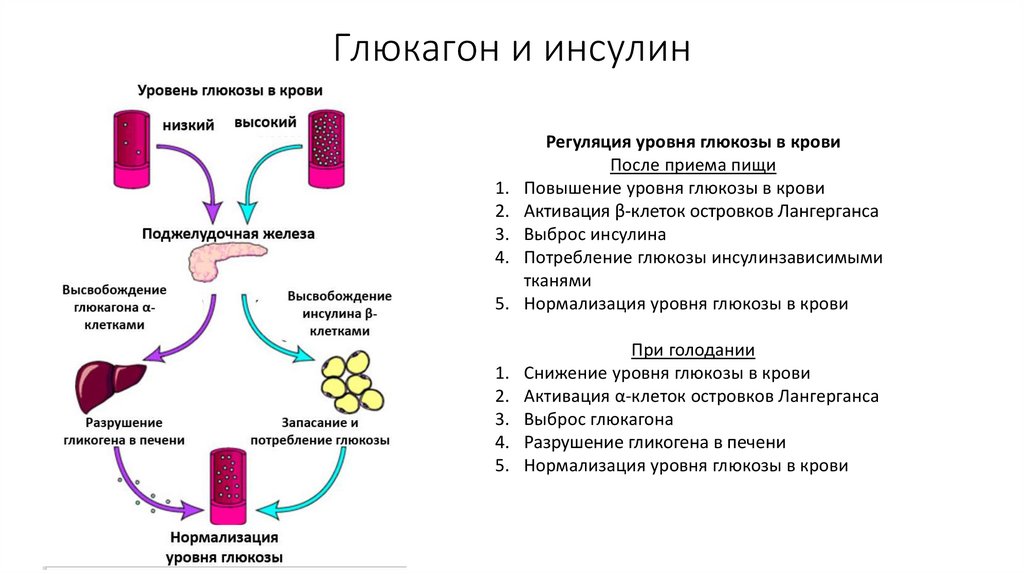 3, 4).
3, 4).
Одним из новых и потенциально возможных путей развития инкретиновой терапии становится применение ее при СД1, т.к. GLP-1 может предотвращать, а возможно и восстанавливать функцию β-клеток, увеличивать их количество, а также подавлять секрецию глюкагона. Назначение GLP-1 в фармакологических дозах пациентам с СД1, гипергликемией и минимальной остаточной функцией β-клетки, снижает гликемию на 3–4 ммоль/л параллельно со снижением глюкагона плазмы на 40%–50% [15].
Важным направлением развития терапии инкретинами должен стать поиск соединений, стимулирующих выработку собственного эндогенного GLP-1, а также определение клеточных механизмов, ответственных за выработку GLP-1 в ответ на поступление питательных веществ.
Альтернативным подходом является разработка системы доставки генов для усиления продукции и выделения GLP-1 в β-клетке. В исследованиях на мышах это приводило к увеличению количества β-клеток и защищало мышей от развития STZ-индуцированного СД.
Наконец, воздействие на выработку проглюкагона, такое как увеличение выработки прогормональной конвертазы в клетках островков, индуцированное аденовирусом, может приводить к превращению глюкагон-продуцирующих α-клеток в GLP-1-продуцирующие клетки [16].
Изучение новых данных о патофизиологии и патогенезе СД открывает широкие перспективы в лечении этого заболевания. Ниже перечислены лишь некоторые из них.
Возможности перепрограммирования α-клеток в β-клетки
Усиленная экспрессия гена Pax4 в глюкагон-продуцирующих клетках приводит к увеличению количества клеток, подобных β-клеткам. Это показывает, что переключение α-клеток на функционирование по типу β-клеток принципиально возможно. Открытие говорит о возможности использования Pax4 для «перепрограммирования» α-клеток в β-клетки.
Последние исследования продемонстрировали, что после введения дифтерийного токсина и гибели более 99% β-клеток у трансгенных мышей, клеточный остаток островков представлен в основном α-клетками. Под действием факторов транскрипции β-клеток (таких, как Pdx 1, Nkx 6.1) оставшиеся α-клетки временно производили и инсулин, и глюкагон, а затем полностью превращались в зрелые функциональные β-клетки. Таким образом показано, что α-клетки могут перепрограммироваться в β-клетки.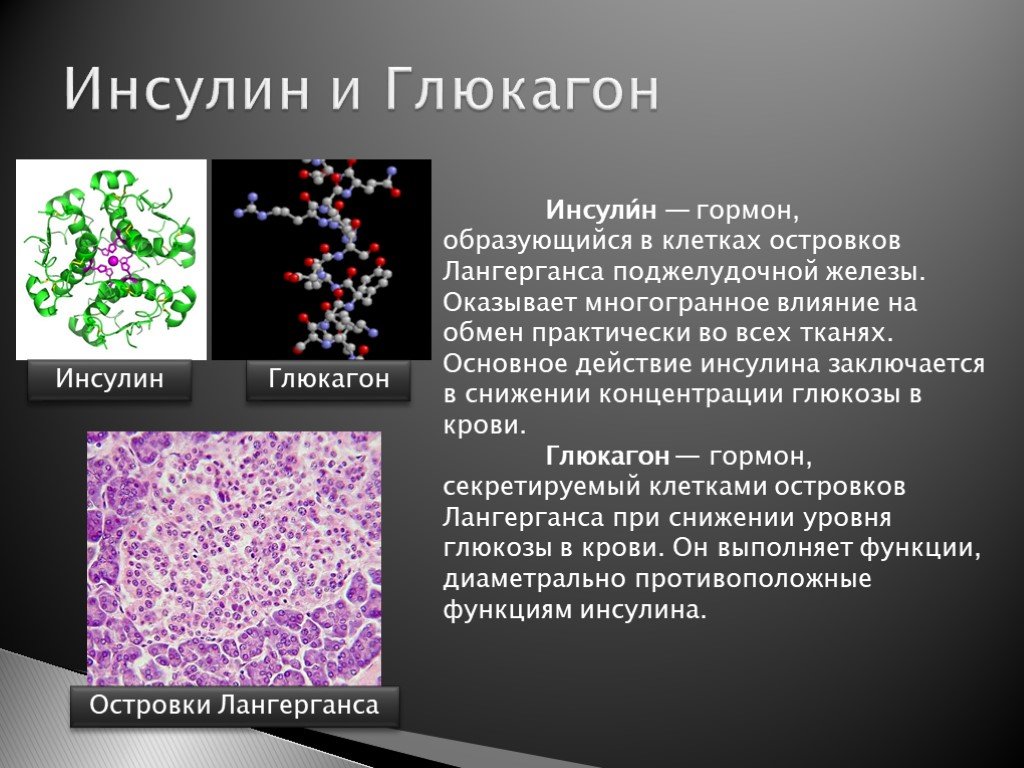 Тем не менее, остается неясным, способны ли вновь образованные β-клетки заменить оригинальные, так как большое количество мышей в обоих исследованиях заболевали диабетом. Также перед учеными встает вопрос об источнике α-клеток для перепрограммирования и пересадки их человеку [2].
Тем не менее, остается неясным, способны ли вновь образованные β-клетки заменить оригинальные, так как большое количество мышей в обоих исследованиях заболевали диабетом. Также перед учеными встает вопрос об источнике α-клеток для перепрограммирования и пересадки их человеку [2].
Некоторые исследователи пытались вырастить β-клетки in vivo с помощью эктопической экспрессии различных факторов транскрипции в клетках кишечника, учитывая, что поджелудочная железа в ходе естественного органогенеза развивается из кишечника. К примеру, индуцированное аденовирусом увеличение экспрессии фактора транскрипции МafA (Ad-MafA) приводит к увеличению уровня инсулина плазмы и снижения гипергликемии, спровоцированной введением стрептозотоцина. Тем не менее, инсулин-продуцирующие клетки кишечника не усиливают секреции инсулина в ответ на оральную нагрузку глюкозой. Абсолютно ясно, что требуются дальнейшие исследования для развития безопасных и эффективных подходов для создания инсулинпродуцирующих клеток с глюкозозависимым инсулиновым ответом [17].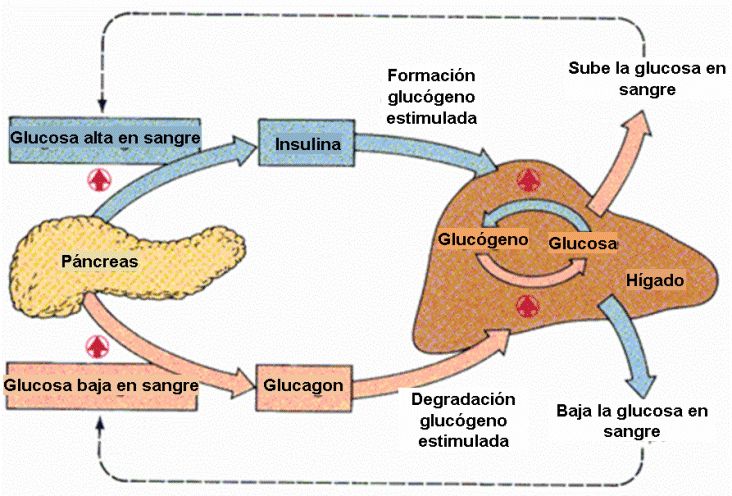
Другие инкретины и биоактивные гастроэнтеропанкреатические гормоны
Другие инкретины и биоактивные гастроэнтеропанкреатические гормоны могут улучшать инсулиновый ответ подобно агонистам рецепторов GLP. Предполагалось, что для этой цели возможно использование аналогов оксинтомодулина. Оксинтомодулин производится совместно с GLP-1 и является агонистом его рецепторов, но при этом он стимулирует глюкагоновые рецепторы, что можно рассматривать как негативный эффект такой терапии. Учитывая, что GIP также стимулирует секрецию глюкагона, в перспективе лечения СД ингибирование этих рецепторов, возможно, более предпочтительно, чем их стимуляция. Для этого может быть использован панкреатический пептид PYY3-36 самостоятельно или в комбинации с антагонистами рецепторов оксинтомодулина, холецистокинина и грелина [16].
Заключение
В настоящее время очевидно, что участие глюкагона в развитии СД было недооценено. Множество современных исследований посвящено глюкагону, его физиологической роли в поддержании нормального уровня глюкозы и его значения в патогенезе диабета. Нарушение обмена глюкагона, возможно, не ведущий патогенетический фактор этого заболевания, однако понимание его физиологии и функции открывает перед нами возможности улучшения терапевтического эффекта, без усиления риска тяжелых осложнений, и даже открытия новых способов коррекции углеводного обмена.
Нарушение обмена глюкагона, возможно, не ведущий патогенетический фактор этого заболевания, однако понимание его физиологии и функции открывает перед нами возможности улучшения терапевтического эффекта, без усиления риска тяжелых осложнений, и даже открытия новых способов коррекции углеводного обмена.
Авторы декларируют отсутствие конфликта (двойственности) интересов в связи с подготовкой рукописи.
1. Lefebvre PJ. Early milestones in glucagon research. Diabetes Obes Metab. 2011;13 Suppl 1:1-4. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01437.x
2. Bramswig NC, Kaestner KH. Transcriptional regulation of alpha-cell differentiation. Diabetes Obes Metab. 2011;13 Suppl 1:13-20. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01440.x
3. Cnop M, Hughes SJ, Igoillo-Esteve M, Hoppa MB, Sayyed F, van de Laar L, et al. The long lifespan and low turnover of human islet beta cells estimated by mathematical modelling of lipofuscin accumulation. Diabetologia. 2010;53(2):321-330. DOI: http://dx.doi.org/10.1007/s00125-009-1562-x [PubMed]
DOI: http://dx.doi.org/10.1007/s00125-009-1562-x [PubMed]
4. Li HJ, Ray SK, Singh NK, Johnston B, Leiter AB. Basic helix-loop-helix transcription factors and enteroendocrine cell differentiation. Diabetes Obes Metab. 2011;13 Suppl 1:5-12. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01438.x
5. Collombat P, Hecksher-Sorensen J, Krull J, Berger J, Riedel D, Herrera PL, et al. Embryonic endocrine pancreas and mature beta cells acquire alpha and PP cell phenotypes upon Arx misexpression. Journal of Clinical Investigation. 2007;117(4):961-970. DOI: http://dx.doi.org/10.1172/JCI29115
6. Collombat P, Mansouri A, Hecksher-Sorensen J, Serup P, Krull J, Gradwohl G, et al. Opposing actions of Arx and Pax4 in endocrine pancreas development. Genes and Development. 2003;17(20):2591-2603. DOI: http://dx.doi.org/10.1101/gad.269003
7. Gosmain Y, Cheyssac C, Masson MH, Guerardel A, Poisson C, Philippe J. Pax6 is a key component of regulated glucagon secretion. Endocrinology. 2012;153(9):4204-4215.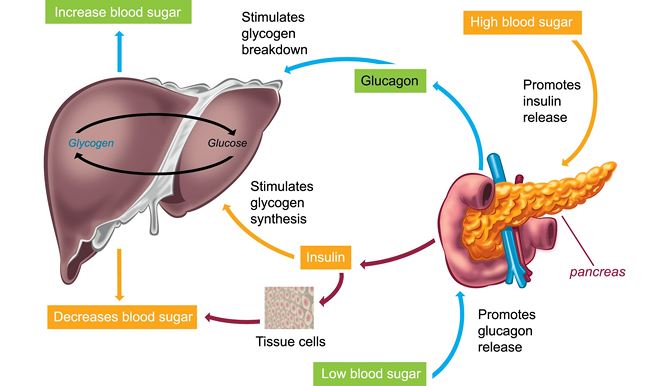 DOI: http://dx.doi.org/10.1210/en.2012-1425
DOI: http://dx.doi.org/10.1210/en.2012-1425
8. Gosmain Y, Marthinet E, Cheyssac C, Guerardel A, Mamin A, Katz LS, et al. Pax6 controls the expression of critical genes involved in pancreatic {alpha} cell differentiation and function. Journal of Biological Chemistry. 2010;285(43):33381-33393. DOI: http://dx.doi.org/10.1074/jbc.M110.147215
9. Hayashi Y, Yamamoto M, Mizoguchi H, Watanabe C, Ito R, Yamamoto S, et al. Mice deficient for glucagon gene-derived peptides display normoglycemia and hyperplasia of islet {alpha}-cells but not of intestinal L-cells. Molecular Endocrinology. 2009;23(12):1990-1999. DOI: http://dx.doi.org/10.1210/me.2009-0296
10. Irwin DM. Molecular evolution of mammalian incretin hormone genes. Regulatory Peptides. 2009;155(1-3):121-130. DOI: http://dx.doi.org/10.1016/j.regpep.2009.04.009
11. Holst JJ, Vilsboll T, Deacon CF. The incretin system and its role in type 2 diabetes mellitus. Molecular and Cellular Endocrinology. 2009;297(1-2):127-136.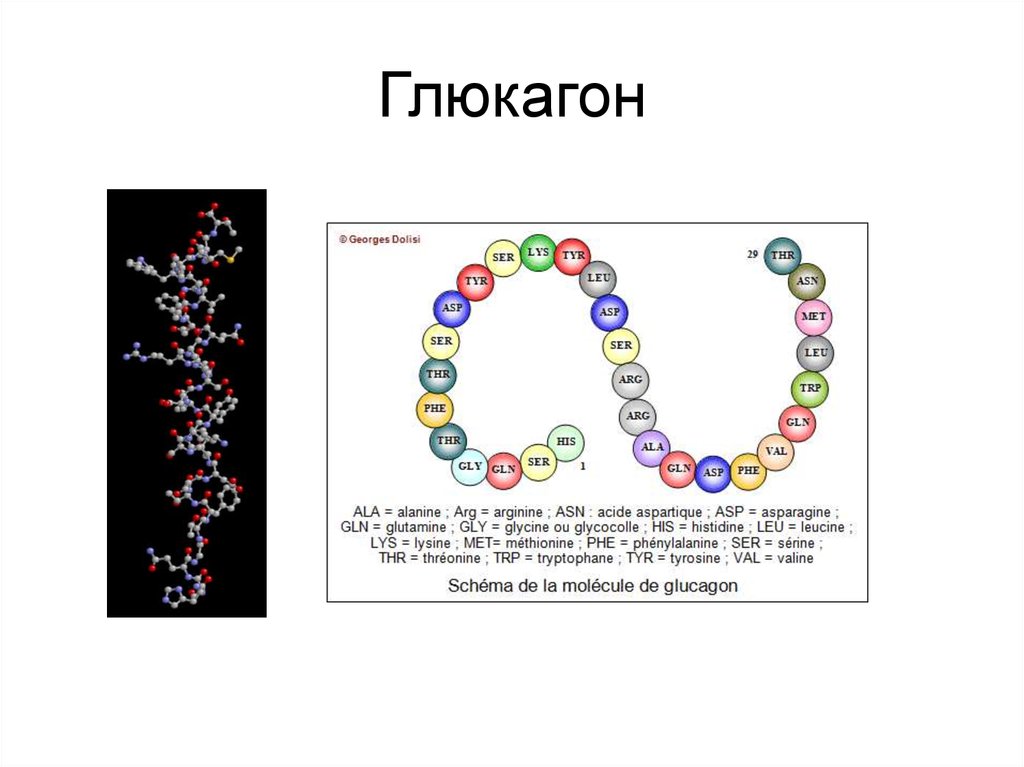 DOI: http://dx.doi.org/10.1016/j.mce.2008.08.012
DOI: http://dx.doi.org/10.1016/j.mce.2008.08.012
12. Kawamori D, Kurpad AJ, Hu J, Liew CW, Shih JL, Ford EL, et al. Insulin signaling in alpha cells modulates glucagon secretion in vivo. Cell Metabolism. 2009;9(4):350-361. DOI: http://dx.doi.org/10.1016/j.cmet.2009.02.007
13. Holst JJ, Christensen M, Lund A, de Heer J, Svendsen B, Kielgast U, et al. Regulation of glucagon secretion by incretins. Diabetes Obes Metab. 2011;13 Suppl 1:89-94. DOI: http://dx.doi.org/10.1111/j.1463-1326.2011.01452.x
14. Balas B, Baig MR, Watson C, Dunning BE, Ligueros-Saylan M, Wang Y, et al. The dipeptidyl peptidase IV inhibitor vildagliptin suppresses endogenous glucose production and enhances islet function after single-dose administration in type 2 diabetic patients. Journal of Clinical Endocrinology and Metabolism. 2007;92(4):1249-1255. DOI: http://dx.doi.org/10.1210/jc.2006-1882
15. Kieffer TJ, Habener JF. The glucagon-like peptides. Endocrine Reviews. 1999;20(6):876-913. DOI: http://dx. doi.org/10.1210/er.20.6.876
doi.org/10.1210/er.20.6.876
16. Kielgast U, Holst JJ, Madsbad S. Antidiabetic actions of endogenous and exogenous GLP-1 in type 1 diabetic patients with and without residual ß-cell function. Diabetes. 2011;60(5):1599-1607. DOI: http://dx.doi.org/10.2337/db10-1790
17. Ahren B. Autonomic regulation of islet hormone secretion—implications for health and disease. Diabetologia. 2000;43(4):393-410. DOI: http://dx.doi.org/10.1007/s001250051322
особенности, функции, важность для организма
- Особенности поджелудочной железы у детей и взрослых
- Роль и функции поджелудочной железы
- Как работает поджелудочная железа?
- Ферменты поджелудочной железы
- Роль гормонов
- Как предотвратить сбои в работе поджелудочной железы?
Изображение от freepic.diller на Freepik
Поджелудочная железа является одним из важнейших внутренних органов. Это небольшой, размером с ладонь, орган, который находится между желудком и позвоночником.Поджелудочная железа (ПЖ) содержит три отдела, которые отвечают за продуцирование ферментов, помогающих переваривать пищу. ПЖ также вырабатывает гормоны, призванные поддерживать в норме уровень глюкозы.
Особенности поджелудочной железы у детей и взрослых
Поджелудочная железа является довольно чувствительным органом. При малейших сбоях в его работе сразу ухудшается самочувствие человека. У взрослых людей размеры этого органа достигают 22 см, вес до 80 г.
Формирование органа происходит на 4-5 неделе после зачатия. Образуется поджелудочная железа из энтодермы и мезенхимы, располагается возле печени. При развитии орган обретает части: хвост, тело, головку. Свои основные функции ПЖ начинает выполнять уже в конце 1-го триместра беременности. Некоторое время орган является подвижным, что объясняется отсутствием надежной фиксации. Ближе к 6-ти годам занимает постоянное положение.
Роль и функции поджелудочной железы
ПЖ обеспечивает сразу несколько функций: выработку гормонов и пищеварительных ферментов.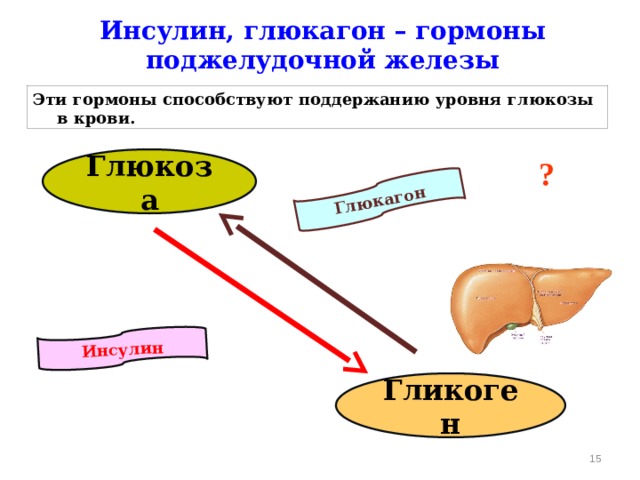 Является внешне- и внутрисекреторной железой.
Является внешне- и внутрисекреторной железой.
Поджелудочная железа продуцирует гормоны, обеспечивающие расщепление жирных кислот, необходимых для работы почек, сердца, мышц. Также ПЖ отвечает за производство гормонов, регулирующих уровень сахара (инсулина, глюкагона). Выделяет грелин, который отвечает за позывы к приему пищи. Обеспечивает участие в обменных процессах: жировом, углеводном, белковом.
ПЖ также отвечает за выработку ферментов, необходимых для пищеварения. Ключевой задачей ферментов является обмен углеводов, белков, жиров.
При сбое одной функции другие остаются в норме, благодаря делению на разные отделы, отвечающие за выработку ферментов/гормонов. Так, при сахарном диабете не наблюдается расстройств пищеварения, а перенесенные воспаления органа не обязательно вызывают стойкую гипогликемию. Однако важно понимать, что патологические изменения органа способны негативно отражаться на энергообеспечении организма и углеводно-жировом обмене.
Как работает поджелудочная железа?
Составляющие ПЖ – островки Лангерганса. Они состоят из клеток, вырабатывающих гормоны:
- дельта-клетки — выполняют выработку соматостатина, гастрина и грелина;
- бета-клетки — обеспечивают производство инсулина;
- а-клетки — вырабатывают глюкагон;
- РР-клетки, производят панкреатический полипептид.
В бета-клетках происходит синтез белка проинсулина. При отделении молекул C-пептида он преобразуется в инсулин. Та часть, которая не синтезировалась, проникает в кровь в неизменном виде. Инсулин требуется организму для транспортировки глюкозы, которая выступает главным источником энергии. Также он отвечает за доставку аминокислот и калия в клетки. Сам он не способен проникать в клетку, но может воздействовать на ее рецепторы. Недостаточность выработки инсулина возникает при повреждении бета-клеток. В результате у человека развивается сахарный диабет первого типа.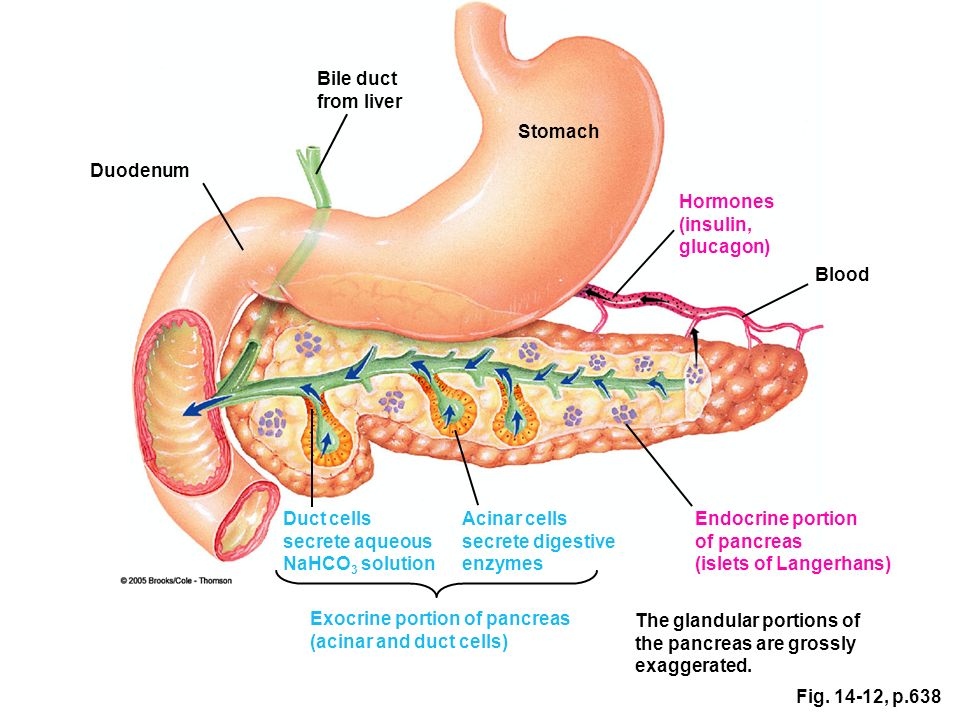
Глюкагон (антагонист инсулина) производится a-клетками ПЖ. При повышении его уровня организм получает сигнал о потребности в глюкозе. Обеспечивается это трансформацией гликогена до получения глюкозы либо ее образованием с помощью глюконеогенеза.
За стимуляцию желудочной секреции отвечает гастрин. Уровень его концентрации меняется на протяжении суток. Возрастает после употребления еды практически в два раза. Выработка происходит при падении в желудке уровня соляной кислоты. Соматостатин обеспечивает воздействие на систему пищеварения путем подавления выработки гормонов (глюкагон, гастрин, инсулин) и ферментов.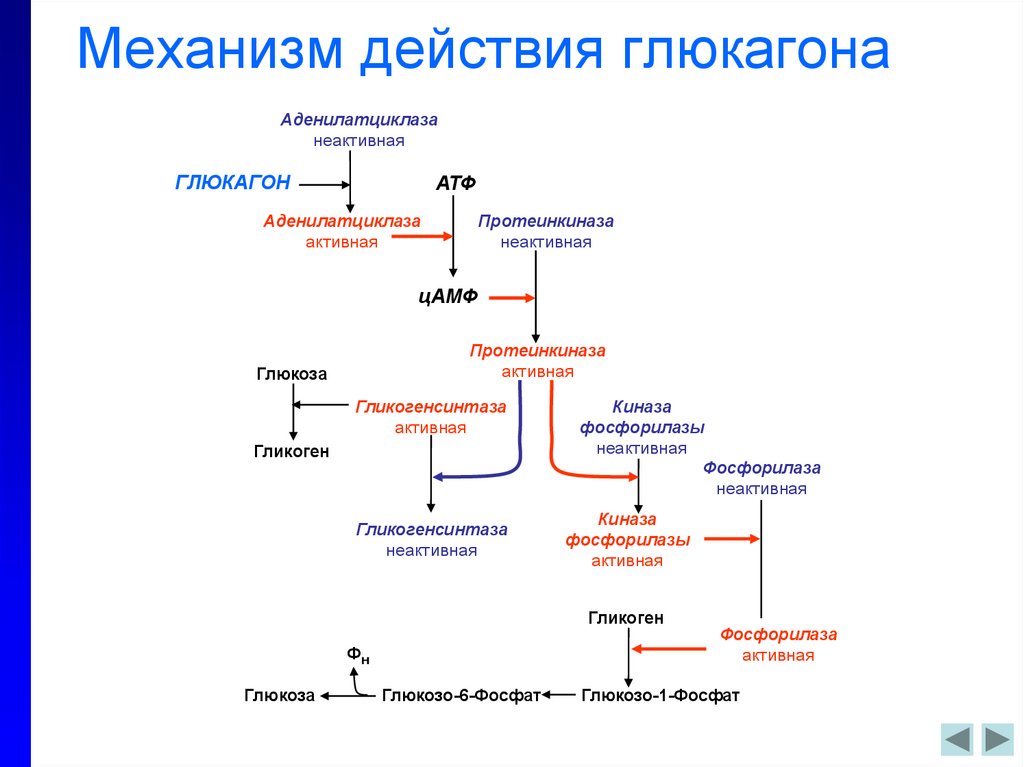
Ферменты поджелудочной железы
ПЖ вырабатывает пищеварительный сок, насыщенный ферментами. На клеточном уровне происходит выработка проферментов, которые до определенного момента остаются пассивными. После попадания пищи в желудок они активируются. Дополнительно в 12-перстную кишку поступают гормоны, активирующие ферменты поджелудочной. Выработка ферментов зависит от панкреозимина, секретина, выделяемых слизистой тонкой кишки при проникновении желудочного сока. Раздражающее воздействие оказывает соляная кислота.
Для участия в процессе пищеварения поджелудочная железа вырабатывает:
- Амилазу — выполняет расщепление углеводов.
- Трипсин, химотрипсин — после этапов переваривания белка в желудке выполняет его расщепление.
- Липазу — обеспечивает расщепление жиров.
Синтез амилазы частично проводится слюнными железами, в то время как трипсин продуцируется исключительно клетками ПЖ. Выработка липазы осуществляется не только ПЖ, но и другими органами: кишечником, печенью, легкими. Фермент относится к водорастворимым и участвует в расщеплении нейтральных жиров. Обеспечивает важнейшую роль в процессах энергообеспечения, транспортирует полиненасыщенные жирные кислоты и способствует всасыванию витаминов, отвечающих за растворение жиров. Запускается механизм производства ферментов после поступления пищи в организм.
Выработка липазы осуществляется не только ПЖ, но и другими органами: кишечником, печенью, легкими. Фермент относится к водорастворимым и участвует в расщеплении нейтральных жиров. Обеспечивает важнейшую роль в процессах энергообеспечения, транспортирует полиненасыщенные жирные кислоты и способствует всасыванию витаминов, отвечающих за растворение жиров. Запускается механизм производства ферментов после поступления пищи в организм.
Роль гормонов
Инсулин и глюкагон обеспечивают контроль за уровнем сахара в крови. Инсулин обеспечивает поступление глюкозы в клетку, стимулирует ее усвоение, снижает количество сахара в крови.
Основной задачей глюкагона является предотвращение гипогликемии Он повышает уровень сахара. За выработку отвечают а-клетки в островках Лангерганса, которые также вырабатывают липокаин, обеспечивающий защиту печени от перерождения.
Панкреатический полипептид, вырабатываемый PP-клетками, подавляет секрецию желудочного сока.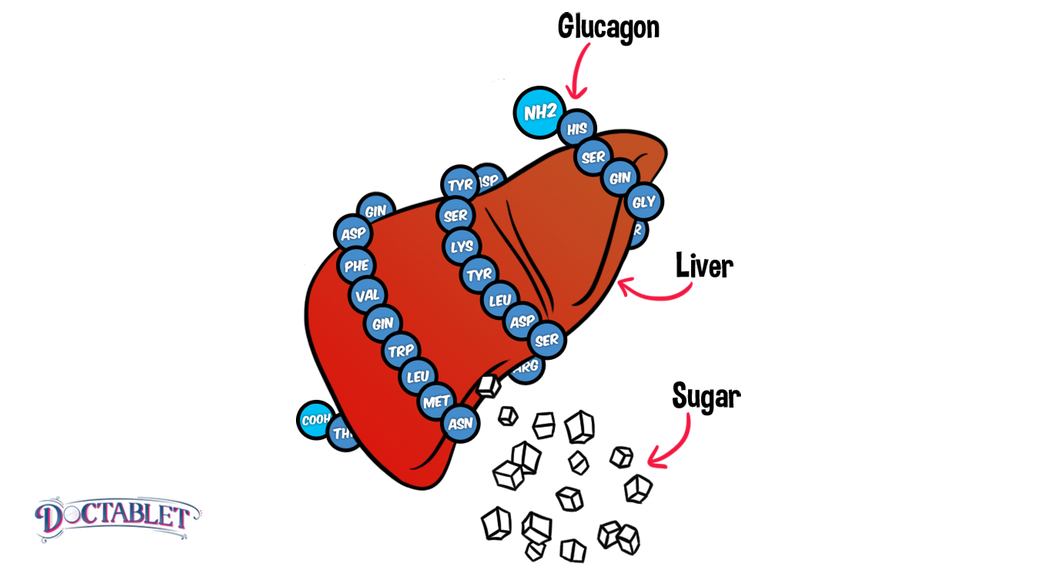 Он состоит из более чем трех десятков аминокислот, выполняющих секреторные функции. Таким образом, нарушения в работе ПЖ могут вызвать сбои и проблемы других органов и систем организма.
Он состоит из более чем трех десятков аминокислот, выполняющих секреторные функции. Таким образом, нарушения в работе ПЖ могут вызвать сбои и проблемы других органов и систем организма.
Как предотвратить сбои в работе поджелудочной железы?
При болях и неприятных ощущениях в области живота следует незамедлительно обращаться к гастроэнтерологу.
Панкреатит (воспаление ПЖ) сопровождается расстройством, рвотой, болями в районе левого подреберья, слабостью и учащенным пульсом. При хроническом воспалении боли менее интенсивные, в основном после употребления пищи. При появлении тревожных симптомов необходимы обследование и консультация специалиста.
Важно регулярно проверять уровень сахара в крови. Так можно предупредить развитие диабета и возникновение гипергликемической комы – состояния, при котором сахар превышает допустимые нормой значения в несколько раз.
Сильное снижение уровня сахара относительно допустимых значений – гипогликемия – также возможно при нарушениях работы поджелудочной железы.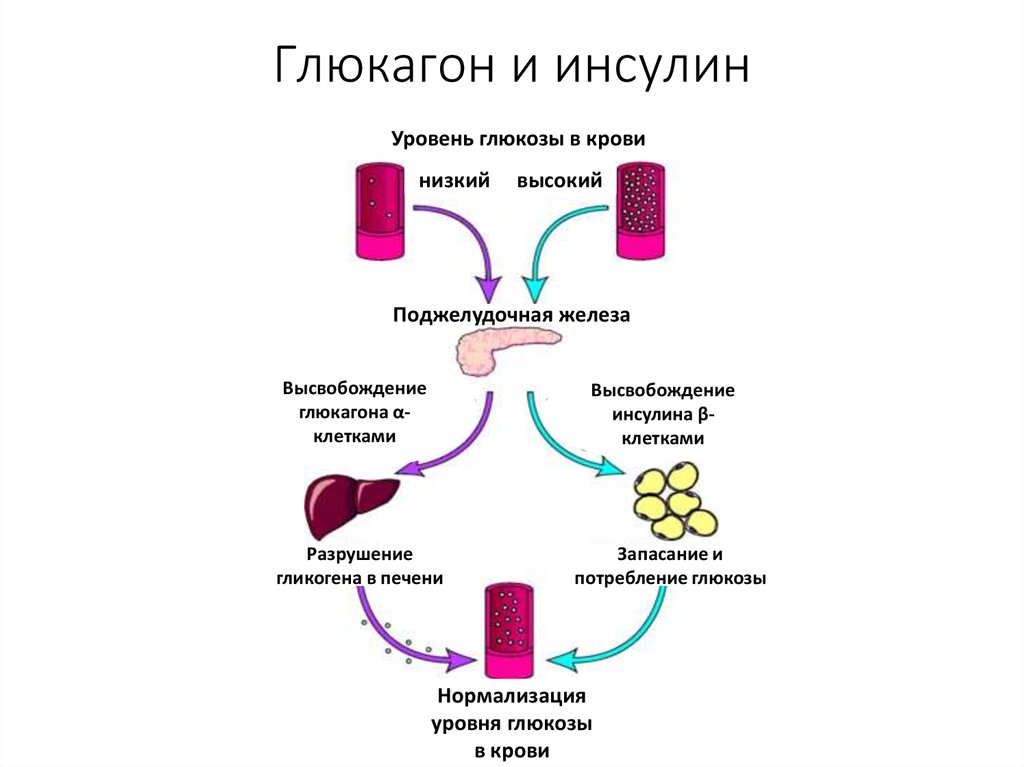 Это состояние даже более опасно, чем гипергликемия, так как повысить уровень сахара гораздо сложнее, чем его снизить. Следовательно, риск развития необратимых последствий во внутренних органах значительно выше, чем при гипергликемии.
Это состояние даже более опасно, чем гипергликемия, так как повысить уровень сахара гораздо сложнее, чем его снизить. Следовательно, риск развития необратимых последствий во внутренних органах значительно выше, чем при гипергликемии.
Профилактика повреждений поджелудочной железы состоит в правильном питании с низким содержанием быстрых углеводов: рафинированного сахара и продуктов на его основе (кондитерских изделий, фаст-фуда и прочих продуктов). Рацион должен быть сбалансирован и содержать белки, жиры и так называемые «длинные» углеводы: каши, фрукты (в умеренном количестве), овощи. Кроме того, рацион должен быть богат необходимыми микроэлементами, которые способствуют бесперебойной работе поджелудочной железы и других органов.
Инсулин, глюкагон и регуляция уровня глюкозы в крови
Человеческому организму необходимо поддерживать уровень глюкозы в крови (сахар в крови) в очень узком диапазоне. Инсулин и глюкагон являются гормонами, которые делают это возможным.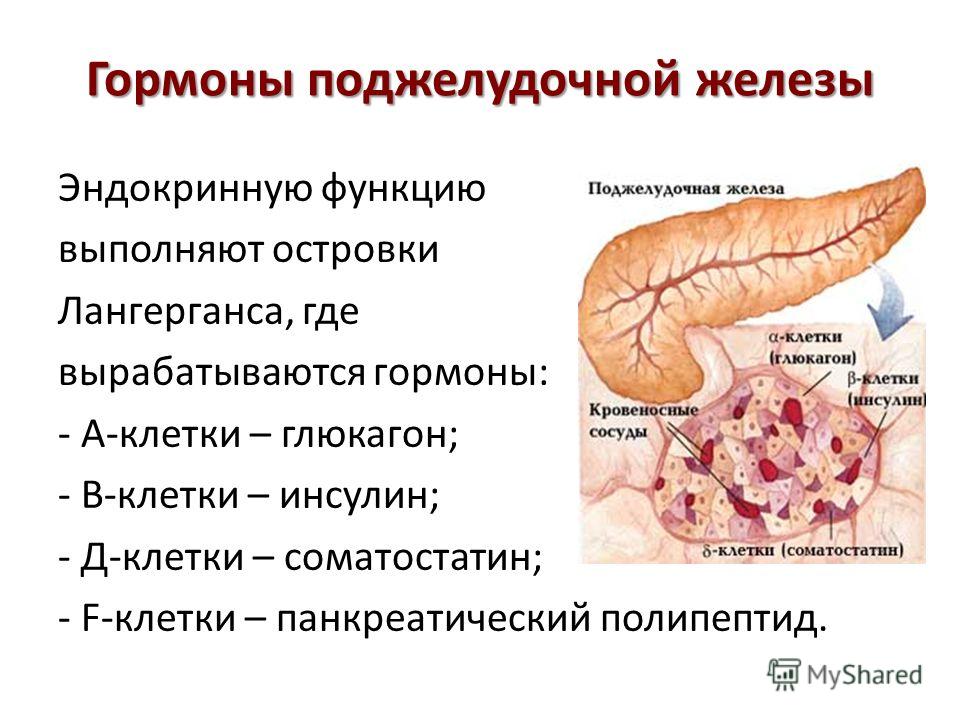
И инсулин, и глюкагон секретируются поджелудочной железой, поэтому их называют эндокринными гормонами поджелудочной железы. На рисунке справа показана тесная связь инсулина и глюкагона друг с другом.
Обратите внимание, что поджелудочная железа играет центральную роль в этой схеме. Именно выработка инсулина и глюкагона поджелудочной железой в конечном итоге определяет наличие у пациента диабета, гипогликемии или какой-либо другой проблемы с сахаром.
Уровни инсулина и глюкозы в крови
Инсулин и глюкагон являются гормонами, секретируемыми островковыми клетками поджелудочной железы. Они оба секретируются в ответ на уровень сахара в крови, но противоположным образом.
В норме инсулин секретируется бета-клетками (разновидностью островковых клеток) поджелудочной железы. Стимулом для секреции инсулина является высокий уровень глюкозы в крови — это так просто. Хотя уровень инсулина, секретируемого поджелудочной железой, всегда низкий, его количество, секретируемое в кровь, увеличивается по мере повышения уровня глюкозы в крови.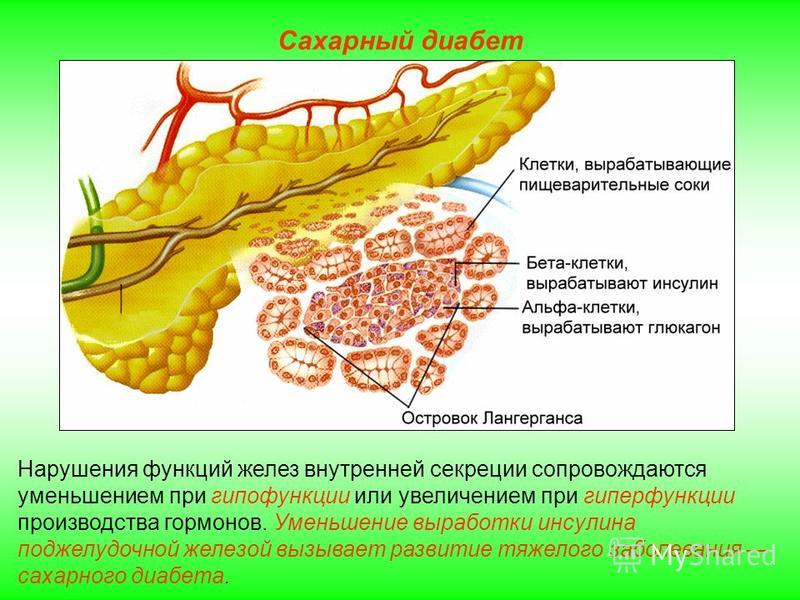 Точно так же, когда уровень глюкозы в крови падает, количество инсулина, секретируемого островками поджелудочной железы, снижается.
Точно так же, когда уровень глюкозы в крови падает, количество инсулина, секретируемого островками поджелудочной железы, снижается.
Инсулин воздействует на ряд клеток, включая мышцы, красную кровь и жир. В ответ на инсулин эти клетки поглощают глюкозу из крови, в результате чего высокий уровень глюкозы в крови снижается до нормального уровня.
Как рецептурный инсулин контролирует уровень глюкозы в кровиПри диабете 1 типа поджелудочная железа не вырабатывает инсулин. В этом случае необходимо принимать инсулин, отпускаемый по рецепту, для контроля уровня глюкозы в крови. Людям с диабетом 2 типа также может потребоваться прием инсулина или пероральных лекарств от диабета для контроля уровня глюкозы в крови.
Инсулин нельзя принимать внутрь, так как он плохо всасывается во рту. Кроме того, инсулин быстро расщепляется желудочной кислотой. Поэтому инсулин необходимо вводить под кожу или вдыхать, и его можно вводить несколькими путями: шприцами, ручками, инсулиновыми помпами и ингаляторами.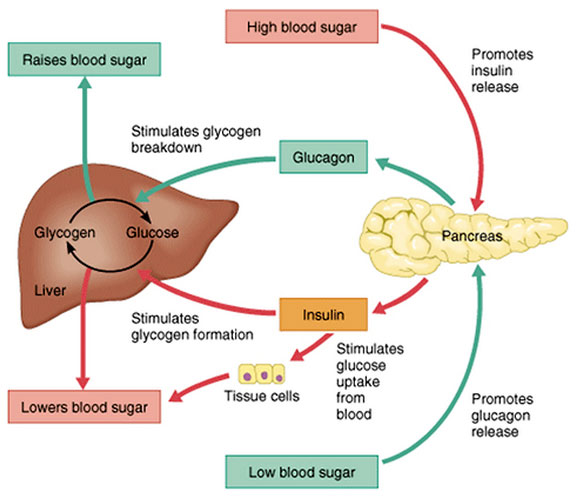
Инсулин, вводимый через шприц, поставляется во флаконе. Вы должны набрать дозу в шприц, чтобы принять предписанную дозу. Инсулиновые шприц-ручки, одноразовые или многоразовые, предварительно заполнены инсулином. Для каждой дозы на шприц-ручку навинчивается новый колпачок.
Инсулиновая помпа — это небольшое устройство, которое вводит инсулин через трубку, вставленную в кожу. Помпа имитирует функцию поджелудочной железы, доставляя небольшое количество инсулина в течение 24 часов в сутки. Вы также можете настроить доставку дозы инсулина во время еды.
Как это ни звучит, ингаляционный инсулин вдыхают через ингалятор. Ингаляционный инсулин принимают до начала приема пищи.
Инсулин, отпускаемый по рецепту, можно полностью настроить в соответствии с вашими потребностями. Существует не только несколько способов введения инсулина, но и различные типы инсулина на выбор. Инсулин классифицируется по началу, пику и продолжительности действия. Начало — это когда инсулин начинает работать в организме.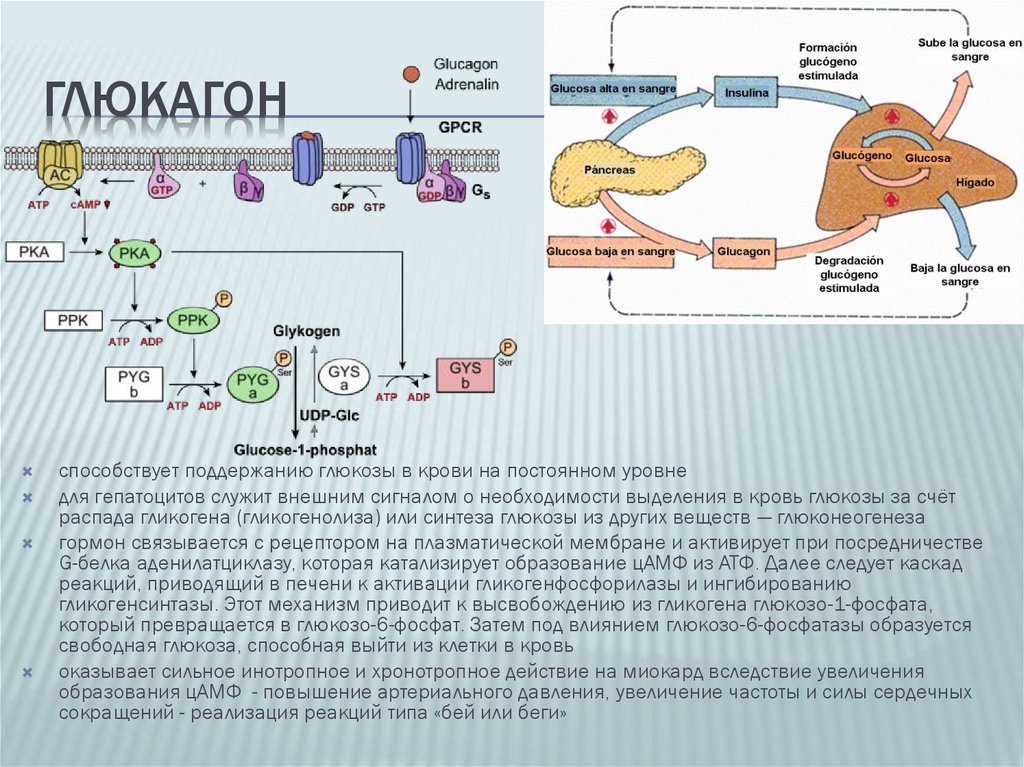 Пик действия инсулина наступает, когда он наиболее эффективен и имеет наибольшую силу. Продолжительность — это то, как долго инсулин будет способствовать снижению уровня глюкозы.
Пик действия инсулина наступает, когда он наиболее эффективен и имеет наибольшую силу. Продолжительность — это то, как долго инсулин будет способствовать снижению уровня глюкозы.
Болюсный инсулин представляет собой инсулин короткого или короткого действия, который принимается перед едой для контроля уровня глюкозы. Болюсный инсулин имеет быстрое начало действия, достигая пика в период от 10 минут до трех часов после его приема, и, кроме того, он действует в среднем от двух до шести часов. Инсулин быстрого или короткого действия также можно принимать для коррекции высокого уровня глюкозы в крови.
Для контроля уровня глюкозы на ночь или между приемами пищи назначают базальный инсулин. Базальный инсулин представляет собой инсулин средней продолжительности действия или инсулин длительного действия. Обычно используется инсулиновая схема, включающая как базальный, так и болюсный инсулин, особенно у людей с диабетом 1 типа.
Что еще делает инсулин в организме Инсулин не просто снижает уровень глюкозы в крови.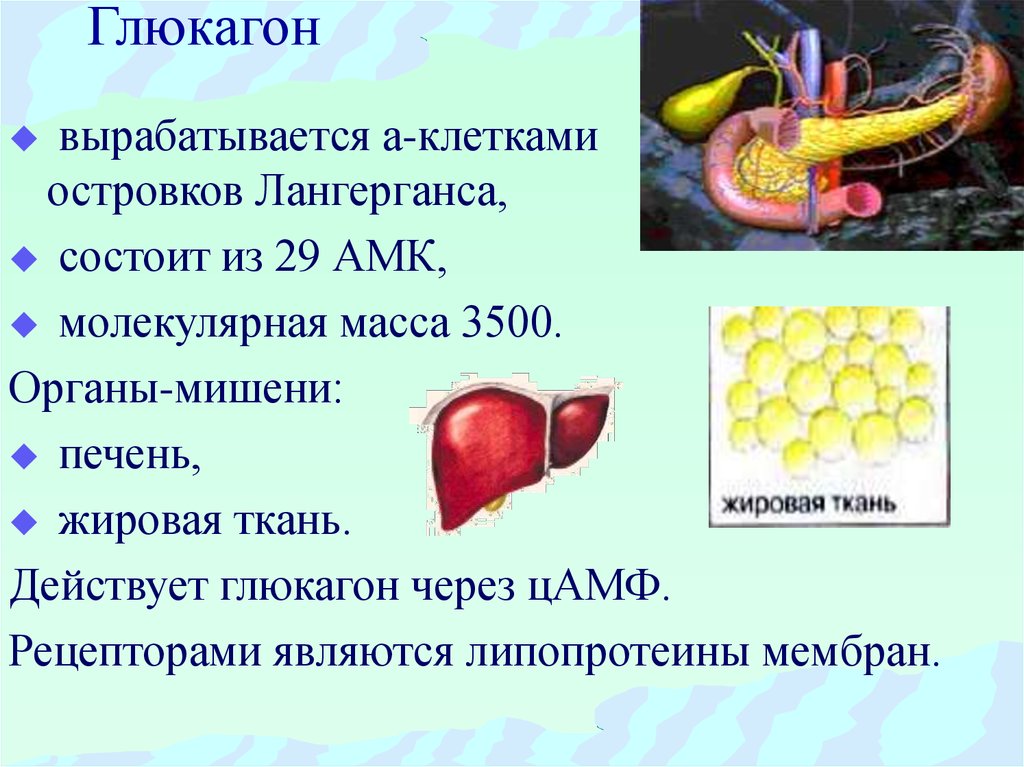 Инсулин — это запасной гормон, который способствует выработке жира и препятствует его расщеплению. В печени инсулин позволяет глюкозе превращаться в гликоген. Гликоген – это запасенная глюкоза, которая расщепляется, когда организм нуждается в энергии. Инсулин также предотвращает выработку глюкозы из других питательных веществ.
Инсулин — это запасной гормон, который способствует выработке жира и препятствует его расщеплению. В печени инсулин позволяет глюкозе превращаться в гликоген. Гликоген – это запасенная глюкоза, которая расщепляется, когда организм нуждается в энергии. Инсулин также предотвращает выработку глюкозы из других питательных веществ.
В мышцах инсулин способствует образованию гликогена и белка, не давая организму расщеплять белок. Инсулин регулирует уровень глюкозы и тесно связан с глюкагоном.
Глюкагон и контроль уровня глюкозы в крови
Глюкагон секретируется альфа-клетками островков поджелудочной железы почти так же, как инсулин, но в обратном направлении. Если уровень глюкозы в крови высокий, то глюкагон не секретируется.
Однако, когда уровень глюкозы в крови падает (например, между приемами пищи и во время физических упражнений), секретируется все больше и больше глюкагона.
Подобно инсулину, глюкагон оказывает влияние на многие клетки организма, но особенно на печень.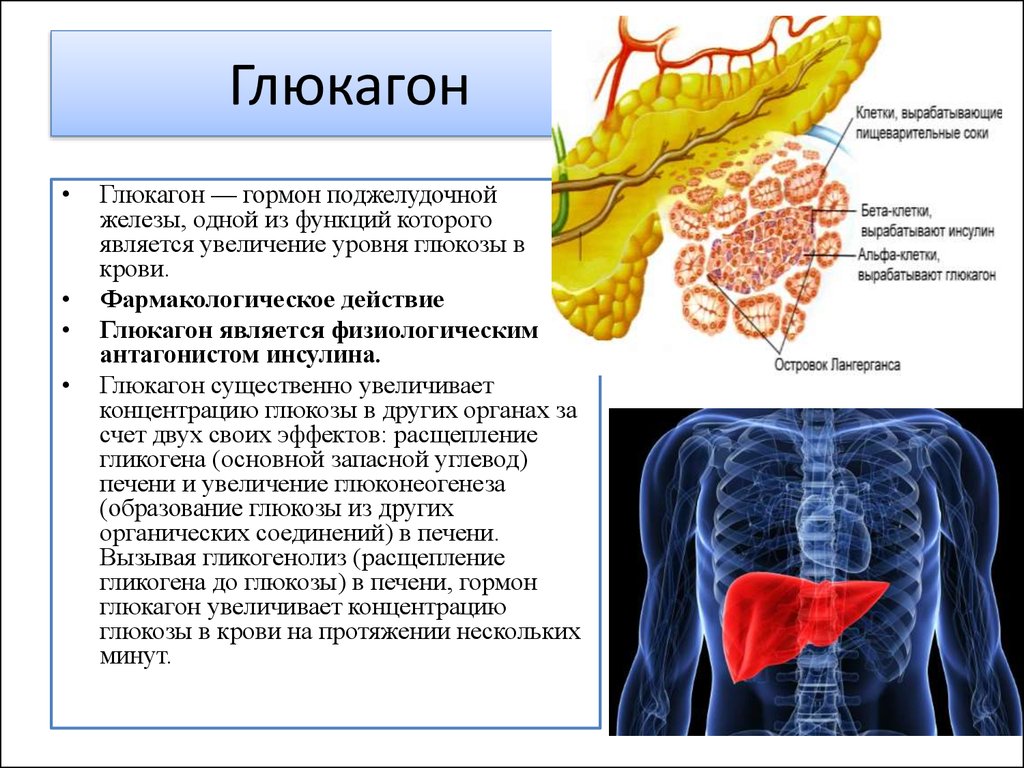
Эффект глюкагона заключается в том, чтобы заставить печень высвобождать глюкозу, хранящуюся в ее клетках, в кровоток, что приводит к повышению уровня глюкозы в крови. Глюкагон также побуждает печень (и некоторые другие клетки, такие как мышцы) производить глюкозу из строительных блоков, полученных из других питательных веществ, содержащихся в организме, таких как белок.
Как действует рецепт ГлюкагонГлюкагон назначают для лечения случаев тяжелой гипогликемии или низкого уровня глюкозы в крови. Его часто назначают, если вы принимаете лекарства, снижающие уровень глюкозы, такие как инсулин или сульфонилмочевина. Глюкагон быстро повышает уровень глюкозы в крови.
Глюкагон, отпускаемый по рецепту, доступен в нескольких формах, и его можно держать под рукой на случай чрезвычайной ситуации. Устройство для назального глюкагона доставляет порошкообразный глюкагон в кровь через нос. Ручка с глюкагоном предварительно заполнена смешанным раствором глюкагона и готова к немедленной инъекции. Если назальный или предварительно заполненный глюкагон не подходит, есть набор глюкагона, который можно быстро смешать и приготовить.
Если назальный или предварительно заполненный глюкагон не подходит, есть набор глюкагона, который можно быстро смешать и приготовить.
Глюкагон часто используется, когда вы не можете есть источник углеводов для повышения уровня глюкозы. Членам семьи, друзьям, школьному персоналу или коллегам рекомендуется знать, как использовать глюкагон на случай, если вы недостаточно рассудительны, чтобы сделать это самостоятельно. Если человек без сознания, его следует положить на бок, чтобы он не задохнулся. Кроме того, когда глюкагон начинает действовать, человек должен есть углеводы (фрукты, фруктовые соки, таблетки с глюкозой и т. д.), чтобы еще больше повысить уровень глюкозы.
Что еще делает глюкагон в организме Помимо повышения уровня глюкозы, глюкагон играет в организме и другие функции. В жировой ткани глюкагон помогает стимулировать расщепление жира, обеспечивая организм энергией при низком уровне глюкозы. Другие эффекты глюкагона включают увеличение частоты сердечных сокращений и замедление пищеварения.
На что может указывать уровень глюкозы в крови
Наше тело хочет, чтобы уровень глюкозы в крови поддерживался на уровне от 70 мг/дл до 110 мг/дл (мг/дл означает миллиграммы глюкозы в 100 миллилитрах крови). Ниже 70 называется гипогликемией. Выше 110 может быть нормальным, если вы ели в последние 2-3 часа. Вот почему ваш врач хочет измерить уровень глюкозы в крови во время голодания, когда уровень должен быть между 70 и 110.
Однако даже после того, как вы поели, уровень глюкозы должен быть ниже 180. Выше 180 называется гипергликемией (что переводится как «слишком много глюкозы в крови»). Если уровень сахара в крови выше 200 после употребления воды с сахаром (тест на толерантность к глюкозе), то у вас диагностирован диабет.
Четыре способа приема инсулина: https://www.cdc.gov/diabetes/basics/type-1-4-ways-to-take-insulin.html
Комитет профессиональной практики Американской диабетической ассоциации, Draznin B, Aroda В.Р., Бакрис Г., Бенсон Г., Браун Ф. М., Фриман Р., Грин Дж., Хуан Э., Исаакс Д., Кахан С., Леон Дж., Лайонс С.К., Питерс А.Л., Прахалад П., Ройш ДЖЕБ, Янг-Хайман Д. 9. Фармакологические подходы к лечению гликемии: стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S125-S143. дои: 10.2337/dc22-S009. PMID: 34964831.
М., Фриман Р., Грин Дж., Хуан Э., Исаакс Д., Кахан С., Леон Дж., Лайонс С.К., Питерс А.Л., Прахалад П., Ройш ДЖЕБ, Янг-Хайман Д. 9. Фармакологические подходы к лечению гликемии: стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S125-S143. дои: 10.2337/dc22-S009. PMID: 34964831.
Глюкагон и другие экстренные препараты глюкозы: https://diabetes.org/healthy-living/medication-treatments/glucagon-other-emergency-glucose-products
Комитет по профессиональной практике Американской диабетической ассоциации, Draznin B, Aroda VR, Bakris G, Benson G, Brown FM, Freeman R, Green J, Huang E, Isaacs D, Kahan S, Leon J, Lyons SK, Peters AL, Prahalad P, Reusch JEB, Young-Hyman D. 6. Гликемический индекс Цели: Стандарты медицинской помощи при сахарном диабете-2022. Лечение диабета. 2022 1 января; 45 (Приложение 1): S83-S96. дои: 10.2337/dc22-S006. PMID: 34964868.
Глюкагон: https://www.ncbi.nlm.nih.gov/books/NBK559195/
Zeigerer A, Sekar R, Kleinert M, et al.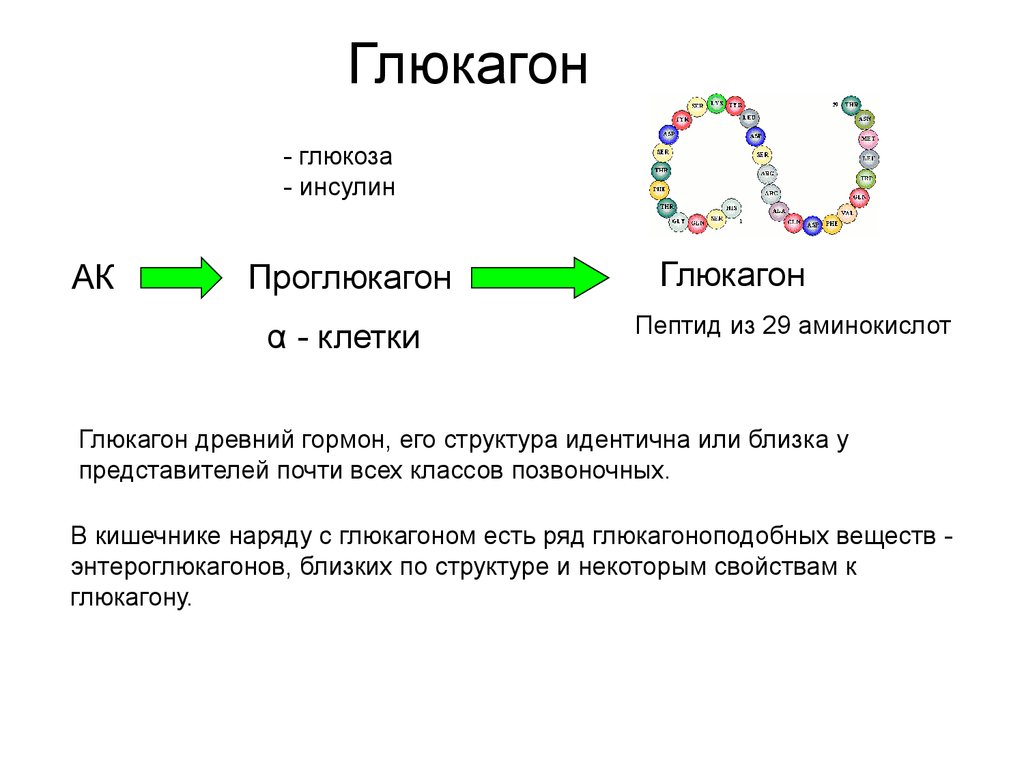 Метаболическое действие глюкагона в норме и при болезнях. Комплексная физиология. 2021;11(2):1759-1783. doi:10.1002/cphy.c200013
Метаболическое действие глюкагона в норме и при болезнях. Комплексная физиология. 2021;11(2):1759-1783. doi:10.1002/cphy.c200013
Al-Massadi O, Fernø J, Diéguez C, et al. Глюкагон контролирует потребление пищи и энергетический баланс. Международный журнал молекулярных наук. 2019;20(16):3905. doi:10.3390/ijms20163905
Iqbal J, Wu H, Hu N, et al. Влияние агонистов рецептора глюкагоноподобного пептида-1 на массу тела у взрослых с ожирением без сахарного диабета — систематический обзор и метаанализ рандомизированных контролируемых исследований. Обзоры ожирения. 2022;23(6). doi:10.1111/obr.13435
Примечания: эта статья была первоначально опубликована 29 марта 2009 г. и последний раз обновлялась 24 января 2023 г.0106 Клиника паращитовидной железы Нормана
Джеймс Норман, доктор медицины, FACS, FACE, признан одним из ведущих мировых экспертов по заболеваниям паращитовидной железы и самым опытным хирургом щитовидной железы/паращитовидной железы в мире. Он сертифицирован как в хирургии, так и в эндокринологии, а также является членом Американского колледжа хирургов (FACS) и Американского колледжа эндокринологии (FACE). Он признан изобретателем минимально инвазивной хирургии паращитовидной железы в середине 1990-х годов, и ему приписывают радикальное изменение способа проведения операции на паращитовидной железе.
Он сертифицирован как в хирургии, так и в эндокринологии, а также является членом Американского колледжа хирургов (FACS) и Американского колледжа эндокринологии (FACE). Он признан изобретателем минимально инвазивной хирургии паращитовидной железы в середине 1990-х годов, и ему приписывают радикальное изменение способа проведения операции на паращитовидной железе.
Глюкагон
VIVO Патофизиология
Эндокринная система > Эндокринная поджелудочная железа
Глюкагон играет важную роль в поддержании нормальной концентрации глюкозы в крови и часто описывается как обладающий эффектом, противоположным действию инсулина. То есть глюкагон имеет эффект повышения уровня глюкозы в крови.
Глюкагон представляет собой линейный пептид из 29 аминокислот. Его первичная последовательность почти полностью консервативна среди позвоночных, и она структурно родственна секретиновому семейству пептидных гормонов. Глюкагон синтезируется в виде проглюкагона и протеолитически обрабатывается с образованием глюкагона в альфа-клетках панкреатических островков. Проглюкагон также экспрессируется в кишечном тракте, где он процессируется не в глюкагон, а в семейство глюкагоноподобных пептидов (энтероглюкагон).
Проглюкагон также экспрессируется в кишечном тракте, где он процессируется не в глюкагон, а в семейство глюкагоноподобных пептидов (энтероглюкагон).
Физиологические эффекты глюкагона
Основным эффектом глюкагона является стимуляция повышения концентрации глюкозы в крови. Как обсуждалось ранее, мозг, в частности, абсолютно зависит от глюкозы в качестве топлива, потому что нейроны не могут использовать альтернативные источники энергии, такие как жирные кислоты, в сколько-нибудь значительной степени. Когда уровень глюкозы в крови начинает падать ниже нормального диапазона, необходимо найти и закачать в кровь дополнительную глюкозу. Глюкагон контролирует два основных метаболических пути в печени, заставляя этот орган распределять глюкозу по всему телу:
- Глюкагон стимулирует распад гликогена, хранящегося в печени. Когда уровень глюкозы в крови высок, большое количество глюкозы поглощается печенью. Под влиянием инсулина большая часть этой глюкозы запасается в виде гликогена.
 Позже, когда уровень глюкозы в крови начинает падать, выделяется глюкагон, который воздействует на гепатоциты, активируя ферменты, деполимеризующие гликоген и высвобождающие глюкозу.
Позже, когда уровень глюкозы в крови начинает падать, выделяется глюкагон, который воздействует на гепатоциты, активируя ферменты, деполимеризующие гликоген и высвобождающие глюкозу. - Глюкагон активирует глюконеогенез в печени. Глюконеогенез представляет собой путь, посредством которого негексозные субстраты, такие как аминокислоты, превращаются в глюкозу. Таким образом, он обеспечивает еще один источник глюкозы для крови. Это особенно важно для животных, таких как кошки и овцы, которые не поглощают много глюкозы из кишечника, если вообще поглощают ее вообще. У этих видов активация глюконеогенных ферментов является основным механизмом, с помощью которого глюкагон выполняет свою работу.
Глюкагон также, по-видимому, оказывает незначительное влияние на усиление липолиза триглицеридов в жировой ткани, что можно рассматривать как дополнительное средство сохранения глюкозы в крови за счет обеспечения топливом жирных кислот для большинства клеток.
Контроль секреции глюкагона
Зная, что основным эффектом глюкагона является повышение уровня глюкозы в крови, понятно, что глюкагон секретируется в ответ на гипогликемию или низкие концентрации глюкозы в крови.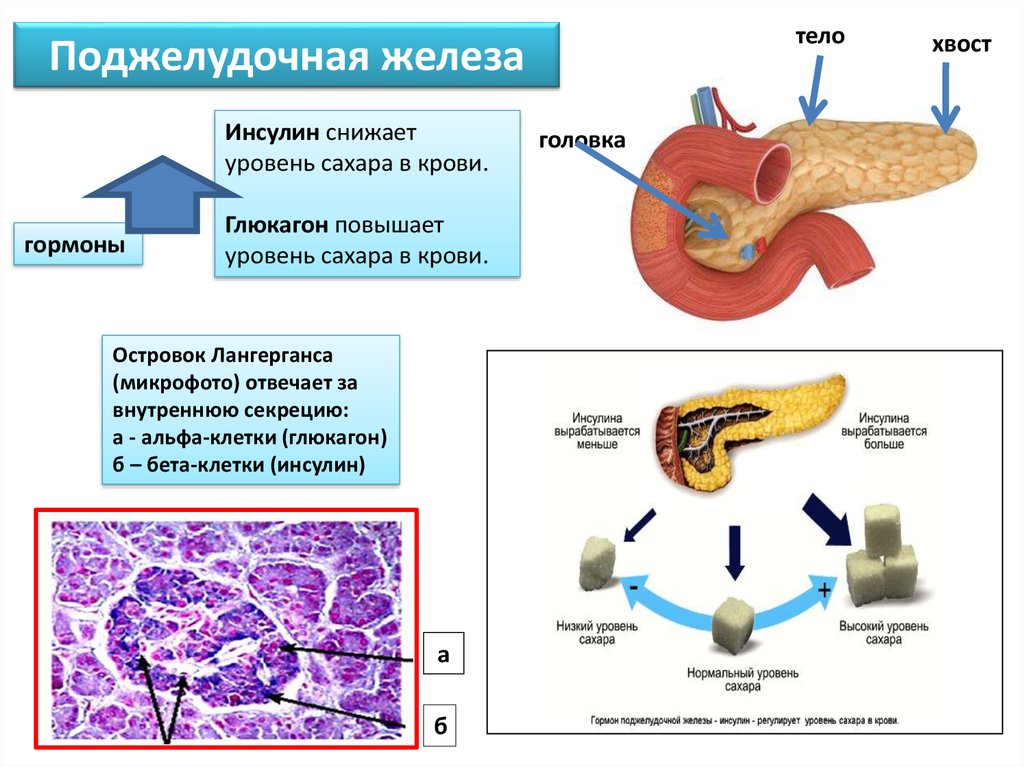
Известны два других состояния, вызывающих секрецию глюкагона:
- Повышенный уровень аминокислот в крови, как это будет видно после употребления богатой белком пищи: в этой ситуации глюкагон будет способствовать превращению избыточных аминокислот в глюкозу за счет усиления глюконеогенеза. Поскольку высокий уровень аминокислот в крови также стимулирует высвобождение инсулина, это будет ситуация, в которой активны как инсулин, так и глюкагон.
- Упражнения: В этом случае неясно, является ли фактический стимул физическими упражнениями как таковыми или сопутствующим истощением глюкозы, вызванным физическими упражнениями.
Что касается отрицательного контроля, секреция глюкагона ингибируется высоким уровнем глюкозы в крови. Неясно, отражает ли это прямое влияние глюкозы на альфа-клетку или, возможно, действие инсулина, который, как известно, ослабляет высвобождение глюкагона. Другим хорошо известным гормоном, ингибирующим секрецию глюкагона, является соматостатин.

 Поджелудочная железа (ПЖ) содержит три отдела, которые отвечают за продуцирование ферментов, помогающих переваривать пищу. ПЖ также вырабатывает гормоны, призванные поддерживать в норме уровень глюкозы.
Поджелудочная железа (ПЖ) содержит три отдела, которые отвечают за продуцирование ферментов, помогающих переваривать пищу. ПЖ также вырабатывает гормоны, призванные поддерживать в норме уровень глюкозы. Позже, когда уровень глюкозы в крови начинает падать, выделяется глюкагон, который воздействует на гепатоциты, активируя ферменты, деполимеризующие гликоген и высвобождающие глюкозу.
Позже, когда уровень глюкозы в крови начинает падать, выделяется глюкагон, который воздействует на гепатоциты, активируя ферменты, деполимеризующие гликоген и высвобождающие глюкозу.