Функция глюкагон: Гормон глюкагон — механизм действия, функция, секреция
функции, синтез, действие — SportWiki энциклопедия
Историческая справка[править | править код]
Еще до открытия инсулина в островках поджелудочной железы были обнаружены разные группы клеток. Сам глюкагон был открыт Мерлином и Кимбаллом в 1923 г., менее чем через 2 года после инсулина. Однако если открытие инсулина вызвало ажиотаж, то глюкагоном мало кто заинтересовался. Только по прошествии более 40 лет стало ясно, какую важную физиологическую роль играет этот гормон в регуляции обмена глюкозы и кетоновых тел, но его роль как лекарственного средства и на сегодняшний день невелика. Глюкагон используют лишь для быстрого купирования гипогликемии, а также в лучевой диагностике в качестве препарата, подавляющего моторику кишечника.
Химические свойства[править | править код]
Глюкагон представляет собой одноцепочечный полипептид, состоящий из 29 аминокислотных остатков (рис. 61.6). Между глюкагоном и другими полипептидными гормонами, в том числе секретином, ВИП и гастроингибирующим пептидом, имеется значительная гомология.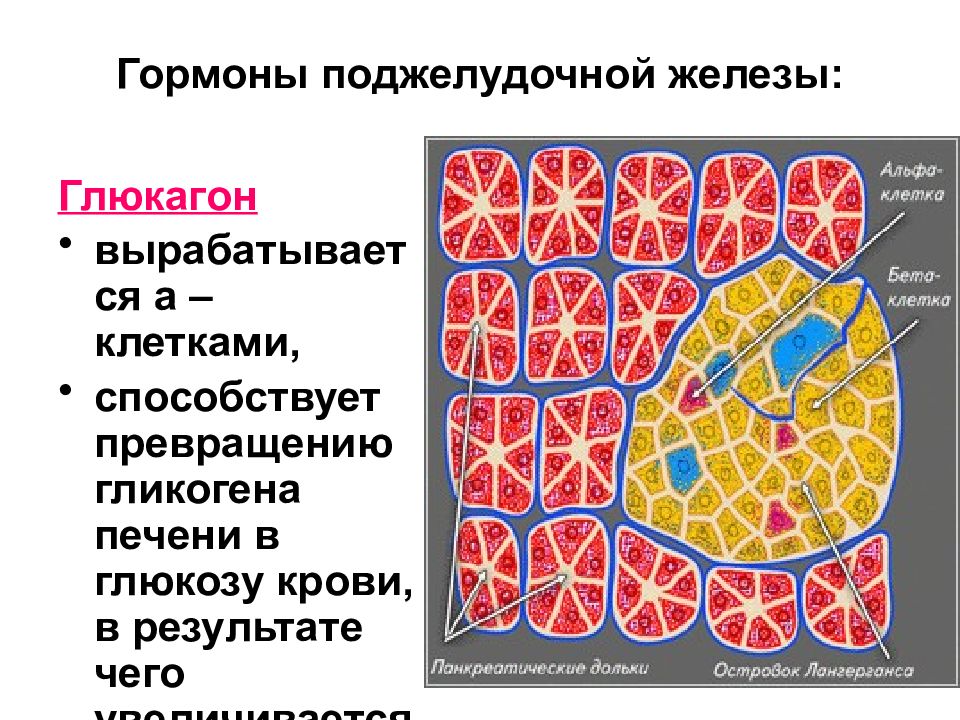
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислот и пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды (Mojsov et al., 1986). Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина.
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике.
Регуляция секреции[править | править код]
Секреция глюкагона регулируется глюкозой, поступающей с пищей, инсулином, аминокислотами и жирными кислотами. Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Большинство аминокислот стимулируют секрецию и глюкагона, и инсулина. Это объясняет, почему после приема чисто белковой пищи у человека не возникает опосредованная инсулином гипогликемия. Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина.
Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина.
Метаболизм[править | править код]
Глюкагон быстро разрушается в печени, почках и плазме, а также в тканях-мишенях (Peterson etal., 1982). EroT1/2 в плазме составляет всего 3—6 мин. Отщепление протеазами N-концевого остатка гистидина приводит к потере глюкагоном биологической активности.
Механизм действия[править | править код]
Глюкагон связывается с рецептором на мембране клеток-мишеней; этот рецептор представляет собой гликопротеид с молекулярной массой 60 ООО (Sheetz and Tager, 1988). Структура рецептора полностью не расшифрована, однако известно, что он сопряжен с Gj-белком, который активирует аденилатциклазу (гл. 2). Главный эффект глюкагона на гепатоциты опосредуется цАМФ. Модификация N-концевого участка молекулы глюкагона превращает его в частичный агонист: сродство к рецептору в той или иной степени сохраняется, а способность активировать аденилатциклазу в значительной степени утрачивается (Unson et al.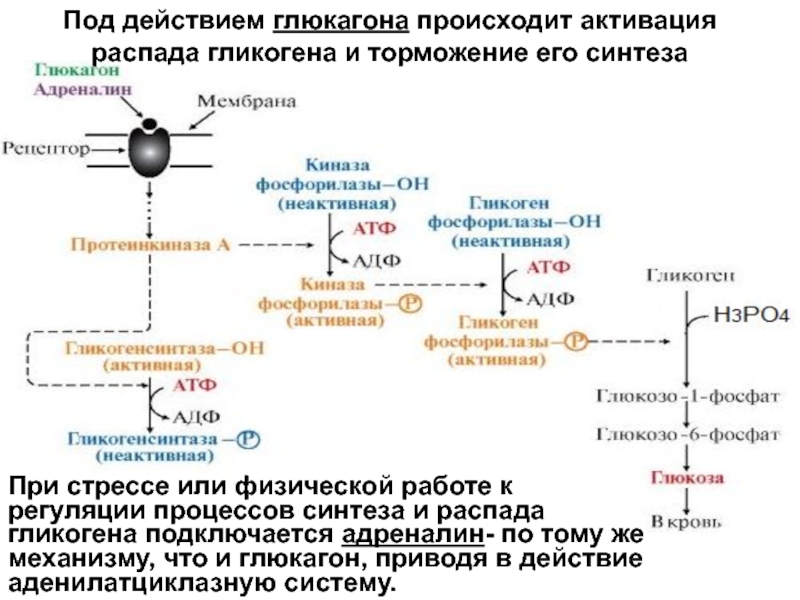 , 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
, 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
Посредством цАМФ-зависимого фосфорилирования глюкагон активирует фосфорилазу — фермент, который катализирует лимитирующую реакцию гликогенолиза. Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
цАМФ опосредует фосфорилирование еще одного бифункционального фермента — 6-фосфофрукто-2-киназы/фрукто-зо-2,6-дифосфатазы (Pilkis et al., 1981; Foster, 1984). От этого фермента зависит внутриклеточная концентрация фруктозо-2,6-дифосфата, который, в свою очередь, регулирует глюконеогенез и гликогенолиз. Когда концентрация глюкагона высока, а инсулина низка, 6-фосфофрукто-2-киназа/фрукго-зо-2,6-дифосфатаза фосфорилируется и работает как фосфата-за, снижая содержание фруктозо-2,6-дифосфата в печени.
Глюкагон, особенно в высоких концентрациях, действует не только на печень, но и на другие ткани. В жировой ткани он активирует аденилатциклазу и усиливает липолиз, в миокарде — увеличивает силу сердечных сокращений. Глюкагон расслабляет гладкие мышцы ЖКТ; такой же эффект оказывают аналоги гормона, не активирующие аденилатциклазу. В некоторых тканях (в том числе в печени) имеется еще один тип рецепторов глюкагона; связывание гормона с ними приводит к образованию ИФ3, ДАГ и увеличению внутриклеточной концентрации кальция (Murphy et al.
Применение[править | править код]
Глюкагон используют для лечения тяжелых эпизодов гипогликемии, обычно у больных сахарным диабетом, когда невозможно организовать в/в инфузию глюкозы. Кроме того, глюкагон применяют в лучевой диагностике как средство, подавляющее моторику ЖКТ.
Глюкагон, применяемый в лечебных целях, получают из бычьей и свиной поджелудочных желез. Аминокислотные последовательности человеческого, бычьего и свиного глюкагона идентичны. При гипогликемии 1 мг глюкагона вводят в/в, в/м или п/к. В экстренных ситуациях первые два пути введения предпочтительны. Улучшение наступает в течение 10 мин, что позволяет свести к минимуму риск поражения ЦНС. Гипергликемизирующий эффект глюкагона кратковременен и может вообще не проявиться, если запасы гликогена в печени истощены. После улучшения, наступившего под действием глюкагона, больному вводят глюкозу либо заставляют его что-нибудь съесть, чтобы предотвратить рецидив гипогликемии.
Глюкагон назначают перед рентгеноконтрастными исследованиями верхних и нижних отделов ЖКТ, перед ретроградной идеографией (Monsein et al., 1986) и перед MPT (Goldberg and Thoeni, 1989) для того, чтобы расслабить гладкие мышцы желудка и кишечника. Его используют также для снятия спазма при остром дивертикулите, патологии желчных путей и сфинктера Одди, как вспомогательное средство при удалении желчных камней с помощью петли Дормиа, а также при обструкции пищевода и инвагинации кишечника (Friedland, 1983; Mortens-sonetal., 1984; Kadir and Gadacz, 1987). Введение глюкагона облегчает дифференциальную диагностику механической и паренхиматозной желтухи (Berstock et al., 1982).
Глюкагон стимулирует выброс катехоламинов клетками феохромоцитомы и используется как экспериментальное диагностическое средство при этой опухоли. Кроме того, глюкагоном пытались лечить шок, используя его инотропное действие на сердце. Препарат оказался полезным для тех больных, которые принимали β-адреноблокаторы, потому что β-адреностимуляторы у них неэффективны.
функции, синтез, действие — SportWiki энциклопедия
Историческая справка[править | править код]
Еще до открытия инсулина в островках поджелудочной железы были обнаружены разные группы клеток. Сам глюкагон был открыт Мерлином и Кимбаллом в 1923 г., менее чем через 2 года после инсулина. Однако если открытие инсулина вызвало ажиотаж, то глюкагоном мало кто заинтересовался. Только по прошествии более 40 лет стало ясно, какую важную физиологическую роль играет этот гормон в регуляции обмена глюкозы и кетоновых тел, но его роль как лекарственного средства и на сегодняшний день невелика. Глюкагон используют лишь для быстрого купирования гипогликемии, а также в лучевой диагностике в качестве препарата, подавляющего моторику кишечника.
Химические свойства[править | править код]
Глюкагон представляет собой одноцепочечный полипептид, состоящий из 29 аминокислотных остатков (рис. 61.6). Между глюкагоном и другими полипептидными гормонами, в том числе секретином, ВИП и гастроингибирующим пептидом, имеется значительная гомология.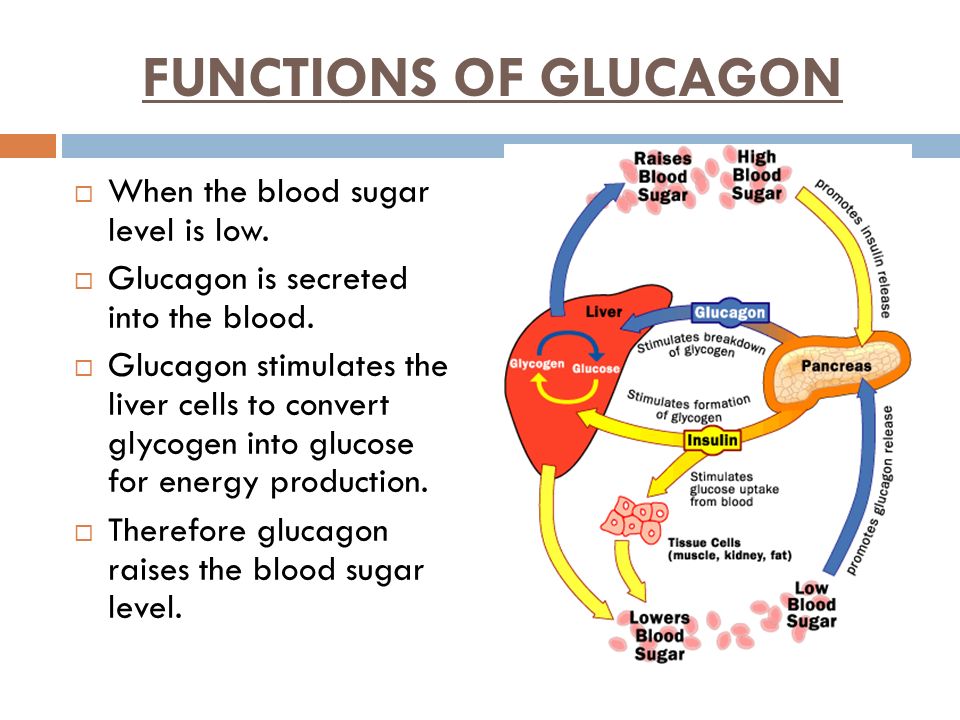 Аминокислотная последовательность глюкагона у млекопитающих высококонсервативна; она одинакова у человека, коровы, свиньи и крысы.
Аминокислотная последовательность глюкагона у млекопитающих высококонсервативна; она одинакова у человека, коровы, свиньи и крысы.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислот и пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды (Mojsov et al., 1986). Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Регуляция секреции[править | править код]
Секреция глюкагона регулируется глюкозой, поступающей с пищей, инсулином, аминокислотами и жирными кислотами. Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Большинство аминокислот стимулируют секрецию и глюкагона, и инсулина. Это объясняет, почему после приема чисто белковой пищи у человека не возникает опосредованная инсулином гипогликемия. Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина. У здоровых людей в ответ на гипогликемию секреция глюкагона увеличивается, а при инсулинозависимом сахарном диабете этот важный защитный механизм утрачивается еще в самом начале болезни.
Метаболизм[править | править код]
Глюкагон быстро разрушается в печени, почках и плазме, а также в тканях-мишенях (Peterson etal., 1982). EroT1/2 в плазме составляет всего 3—6 мин. Отщепление протеазами N-концевого остатка гистидина приводит к потере глюкагоном биологической активности.
Механизм действия[править | править код]
Глюкагон связывается с рецептором на мембране клеток-мишеней; этот рецептор представляет собой гликопротеид с молекулярной массой 60 ООО (Sheetz and Tager, 1988). Структура рецептора полностью не расшифрована, однако известно, что он сопряжен с Gj-белком, который активирует аденилатциклазу (гл. 2). Главный эффект глюкагона на гепатоциты опосредуется цАМФ. Модификация N-концевого участка молекулы глюкагона превращает его в частичный агонист: сродство к рецептору в той или иной степени сохраняется, а способность активировать аденилатциклазу в значительной степени утрачивается (Unson et al., 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
Посредством цАМФ-зависимого фосфорилирования глюкагон активирует фосфорилазу — фермент, который катализирует лимитирующую реакцию гликогенолиза. Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
цАМФ опосредует фосфорилирование еще одного бифункционального фермента — 6-фосфофрукто-2-киназы/фрукто-зо-2,6-дифосфатазы (Pilkis et al., 1981; Foster, 1984). От этого фермента зависит внутриклеточная концентрация фруктозо-2,6-дифосфата, который, в свою очередь, регулирует глюконеогенез и гликогенолиз. Когда концентрация глюкагона высока, а инсулина низка, 6-фосфофрукто-2-киназа/фрукго-зо-2,6-дифосфатаза фосфорилируется и работает как фосфата-за, снижая содержание фруктозо-2,6-дифосфата в печени. Когда концентрация инсулина высока, а глюкагона низка, фермент дефосфорилируется и работает как киназа, увеличивая содержание фрукгозо-2,6-дифосфата. Фруктозо-2,6-дифосфат является аллостерическим активатором фосфофруктокиназы — фермента, который катализирует лимитирующую реакцию гликолиза. Таким образом, когда концентрация глюкагона высока, гликолиз тормозится, а глюконеогенез усиливается. Это приводит к увеличению уровня малонил-КоА, ускорению окисления жирных кислот и кетогенезу. Напротив, когда высока концентрация инсулина, гликолиз усиливается, а глюконеогенез и ке-тогенез подавляются (Foster, 1984).
Глюкагон, особенно в высоких концентрациях, действует не только на печень, но и на другие ткани. В жировой ткани он активирует аденилатциклазу и усиливает липолиз, в миокарде — увеличивает силу сердечных сокращений. Глюкагон расслабляет гладкие мышцы ЖКТ; такой же эффект оказывают аналоги гормона, не активирующие аденилатциклазу. В некоторых тканях (в том числе в печени) имеется еще один тип рецепторов глюкагона; связывание гормона с ними приводит к образованию ИФ3, ДАГ и увеличению внутриклеточной концентрации кальция (Murphy et al., 1987). Роль этого рецептора глюкагона в регуляции метаболизма остается неизвестной.
Применение[править | править код]
Глюкагон используют для лечения тяжелых эпизодов гипогликемии, обычно у больных сахарным диабетом, когда невозможно организовать в/в инфузию глюкозы. Кроме того, глюкагон применяют в лучевой диагностике как средство, подавляющее моторику ЖКТ.
Глюкагон, применяемый в лечебных целях, получают из бычьей и свиной поджелудочных желез. Аминокислотные последовательности человеческого, бычьего и свиного глюкагона идентичны. При гипогликемии 1 мг глюкагона вводят в/в, в/м или п/к. В экстренных ситуациях первые два пути введения предпочтительны. Улучшение наступает в течение 10 мин, что позволяет свести к минимуму риск поражения ЦНС. Гипергликемизирующий эффект глюкагона кратковременен и может вообще не проявиться, если запасы гликогена в печени истощены. После улучшения, наступившего под действием глюкагона, больному вводят глюкозу либо заставляют его что-нибудь съесть, чтобы предотвратить рецидив гипогликемии. Самые частые побочные эффекты глюкагона — тошнота и рвота.
Глюкагон назначают перед рентгеноконтрастными исследованиями верхних и нижних отделов ЖКТ, перед ретроградной идеографией (Monsein et al., 1986) и перед MPT (Goldberg and Thoeni, 1989) для того, чтобы расслабить гладкие мышцы желудка и кишечника. Его используют также для снятия спазма при остром дивертикулите, патологии желчных путей и сфинктера Одди, как вспомогательное средство при удалении желчных камней с помощью петли Дормиа, а также при обструкции пищевода и инвагинации кишечника (Friedland, 1983; Mortens-sonetal., 1984; Kadir and Gadacz, 1987). Введение глюкагона облегчает дифференциальную диагностику механической и паренхиматозной желтухи (Berstock et al., 1982).
Глюкагон стимулирует выброс катехоламинов клетками феохромоцитомы и используется как экспериментальное диагностическое средство при этой опухоли. Кроме того, глюкагоном пытались лечить шок, используя его инотропное действие на сердце. Препарат оказался полезным для тех больных, которые принимали β-адреноблокаторы, потому что β-адреностимуляторы у них неэффективны.
функции, синтез, действие — SportWiki энциклопедия
Историческая справка[править | править код]
Еще до открытия инсулина в островках поджелудочной железы были обнаружены разные группы клеток. Сам глюкагон был открыт Мерлином и Кимбаллом в 1923 г., менее чем через 2 года после инсулина. Однако если открытие инсулина вызвало ажиотаж, то глюкагоном мало кто заинтересовался. Только по прошествии более 40 лет стало ясно, какую важную физиологическую роль играет этот гормон в регуляции обмена глюкозы и кетоновых тел, но его роль как лекарственного средства и на сегодняшний день невелика. Глюкагон используют лишь для быстрого купирования гипогликемии, а также в лучевой диагностике в качестве препарата, подавляющего моторику кишечника.
Химические свойства[править | править код]
Глюкагон представляет собой одноцепочечный полипептид, состоящий из 29 аминокислотных остатков (рис. 61.6). Между глюкагоном и другими полипептидными гормонами, в том числе секретином, ВИП и гастроингибирующим пептидом, имеется значительная гомология. Аминокислотная последовательность глюкагона у млекопитающих высококонсервативна; она одинакова у человека, коровы, свиньи и крысы.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислот и пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды (Mojsov et al., 1986). Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.
Рисунок 61.6. Аминокислотная последовательность глюкагона.Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Регуляция секреции[править | править код]
Секреция глюкагона регулируется глюкозой, поступающей с пищей, инсулином, аминокислотами и жирными кислотами. Глюкоза — мощный ингибитор секреции глюкагона. При приеме внутрь она оказывает гораздо более сильное действие на секрецию глюкагона, чем при в/в введении (как, впрочем, и на секрецию инсулина). Вероятно, эффект глюкозы опосредуется какими-то пищеварительными гормонами. Он утрачивается при нелеченном или декомпенсированном инсулинозависимом сахарном диабете, отсутствует и в культуре a-кпеток. Следовательно, действие глюкозы на а-клетки, по крайней мере отчасти, зависит от стимуляции ею секреции инсулина. Соматостатин, свободные жирные кислоты и кетоновые тела тоже тормозят секрецию глюкагона.
Большинство аминокислот стимулируют секрецию и глюкагона, и инсулина. Это объясняет, почему после приема чисто белковой пищи у человека не возникает опосредованная инсулином гипогликемия. Подобно глюкозе, аминокислоты более эффективны при приеме внутрь, чем при в/в введении. Следовательно, их эффект также может быть отчасти опосредован пищеварительными гормонами. Кроме того, секреция глюкагона находится под контролем вегетативной нервной системы. Раздражение симпатических нервных волокон, иннервирующих островки поджелудочной железы, а также введение адреностимуляторов и симпатомиметиков усиливают секрецию этого гормона. Ацетилхолин обладает аналогичным действием. Глюкагон при сахарном диабете. У больных с декомпенсированным сахарным диабетом концентрация глюкагона в плазме повышена. Благодаря своей способности усиливать глюконеогенез и гликогенолиз глюкагон усугубляет гипергликемию. Однако нарушения секреции глюкагона при сахарном диабете, по-ви-димому, носят вторичный характер и исчезают при нормализации уровня глюкозы в крови (Unger, 1985). Роль гиперглюкагонемии при сахарном диабете прояснили эксперименты с введением соматостатина (Gerich et al., 1975). Соматостатин, хотя и не нормализует полностью метаболизм глюкозы, существенно замедляет скорость развития гипергликемии и кетонемии у больных инсулинозависимым сахарным диабетом после внезапной отмены инсулина. У здоровых людей в ответ на гипогликемию секреция глюкагона увеличивается, а при инсулинозависимом сахарном диабете этот важный защитный механизм утрачивается еще в самом начале болезни.
Метаболизм[править | править код]
Глюкагон быстро разрушается в печени, почках и плазме, а также в тканях-мишенях (Peterson etal., 1982). EroT1/2 в плазме составляет всего 3—6 мин. Отщепление протеазами N-концевого остатка гистидина приводит к потере глюкагоном биологической активности.
Механизм действия[править | править код]
Глюкагон связывается с рецептором на мембране клеток-мишеней; этот рецептор представляет собой гликопротеид с молекулярной массой 60 ООО (Sheetz and Tager, 1988). Структура рецептора полностью не расшифрована, однако известно, что он сопряжен с Gj-белком, который активирует аденилатциклазу (гл. 2). Главный эффект глюкагона на гепатоциты опосредуется цАМФ. Модификация N-концевого участка молекулы глюкагона превращает его в частичный агонист: сродство к рецептору в той или иной степени сохраняется, а способность активировать аденилатциклазу в значительной степени утрачивается (Unson et al., 1989). Так ведут себя, в частности, [Фен’]-глюкагон и дез-Гис’-[Глу9]-глюкагонамид.
Посредством цАМФ-зависимого фосфорилирования глюкагон активирует фосфорилазу — фермент, который катализирует лимитирующую реакцию гликогенолиза. Одновременно происходит фосфорилирование гликогенсинтетазы, и ее активность снижается. В результате гликогенолиз усиливается, а гликогенез тормозится. цАМФ стимулирует также транскрипцию гена фосфоенолпируваткарбоксикиназы — фермента, который катализирует лимитирующую реакцию глюконеогенеза (Granner et al., 1986). В норме инсулин вызывает противоположные эффекты, и когда концентрации обоих гормонов максимальны, действие инсулина преобладает.
цАМФ опосредует фосфорилирование еще одного бифункционального фермента — 6-фосфофрукто-2-киназы/фрукто-зо-2,6-дифосфатазы (Pilkis et al., 1981; Foster, 1984). От этого фермента зависит внутриклеточная концентрация фруктозо-2,6-дифосфата, который, в свою очередь, регулирует глюконеогенез и гликогенолиз. Когда концентрация глюкагона высока, а инсулина низка, 6-фосфофрукто-2-киназа/фрукго-зо-2,6-дифосфатаза фосфорилируется и работает как фосфата-за, снижая содержание фруктозо-2,6-дифосфата в печени. Когда концентрация инсулина высока, а глюкагона низка, фермент дефосфорилируется и работает как киназа, увеличивая содержание фрукгозо-2,6-дифосфата. Фруктозо-2,6-дифосфат является аллостерическим активатором фосфофруктокиназы — фермента, который катализирует лимитирующую реакцию гликолиза. Таким образом, когда концентрация глюкагона высока, гликолиз тормозится, а глюконеогенез усиливается. Это приводит к увеличению уровня малонил-КоА, ускорению окисления жирных кислот и кетогенезу. Напротив, когда высока концентрация инсулина, гликолиз усиливается, а глюконеогенез и ке-тогенез подавляются (Foster, 1984).
Глюкагон, особенно в высоких концентрациях, действует не только на печень, но и на другие ткани. В жировой ткани он активирует аденилатциклазу и усиливает липолиз, в миокарде — увеличивает силу сердечных сокращений. Глюкагон расслабляет гладкие мышцы ЖКТ; такой же эффект оказывают аналоги гормона, не активирующие аденилатциклазу. В некоторых тканях (в том числе в печени) имеется еще один тип рецепторов глюкагона; связывание гормона с ними приводит к образованию ИФ3, ДАГ и увеличению внутриклеточной концентрации кальция (Murphy et al., 1987). Роль этого рецептора глюкагона в регуляции метаболизма остается неизвестной.
Применение[править | править код]
Глюкагон используют для лечения тяжелых эпизодов гипогликемии, обычно у больных сахарным диабетом, когда невозможно организовать в/в инфузию глюкозы. Кроме того, глюкагон применяют в лучевой диагностике как средство, подавляющее моторику ЖКТ.
Глюкагон, применяемый в лечебных целях, получают из бычьей и свиной поджелудочных желез. Аминокислотные последовательности человеческого, бычьего и свиного глюкагона идентичны. При гипогликемии 1 мг глюкагона вводят в/в, в/м или п/к. В экстренных ситуациях первые два пути введения предпочтительны. Улучшение наступает в течение 10 мин, что позволяет свести к минимуму риск поражения ЦНС. Гипергликемизирующий эффект глюкагона кратковременен и может вообще не проявиться, если запасы гликогена в печени истощены. После улучшения, наступившего под действием глюкагона, больному вводят глюкозу либо заставляют его что-нибудь съесть, чтобы предотвратить рецидив гипогликемии. Самые частые побочные эффекты глюкагона — тошнота и рвота.
Глюкагон назначают перед рентгеноконтрастными исследованиями верхних и нижних отделов ЖКТ, перед ретроградной идеографией (Monsein et al., 1986) и перед MPT (Goldberg and Thoeni, 1989) для того, чтобы расслабить гладкие мышцы желудка и кишечника. Его используют также для снятия спазма при остром дивертикулите, патологии желчных путей и сфинктера Одди, как вспомогательное средство при удалении желчных камней с помощью петли Дормиа, а также при обструкции пищевода и инвагинации кишечника (Friedland, 1983; Mortens-sonetal., 1984; Kadir and Gadacz, 1987). Введение глюкагона облегчает дифференциальную диагностику механической и паренхиматозной желтухи (Berstock et al., 1982).
Глюкагон стимулирует выброс катехоламинов клетками феохромоцитомы и используется как экспериментальное диагностическое средство при этой опухоли. Кроме того, глюкагоном пытались лечить шок, используя его инотропное действие на сердце. Препарат оказался полезным для тех больных, которые принимали β-адреноблокаторы, потому что β-адреностимуляторы у них неэффективны.
инструкция по применению гормона, описание
Содержание статьи:
Еще до того как был открыт инсулин были найдены различные группы клеток в островках поджелудочной железы.
Сам гормон глюкагон открыли Мерлин и Кимбалл в 1923 году, но этим открытием в то время мало кто заинтересовался, и только через 40 лет стало понятно, что этот гормон играет важнейшую физиологическую роль в осуществлении обмена кетоновых тел и глюкозы.
При этом его роль, как лекарственного препарата в настоящее время незначительна.
Химические свойства
Глюкагон является одноцепочным полипептидом, включающим 29 остатков аминокислот. Обнаружена значительная гомология между глюкагоном и иными гормонами полипептидной природы, такими как
- секретин,
- гасроингибирующий пептид,
- ВИП.
Последовательность аминокислот данного гормона схожа у многих млекопитающих и одинакова у свиньи, человека, крысы и коровы он является гормоном поджелудочной железы.
До сих пор не выяснена физиологическая функция и роль пептидов – предшественников глюкагона. Но есть предположение, основанное на сложной регуляции процессинга препроглюкагона, что все они имеют особенные функции.
В клетках островков поджелудочной железы есть секреторные гранулы, в которых различают центральное ядро, состоящее из глюкагона, и наружный ободок из глицентина. L-клетки, расположенные в кишечнике, содержат гранулы, состоящие только из глицентина.
Скорее всего, в этих клетках поджелудочной железы отсутствует фермент, превращающий глицентин в глюкагон.
Оксинтомодулин стимулирует аденилатциклазу за счет связывания с рецепторами глюкагона, находящимися на гепатоцитах. Активность данного пептида равна около 20% от таковой глюкагона.
Глюкагоноподобный белок первого типа очень сильно активирует выделение инсулина, но при этом практически никак не влияет на гепатоциты.
Глицентин, глюкагоноподобные пептиды и оксинтомодулин обнаруживаются в основном в кишечнике. После удаления поджелудочной железы секреция глюкагога продолжается.
Регуляция секреции
Секреция глюкагона, и его синтез действие, за которое отвечает глюкоза пищи, а также инсулин, жирные кислоты и аминокислоты. Глюкоза является мощнейшим ингибитором образования глюкагона.
Более сильное влияние на секрецию и синтез этого гормона она оказывает при приеме внутрь, чем при внутривенном пути введения, это указывает и ее инструкция по применению.
Таким же образом глюкоза действует и на выделение инсулина. Скорее всего, данный эффект связан с действием пищеварительных гормонов и утрачивается при плохо компенсированном сахарном диабете (инсулинозависимом) или отсутствии его лечения.
Нет его и в культуре а-клеток. То есть можно сделать вывод, что влияние глюкозы на а-клетки, в какой-то степени, зависит от активации ею выделения инсулина. Секрецию и уровеньглюкагона также тормозят свободные жирные кислоты, соматостатин и кетоновые тела.
Большинство аминокислот усиливает секрецию как инсулина, так и действие глюкагона. Именно поэтому после употребления пищи, состоящей только из белков, у человека не начинается гипогликемия, опосредованная инсулином и все функции поджелудочной железы продолжают нормально работать.
Как и глюкоза, больший эффект аминокислоты оказывают при пероральном приеме, чем при инъекционном введении. То есть их эффект частично связан с пищеварительными гормонами. Кроме того, выделение глюкагона контролируется вегетативной нервной системой.
Секреция и синтез этого гормона усиливается при раздражении симпатических нервных волокон, отвечающих за иннервацию островков поджелудочной железы, а также при введении симпатомиметиков и адреностимуляторов.
Метаболизм и синтез глюкагона основаны на следующих принципах:
- Глюкагон подвергается быстрому разрушению в печени, плазме и почках, а также в некоторых тканях-мишенях.
- Его период полувыведения в плазме равен всего 3-6 минутам.
- Гормон утрачивает биологическую активность при отщеплении протеазами N-концевого остатка гистидина.
Механизм действия
Глюкагон соединяется с особым рецептором, расположенным на мембране клеток-мишеней. Этот рецептор является гликопротеидом с определенной молекулярной массой.
Полностью его структуру расшифровать пока не удалось, но известно, что он связан с Gj-белком, активирующим аденилатциклазу, и влияющую на его синтез.
Основной эффект глюкагона на гепатоциты происходит через циклическую АМФ. За счет модификации N-концевого участка молекулы глюкагона происходит его превращение в частичный агонист.
При сохранении сродства к рецептору, в значительной мере утрачивается его способность активировать аденилатциклазу. Такое поведение характерно для дез-Гис -[Глу9]-глюкагонамида и [Фен]-глюкагона.
Данный фермент определяет внутриклеточную концентрацию фруктозо-2,6-дифосфата, который оказывает влияние на гликогенолиз и глюконеогенез.
Если уровень глюкагона высокий и синтез проходит быстро, то при малом количестве инсулина происходит фосфорилирование 6-фосфофрукто-2-киназа/фруктозо-2,6-дифосфатазы и она начинает работать как фосфотаза.
При этом количество фруктозо-2,6-дифосфата в печени уменьшается. При высокой концентрации инсулина и малом количестве глюкагона начинается дефосфорилирование фермента, и он функционирует как киназа, увеличивая уровень фруктозо-2,6-дифосфата.
Это соединение приводит к активации фосфофруктокиназы – это фермент, ускоряющий лимитирующую реакцию гликолиза.
Таким образом, при высокой концентрации глюкагона происходит торможение гликолиза и усиление глюконеогенеза, а при большом содержании инсулина гликолиз активируется. Кетогенез и глюконеогенез подавляются.
Применение
Глюкагон, как и его синтез, предназначается для купирования тяжелых приступов гипогликемии при невозможности провести внутривенное вливание глюкозы. Инструкция по применению гормона достаточно четко все расписывает
Это обычно возникает у больных сахарным диабетом. Также этот гормон используется при лучевой диагностике для подавления моторики пищеварительного тракта. В данном случае, применению гормона есть альтернативы.
Глюкагон, применяемый в медицине, выделяют из поджелудочной железы свиней или коров. Это связано с тем, что аминокислоты глюкагона у этих животных расположены в одинаковом порядке. При гипогликемии гормон вводят внутримышечно, внутривенно или подкожно в количестве 1 мг
В экстренных случаях лучше использовать глюкагон и два первых пути введения. Через 10 минут наступает улучшение, что позволяет минимизировать риск заболеваний ЦНС.
Гипергликемия под действием глюкагона кратковременна, а может и вообще не наступить, если запасов гликогена в печени недостаточно. После нормализации состояния больному необходимо что-нибудь съесть или сделать инъекцию глюкозы, чтобы предотвратить повторный приступ гипогликемии. Наиболее частые побочные реакции на глюкагон – рвота и тошнота.
- Данный гормон назначается перед проведением рентгеноконтрастного исследования отделов желудочно-кишечного тракта, перед МРТ и ретроградной идеографией для расслабления мускулатуры кишечника и желудка и улучшения их функции.
- Глюкагон применяется для купирования спазмов при заболеваниях желчных путей и сфинктера Одди или при остром дивертикулите.
- Как вспомогательный элемент при удалении камней из желчного пузыря с использованием петли Дормиа, а также при инвагинации кишечника и обструктивных процессах в пищеводе и улучшения их функции.
- Секреция глюкагона применяется как средство экспериментальной диагностики при феохромоцитоме, так как он активирует выброс катехоламинов клетками этой опухоли.
- Этот гормон применяется для лечения шока, так как оказывает инотропный эффект на сердце. Он эффективен у больных, принимающих бета-адреноблокаторы, потому что адреностимуляторы в таких случаях не действуют.
Глюкагон — Википедия. Что такое Глюкагон
Модель молекулы глюкагонаГлюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном.
Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон. Глюкагон был открыт в 1923 году Кимбеллом и Мерлином[1].
Первичная структура молекулы глюкагона следующая: NH2-His-Ser-Gln-Gly-Thr-Phe- Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser- Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu- Met-Asn-Thr-COOH
Механизм
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза).[источник не указан 1940 дней] Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ — глюконеогенеза. Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ. Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы. Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне. Глюкагон также активирует глюконеогенез, липолиз и кетогенез в печени.
Глюкагон практически не оказывает действия на гликоген скелетных мышц, по-видимому, из-за практически полного отсутствия в них глюкагоновых рецепторов. Глюкагон вызывает увеличение секреции инсулина из здоровых β-клеток поджелудочной железы и торможение активности инсулиназы. Это является, по-видимому, одним из физиологических механизмов противодействия вызываемой глюкагоном гипергликемии.
Глюкагон оказывает сильное инотропное и хронотропное действие на миокард вследствие увеличения образования цАМФ (то есть оказывает действие, подобное действию агонистов β-адренорецепторов, но без вовлечения β-адренергических систем в реализацию этого эффекта). Результатом является повышение артериального давления, увеличение частоты и силы сердечных сокращений.
В высоких концентрациях глюкагон вызывает сильное спазмолитическое действие, расслабление гладкой мускулатуры внутренних органов, в особенности кишечника, не опосредованное аденилатциклазой.
Глюкагон участвует в реализации реакций типа «бей или беги», повышая доступность энергетических субстратов (в частности, глюкозы, свободных жирных кислот, кетокислот) для скелетных мышц и усиливая кровоснабжение скелетных мышц за счёт усиления работы сердца. Кроме того, глюкагон повышает секрецию катехоламинов мозговым веществом надпочечников и повышает чувствительность тканей к катехоламинам, что также благоприятствует реализации реакций типа «бей или беги».
Примечания
— поджелудочной железы — Биохимия
Гормонами поджелудочной железы являются инсулин и глюкагон.
Глюкагон
Строение
Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез
Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
Регуляция синтеза и секреции
Активируют: гипогликемия, адреналин.
Уменьшают: глюкоза, жирные кислоты.
Механизм действия
Аденилатциклазный активирующий.
Мишени и эффекты
Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови.
Жировая ткань
- повышает активность внутриклеточной гормон-чувствительной ТАГ-липазы и, соответственно, стимулирует липолиз.
Печень
Патология
Гиперфункция
Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Инсулин
Строение
Представляет собой полипептид из 51 аминокислоты, массой 5,7 кД, состоящий из двух цепей А и В, связанных между собой дисульфидными мостиками.
Синтез
Синтезируется в клетках поджелудочной железы в виде проинсулина, в этом виде он упаковывается в секреторные гранулы и уже здесь образуется инсулин и С-пептид.
Регуляция синтеза и секреции
Активируют синтез и секрецию:
- глюкоза крови – главный регулятор, пороговая концентрация для секреции инсулина – 5,5 ммоль/л,
- жирные кислоты и аминокислоты,
- влияния n.vagus – находится под контролем гипоталамуса, активность которого определяется концентрацией глюкозы крови,
- гормоны ЖКТ: холецистокинин, секретин, гастрин, энтероглюкагон, желудочный ингибирующий полипептид,
- хроническое воздействие гормона роста, глюкокортикоидов, эстрогенов, прогестинов.
Уменьшают: влияние симпато-адреналовой системы.
Механизм действия
Осуществляется через рецепторы с тирозинкиназной активностью (подробно).
Мишени и эффекты
Основным эффектом является снижение концентрации глюкозы в крови благодаря усилению транспорта глюкозы внутрь миоцитов и адипоцитов и активации внутриклеточных реакций утилизации глюкозы:
- активируя фосфодиэстеразу, которая разрушает вторичный мессенджер цАМФ, инсулин прерывает эффекты адреналина и глюкагона на печень и жировую ткань.
- в мышцах и жировой ткани стимулирует транспорт глюкозы в клетки (активация Глют-4),
- в печени и мышцах ускоряет синтез гликогена (активация гликогенсинтазы).
- в печени, мышцах и адипоцитах инсулин стимулирует гликолиз, активируя фосфофруктокиназу и пируваткиназу.
- полученный в гликолизе пируват превращается в ацетил-SКоА под влиянием активированного инсулином пируватдегидрогеназного комплекса, и далее используется для синтеза жирных кислот. Превращение ацетил-SКоА в малонил-SКоА, первый субстрат синтеза жирных кислот, также стимулируется инсулином (ацетил-SКоА-карбоксилаза).
- в мышцах усиливает транспорт нейтральных аминокислот в миоциты и стимулирует трансляцию (рибосомальный синтез белков).
Ряд эффектов инсулина заключается в изменении транскрипции генов и скорости трансляции ферментов, отвечающих за обмен веществ, за рост и деление клеток.
Благодаря этому индуцируется синтез ферментов метаболизма
- углеводов в печени (глюкокиназа, пируваткиназа, глюкозо-6-фосфатдегидрогеназа),
- липидов в печени (АТФ-цитрат-лиаза, ацетил-SКоА-карбоксилаза, синтаза жирных кислот, цитозольная малатдегидрогеназа) и адипоцитах (ГАФ-дегидрогеназа, пальмитатсинтаза, липопротеинлипаза).
и происходит репрессия фосфоенолпируват-карбоксикиназы (подавление глюконеогенеза).
Инактивация инсулина
Инактивация инсулина начинается после интернализации инсулин-рецепторного комплекса и образования эндосомы, в которой и происходит деградация инсулина. Участвуют две ферментные системы:
- Глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные связи между цепями А и В, в результате чего гормон распадается.
- Инсулиназа (инсулин-протеиназа), гидролизующая инсулин до аминокислот.
Период полужизни инсулина не превышает 5-6 минут. Происходит деградация в основном в печени и почках, но и другие ткани принимают в этом участие. Также в почках инсулин может фильтроваться, захватываться эпителиоцитами проксимальных канальцев и разрушаться до аминокислот.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Инсулини глюкагон: как они работают?
Введение
Инсулин и глюкагон — гормоны, которые помогают регулировать уровень глюкозы в крови или сахара в организме. Глюкоза, которая поступает с пищей, которую вы едите, проходит через кровоток, чтобы подпитывать ваше тело.
Инсулин и глюкагон работают вместе, чтобы сбалансировать уровень сахара в крови, удерживая его в узком диапазоне, необходимом вашему организму. Эти гормоны подобны инь и янь поддержания уровня глюкозы в крови.Читайте дальше, чтобы узнать больше о том, как они работают и что может случиться, если они не работают должным образом.
Инсулин и глюкагон работают по так называемой петле отрицательной обратной связи. Во время этого процесса одно событие запускает другое, которое запускает другое, и так далее, чтобы сбалансировать уровень сахара в крови.
Как работает инсулин
Во время пищеварения продукты, содержащие углеводы, превращаются в глюкозу. Большая часть этой глюкозы попадает в ваш кровоток, вызывая повышение уровня глюкозы в крови.Это повышение уровня глюкозы в крови сигнализирует вашей поджелудочной железе вырабатывать инсулин.
Инсулин сообщает клеткам по всему телу брать глюкозу из кровотока. Когда глюкоза попадает в ваши клетки, уровень глюкозы в крови снижается. Некоторые клетки используют глюкозу в качестве энергии. Другие клетки, такие как печень и мышцы, хранят избыток глюкозы в виде вещества, называемого гликогеном. Ваше тело использует гликоген в качестве топлива между приемами пищи.
Подробнее: Простые и сложные углеводы »
Как работает глюкагон
Глюкагон уравновешивает действие инсулина.
Примерно через четыре-шесть часов после еды уровень глюкозы в крови снижается, заставляя поджелудочную железу вырабатывать глюкагон. Этот гормон сигнализирует вашей печени и мышечным клеткам о необходимости преобразования накопленного гликогена в глюкозу. Затем эти клетки выпускают глюкозу в кровоток, чтобы другие клетки могли использовать ее для получения энергии.
Вся эта петля обратной связи с инсулином и глюкагоном постоянно в движении. Он предотвращает слишком низкое падение уровня сахара в крови, обеспечивая стабильный запас энергии в вашем теле.
GCG — предшественник проглюкагона — Homo sapiens (человек)
GCG
Homo sapiens (человек)
Reviewed — оценка аннотации:Оценка аннотации: 5 из 5
Оценка аннотации обеспечивает эвристический критерий содержания аннотации записи или протеома UniProtKB. Эту оценку нельзя использовать в качестве меры точности аннотации, поскольку мы не можем определить «правильную аннотацию» для любого данного белка.
-Экспериментальные данные на уровне белка иЭто указывает на тип доказательств, подтверждающих существование белка. Обратите внимание, что свидетельство «существования белка» не дает информации о точности или правильности отображаемых последовательностей.
Выберите раздел слева для просмотра содержимого.
В этом разделе представлена любая полезная информация о белке, в основном биологическая информация.
Function i
Играет ключевую роль в метаболизме глюкозы и гомеостазе. Регулирует уровень глюкозы в крови за счет увеличения глюконеогенеза и уменьшения гликолиза. Противорегулирующий гормон инсулина повышает уровень глюкозы в плазме в ответ на инсулино-индуцированную гипогликемию.Играет важную роль в возникновении и поддержании гипергликемических состояний при диабете.Информация, подобранная вручную, которая была выведена куратором на основе его / ее научных знаний или научного содержания статьи.
Ручное утверждение выведено куратором из iGlucagon
Глюкагон
Глюкагон играет важную роль в поддержании нормальной концентрации глюкозы в крови и часто описывается как имеющий противоположный эффект инсулина.То есть глюкагон увеличивает уровень глюкозы в крови.
Глюкагон — линейный пептид из 29 аминокислот. Его первичная последовательность почти полностью сохраняется у позвоночных и структурно родственна семейству секретинов пептидных гормонов. Глюкагон синтезируется как проглюкагон и протеолитически обрабатывается с образованием глюкагона в альфа-клетках островков поджелудочной железы. Проглюкагон также экспрессируется в кишечном тракте, где он перерабатывается не в глюкагон, а в семейство глюкагоноподобных пептидов (энтероглюкагон).
Физиологические эффекты глюкагона
Основным действием глюкагона является стимуляция повышения концентрации глюкозы в крови. Как обсуждалось ранее, мозг, в частности, полностью зависит от глюкозы в качестве топлива, поскольку нейроны не могут в значительной степени использовать альтернативные источники энергии, такие как жирные кислоты. Когда уровень глюкозы в крови начинает опускаться ниже нормального диапазона, необходимо найти и накачать дополнительную глюкозу в кровь. Глюкагон контролирует два основных метаболических пути в печени, заставляя этот орган распределять глюкозу по всему телу:
- Глюкагон стимулирует расщепление гликогена, хранящегося в печени. Когда уровень глюкозы в крови высок, большое количество глюкозы поглощается печенью. Под влиянием инсулина большая часть этой глюкозы сохраняется в форме гликогена. Позже, когда уровень глюкозы в крови начинает падать, секретируется глюкагон, который действует на гепатоциты, активируя ферменты, которые деполимеризуют гликоген и высвобождают глюкозу.
- Глюкагон активирует глюконеогенез в печени. Глюконеогенез — это путь, по которому негексозные субстраты, такие как аминокислоты, превращаются в глюкозу.Таким образом, он является еще одним источником глюкозы для крови. Это особенно важно для животных, таких как кошки и овцы, которые не поглощают много глюкозы из кишечника, если вообще не усваивают ее — у этих видов активация глюконеогенных ферментов является главным механизмом, с помощью которого глюкагон выполняет свою работу.
Глюкагон, по-видимому, также оказывает незначительное влияние на усиление липолиза триглицеридов в жировой ткани, что можно рассматривать как дополнительное средство сохранения глюкозы в крови путем обеспечения топливом жирных кислот для большинства клеток.
Контроль секреции глюкагона
Зная, что основной эффект глюкагона заключается в повышении уровня глюкозы в крови, логично предположить, что глюкагон секретируется в ответ на гипогликемию или низкие концентрации глюкозы в крови.
Известно два других состояния, вызывающих секрецию глюкагона:
- Повышенный уровень аминокислот в крови, который можно было бы увидеть после употребления богатой белком еды: в этой ситуации глюкагон будет способствовать превращению избыточных аминокислот в глюкозу за счет усиления глюконеогенеза.Поскольку высокий уровень аминокислот в крови также стимулирует высвобождение инсулина, это может быть ситуация, в которой активны и инсулин, и глюкагон.
- Упражнение: в этом случае неясно, является ли фактический стимул упражнением как таковым или сопровождающим его истощением, вызванным упражнениями.
Что касается отрицательного контроля, секреция глюкагона подавляется высоким уровнем глюкозы в крови. Неясно, отражает ли это прямое влияние глюкозы на альфа-клетки или, возможно, эффект инсулина, который, как известно, подавляет высвобождение глюкагона.Другой гормон, который, как известно, ингибирует секрецию глюкагона, — это соматостатин.
Болезни
Заболевания, связанные с чрезмерно высокой или низкой секрецией глюкагона, встречаются редко. Известно, что рак альфа-клеток (глюкагономы) вызывает чрезмерную секрецию глюкагона. Эти опухоли обычно вызывают синдром истощения и, что интересно, сыпь и другие поражения кожи.
Несмотря на то, что дефицит инсулина, несомненно, является основным дефектом сахарного диабета 1 типа, имеются убедительные доказательства того, что аберрантная секреция глюкагона вносит свой вклад в метаболические нарушения, наблюдаемые при этом важном заболевании.Например, у многих пациентов с диабетом и гипергликемией также наблюдается повышенная концентрация глюкагона в крови, но секреция глюкагона обычно подавляется повышенным уровнем глюкозы в крови.
