Анксиолитическое действие что это значит: Анксиолитическое средство (транквилизатор) — список препаратов фармако-терапевтической группы (ФТГ) в справочнике лекарственных средств Видаль
| Алзолам | Таб. 250 мкг: 100 шт. рег. №: П N012954/01 от 13.08.08Таб. 500 мкг: 100 шт. рег. №: П N012954/01 от 13.08.08 | |||
| Алпразолам | Таб. | |||
| Алпразолам | Таб. 250 мкг: 50 шт. рег. №: ЛС-002581 от 29.07.11 | |||
| Атаракс® | Таб. | |||
| Афобазол® | Таб. 5 мг: 20, 30, 40, 50, 60, 80, 100 или 120 шт. рег. №: ЛС-000861 от 23.07.10 Дата перерегистрации: 28.06.16Таб. 10 мг: 20, 30, 40, 50, 60, 80, 100 или 120 шт. | |||
| Афобазол® Ретард | Таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой | |||
| Бензозепам® | Таб. Таб. 1 мг: 10, 20, 30, 40 или 50 шт. рег. №: ЛП-006276 от 19.06.20 Дата перерегистрации: 06.04.21Таб. 2.5 мг: 10, 20, 30, 40 или 50 шт. рег. №: ЛП-006276 от 19.06.20 Дата перерегистрации: 06.04.21 | |||
| Гидроксизин |  №: ЛП-005924
от 20.11.19 №: ЛП-005924
от 20.11.19 | |||
| Гидроксизин Канон | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-002566 от 06.08.14 | |||
| Гидроксизин-Вертекс | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-006067
от 27.01.20 №: ЛП-006067
от 27.01.20 | |||
| Гидроксизин-Натив | Таблетки, покрытые пленочной оболочкой рег. №: ЛП-004389 от 01.08.17 | |||
| Грандаксин® | Таблетки рег. №: П N013243/01
от 16.09.11
Дата перерегистрации: 29.03.19 №: П N013243/01
от 16.09.11
Дата перерегистрации: 29.03.19 | |||
| Диамидазепам® | Таб. 20 мг: 30 шт. рег. №: ЛП-001585 от 15.03.12 Дата перерегистрации: 11.12.17 | |||
| Диамидазепам® | Таб. | |||
| Золомакс | Таб. 1 мг: 30 шт. рег. №: ЛСР-001893/10 от 12.03.10 | |||
| Золомакс | Таб. | |||
| Лоразепам | Таб., покрытые пленочной оболочкой, 1 мг: 30 шт. рег. №: ЛП-005477 от 18.04.19 | |||
| Лоразепам | Таб. | |||
| Лорафен | Таб., покрытые оболочкой, 1 мг: 25 шт. рег. №: П N016057/01 от 16.10.09 Дата перерегистрации: 12.08.10 | |||
| Лорафен | Таб. | |||
| Мебикар® | Таб. 500 мг: 10 или 20 шт. рег. №: ЛП-003397 от 29.12.15 | |||
| Мебикс | Таблетки рег. №: Р N001162/02
от 31.10.08 №: Р N001162/02
от 31.10.08 | |||
| Мезапам | Таб. 10 мг: 50 шт. рег. №: ЛС-002377 от 25.07.11 | |||
| Нейрофазол | Концентрат для приготовления раствора для инфузий рег. №: ЛСР-002102/10
от 16.03.10 №: ЛСР-002102/10
от 16.03.10 | |||
| Нозепам | Таб. 10 мг: 50 шт. рег. №: Р N000658/01 от 18.03.08 | |||
| Реланиум® | Раствор для в/в и в/м введения рег. №: П N015758/01
от 29.05.09 №: П N015758/01
от 29.05.09 | |||
| Релиум | Р-р д/в/в и в/м введения 10 мг/2 мл: амп. 5, 10 или 50 шт. рег. №: П N015047/01 от 13.08.08 Дата перерегистрации: 21.02.17 | |||
| Релиум | Таб. | |||
| Селанк® | Капли назальные рег. №: ЛСР-003338/09 от 30.04.09 Дата перерегистрации: 16.07.18 | |||
| Сибазон | Р-р д/в/в и в/м введения 0. | |||
| Сибазон | Р-р д/в/в и в/м введения 5 мг/1 мл: амп. 2 мл 5 или 10 шт. рег. №: Р N003867/01 от 16.05.12 | |||
| Сибазон | Р-р д/в/в и в/м введения 5 мг/мл: амп. | |||
| Сибазон | Р-р ректальный 2 мг/мл: 1.25 мл или 2.5 мл микроклизмы 5 шт. рег. №: ЛП-006671 от 23.12.20Р-р ректальный 4 мг/мл: 2.5 мл или 5 мл микроклизмы 5 шт. рег. №: ЛП-006671 от 23. 12.20 12.20 | |||
| Сибазон | Таб. 5 мг: 20 шт. рег. №: ЛС-000931 от 28.05.10 | |||
| Сибазон | Таб. | |||
| Спитомин® | Таб. 10 мг: 60 шт. рег. №: П N013159/01 от 27.12.07 Дата перерегистрации: 17.09.14 | |||
| Спитомин® | Таб. | |||
| Стрезам® | Капсулы рег. №: ЛСР-005103/08 от 01.07.08 | |||
| Тералиджен® ретард | Таб. Таб. с пролонг. высвобождением, покр. пленочной оболочкой, 40 мг: 30 шт. рег. №: ЛП-006105 от 19.02.20Таб. с пролонг. высвобождением, покр. пленочной оболочкой, 60 мг: 30 шт. рег. №: ЛП-006105 от 19.02.20 | |||
| Тофизопам | Таб. | |||
| Тофизопам Канон | Таблетки рег. №: ЛП-006107 от 20.02.20 | |||
| Транквезипам | Р-р д/в/в и в/м введения 1 мг/1 мл: амп. | |||
| Транквезипам | Таб. 1 мг: 50 шт. рег. №: Р N003747/02 от 28.09.09 Дата перерегистрации: 29.11.17 | |||
| Транквезипам | Таб. | |||
| Фезанеф | Таблетки рег. №: Р N003954/01 от 05.03.10 | |||
| Феназепам® | Р-р д/в/в и в/м введения 1 мг/1 мл: амп. | |||
| Феназепам® | Таб. 0.5 мг: 50 шт. рег. №: Р N003672/01 от 16.06.09 Дата перерегистрации: 07.05.18 | |||
| Феназепам® | Таб. | |||
| Феназепам® | Таб. 2.5 мг: 50 шт. рег. №: Р N003672/01 от 16.06.09 Дата перерегистрации: 07.05.18 | |||
| Феназепам® | Таб. Таб., диспергируемые в полости рта, 0.5 мг: 7, 10, 14, 20, 21, 28, 30, 35, 42, 50 или 70 шт. рег. №: ЛП-005121 от 19.10.18Таб., диспергируемые в полости рта, 1 мг: 7, 10, 14, 20, 21, 28, 30, 35, 42, 50 или 70 шт. рег. №: ЛП-005121 от 19.10.18 | |||
| Фензитат® | Таб. | |||
| Фенорелаксан® | Р-р д/в/в и в/м введения 1 мг/1 мл: амп. 1 мл 10 шт. рег. №: Р N003863/01 от 30.03.11 | |||
| Фенорелаксан® | Таб. Таб. 500 мкг: 50 шт. рег. №: Р N003285/01 от 28.05.09 Дата перерегистрации: 29.12.11 | |||
| Элениум | Таблетки, покрытые оболочкой рег. №: П N015067/01-2003 от 23.06.03 | |||
| Элзепам® | Р-р д/в/в и в/м введения 1 мг/1 мл: амп. 5 или 10 шт. рег. №: Р N001201/01 от 21.05.08 | |||
| Элзепам® | Таб. 0.5 мг: 10, 20 или 50 шт. рег. №: ЛП-000853 от 14.10.11Таб. 1 мг: 10, 20 или 50 шт. рег. №: ЛП-000853 от 14.10.11 | |||
| Апаурин | Р-р д/в/в и в/м введения 10 мг/2 мл: амп. 10 шт. рег. №: П N014583/01 от 02.06.08 | |||
| Апаурин | Таб., покр. оболочкой, 2 мг: 30 шт. рег. №: П N012412/01 от 23.02.11 | |||
| Апаурин | Таб., покр. оболочкой, 5 мг: 30 шт. рег. №: П N012412/01 от 23.02.11 | |||
| Гидазепам | Таблетки рег. №: 92/210/5 от 24.07.92 | |||
| Диазепам-Ратиофарм | Р-р д/инъекц. 10 мг/2 мл: амп. 5 шт. рег. №: П N011920/01-2000 от 10.05.00 | |||
| Диазепам-Ратиофарм | Таб. 10 мг: 10, 20 или 50 шт. рег. №: П N011920/02-2000 от 10.05.00 | |||
| Диазепам-Ратиофарм | Таб. 5 мг: 10, 20 или 50 шт. рег. №: П N011920/02-2000 от 10.05.00 | |||
| Диазепам-Тева | Таб. 2 мг: 30 шт. рег. №: П N013910/01-2002 от 11.04.02 | |||
| Диазепам-Тева | Таб. 5 мг: 30 шт. рег. №: П N013910/01-2002 от 11.04.02 | |||
| Ксанакс® | Таб. 250 мкг: 30 шт. рег. №: П N013211/01-2001 от 20.07.01 | |||
| Ксанакс® | Таб. 500 мкг: 30 шт. рег. №: П N013211/01-2001 от 20.07.01 | |||
| Ксанакс® Ретард | Таб. 1 мг: 30 шт. рег. №: П N013212/01-2001 от 20.07.01 | |||
| Ксанакс® Ретард | Таб. 500 мкг: 30 шт. рег. №: П N013212/01-2001 от 20.07.01 | |||
| Лексотан | Таб. 1.5 мг: 10 или 30 шт. рег. №: П N013936/01-2002 от 18.04.02 | |||
| Лексотан | Таб. 6 мг: 10 или 30 шт. рег. №: П N013936/01-2002 от 18.04.02 | |||
| Неурол | Таб. 1 мг: 30 шт. рег. №: П N016221/01 от 13.05.05 | ZENTIVA (Чешская Республика) | ||
| Неурол | Таб. 250 мкг: 30 шт. рег. №: П N016221/01 от 13.05.05 | ZENTIVA (Чешская Республика) | ||
| Оксазепам-Ферейн | Таблетки рег. №: Р N003194/01 от 19.01.04 | |||
| Релиум | Р-р д/инъекций 10 мг/2 мл: амп. 5, 10 или 50 шт. рег. №: П N015047/01-2003 от 13.08.08 | |||
| Рудотель® | Таблетки рег. №: П N012543/01 от 12.04.04 | |||
| Седуксен® | Р-р д/в/в и в/м введения 10 мг/2 мл: амп. 5 шт. рег. №: П N012431/01 от 07.08.07 Дата перерегистрации: 18.08.11 | |||
| Седуксен® | Таб. 5 мг: 20 шт. рег. №: Р N002110/01 от 27.12.07 | |||
| Сибазон-Ферейн | Таблетки рег. №: ЛС-000591 от 29.07.05 | |||
| Сигнопам | Таблетки рег. №: П N013653/01-2002 от 24.01.02 | |||
| Феназептин | Таб. 0.5 мг: 10, 20, 30, 40 или 50 шт. рег. №: ЛП-006276 от 19.06.20 Дата перерегистрации: 06.04.21 | |||
| Хелекс® | Таб. 1 мг: 30 шт. рег. №: П N013561/01 от 07.08.07 | |||
| Хелекс® | Таб. 250 мкг: 30 шт. рег. №: П N013561/01 от 07.08.07 | |||
| Хелекс® | Таб. 500 мкг: 30 шт. рег. №: П N013561/01 от 07.08.07 | |||
| Хелекс® СР | Таб. пролонгир. действия 1 мг: 20, 30, 60 или 90 шт. рег. №: ЛСР-001490/09 от 03.03.09 | |||
| Хелекс® СР | Таб. пролонгир. действия 2 мг: 20, 30, 60 или 90 шт. рег. №: ЛСР-001490/09 от 03.03.09 | |||
| Хелекс® СР | Таб. пролонгир. действия 500 мкг: 20, 30, 60 или 90 шт. рег. №: ЛСР-001490/09 от 03.03.09 | |||
| Эстазолам | Таблетки рег. №: П N012694/01-2001 от 15.02.01 | |||
Грандаксин® — «дневной транквилизатор» для лечения расстройств ВНС¹ и тревоги
GRN 23.07.2020/1
Транквилизаторы² — один из востребованных в мире классов ЛС. От 10 до 15% всего населения мира хотя бы раз в год получают рецепты на тот или иной препарат этого класса [1] Особенно часто назначаются бензодиазепины [2]
Сегодня транквилизаторы чаще называют анксиолитиками — «растворяющими тревогу»³.
А вот в России отношение к анксиолитикам в непсихиатрической практике остаётся неоднозначным. Врачи опасаются их применения, не всегда знают правовые аспекты, но жизнь диктует свои правила: по данным лишь одного исследования СТАРТ [3,4] клинически развернутые тревога* и депрессия фиксируются почти у половины «соматических» больных (47% и 41% соответственно), а субклинические проявления: синдром вегетативной дистонии (СВД) и дистресс-расстройства демонстрируют более 70% (!) пациентов.
Клиника патологической тревоги проявляется, преимущественно, соматическими симптомами: увеличением ЧСС, спазмом периферических сосудов, нарушениями дыхания, диареей, тремором, приступами потливости, обмороками, — это заметил еще З. Фрейд, который называл их «благопристойной маскировкой» для неприемлемых в «приличном обществе» психических расстройств [5], в сочетании с эмоциональной лабильностью, нарушениями сна, астенией, болевыми и нейроэндокринными нарушениями [6-10].
В МКБ-10 для ведения пациентов с психопатологией в рамках общетерапевтической практики используются коды F45.3, R45.8, G 90.8 или G 90.9 [6]
Нетипичный бензодиазепин
Химические транквилизаторы появились в середине 1950-х, cреди первых формул были бензодиазепины. Но, наряду с противотревожной результативностью, они давали мощный седативно-гипнотический эффект, исключавший их использование в амбулаторной практике у работающих/учащихся пациентов. «Бонусом» шли синдром привыкания, потенцирование действия алкоголя и пр. Лишь спустя десятилетия учёным удалось синтезировать «нетипичный бензодиазепин — тофизопам (Грандаксин®), который тут же окрестили «дневным транквилизатором».
Грандаксин® [6, 11-15] в терапевтических дозах:
*наступление терапевтического эффекта происходит в сжатые сроки.
- проявляет селективное анксиолитическое действие при отсутствии снотворного и миорелаксирующего
- оказывает выраженное вегетостабилизирующее действие
- наблюдается повышение способности к концентрации внимания и снижению выраженности эмоциональных расстройств, улучшению качества сна
- сопровождается минимальным количеством НЯ
- не вызывает привыкания и лекарственной зависимости
- ослабляет угнетающее действие алкоголя на ЦНС
Рис. 1. Как выписывать Грандаксин®? На обычном рецепте! [15]
Литература
- Бородин В. И. Побочные эффекты транквилизаторов и их роль в пограничной психиатрии // Психиатр. и психофармакол. — 2000. — № 3. — С. 72–74.
- Аведисова А. С. К вопросу о зависимости к бензодиазепинам // Психиатр. и психофармакол. — 1999. — № 1. — С. 24–25.
- Смулевич А.Б. с соавт. Четырехмерный опросник для оценки дистресса, депрессии, тревоги и соматизации (4ДДТС) при вегетативных психосоматических расстройствах пограничного уровня // Журнал неврологии и психиатрии им. С.С. Корсакова2014;114(11):67-73
- Terluin B. & ect. The Four-Dimensional Symptom Questionnaire (4DSQ): a validation study of a multidimensional self-report questionnaire to assess distress, depression, anxiety and somatization. BMC Psychiatry 2006; 6: 34
- Rickels K, Rynn MA. What is generalized anxiety disorder? J Clin Psychiatry, 2001;62 (suppl. 11):4–12.
- Е.С. Акарачкова, О.В. Котова. Применение психотропных препаратов врачом общей практики: за и против. Неврология, спецвыпуск №1, 2016.
- Смулевич А.Б., Дубницкая Э.Б., Дробижев М.Ю., Бурлаков А.В., Макух Е.А., Горбушин А.Г. Депрессии и возможности их лечения в общемедицинской практике (предварительные результаты программы ПАРУС)//Консилиум медикум.-2007.-том 2.-№2.-Психические расстройства в общей медицине.-с.23-25
- Акарачкова Е.С. К вопросу диагностики и лечения психовегетативных расстройств в общесоматической практике.// Лечащий врач №10 2010 с.60-64
- Котова О.В., Акарачкова Е.С., Вершинина С.В., Рябоконь И.В. Нарушения сна у пациентов с неврологическими заболеваниями. Журнал неврологии и психиатрии им. C.C. Корсакова.2013. Т. 113. № 12. С. 117-120
- Вегетативные расстройства: клиника, лечение, диагностика./ под ред. А.М. Вейна. — М.: 1998. — 752 с.
- Дюкова Г.М., Саксонова Е.В., Голубев В.Л. Грандаксин в неврологической практике (мультицентровое исследование). Журнал неврологии и психиатрии 2009;9:44-48
- Арушанян Э. Б.,. Байда (Мастягина) О. А, Мастягин С. С., Попов А. В. Хронобиологические особенности влияния тофизопама на вариабельность сердечного ритма у человека Экcпеpиментальная и клиничеcкая фаpмакология. 2005;68(4):36-39
- Дюкова Г.М., Грандаксин в клинической практике, Лечение нервных болезней 2005; 2(16):25-29
- Ярыгин Н. В. с соавт. Опыт применения грандаксина в коррекции предэкзаменационного стресса у студентов высших учебных заведений. Фарматека, 2005;13(108):139-142.
- Инструкция по медицинскому применению Грандаксин. ГРЛС, П N013243/01, 16.09.2011.
Глоссарий
*Тревога – эмоциональное переживание, при котором испытывается дискомфорт от неопределенности перспективы. [Старостина] Патологическая тревога непропорциональна реальной угрозе, резко снижает продуктивность и адаптационные возможности организма [69 из Старостиной]
¹ Вегетативной нервной системы
² от лат. tranquillium — «спокойствие»
³ от лат. anxius — «тревожный» и греч. lysis — «растворение»
Производные бензодиазепина
Производные бензодиазепина – анксиолитики, снимающие тревогу, по-старому называют транквилизаторами. Препараты этой группы усиливают эффекты ГАМК (гамма-амино-маслянная кислота) – главного тормозного медиатора в ЦНС. Слабо действуют на серотониновые и дофаминовые рецепторы. Эффекты обусловлены влиянием на различные отделы ЦНС: ретикулярную формацию ствола головного мозга и неспецифические ядра таламуса (седативный эффект), миндалевидные комплексы лимбической системы (анксиолитический), полисинапсы спинного мозга (миорелаксирующий) и гиппокампа (противосудорожный). Седация, вызываемая бензодиазепинами, проявляется подавлением реакции на постоянные раздражители со снижением уровня мышления и активности. Для них характерна антероградная амнезия, когда невозможно вспомнить случившееся во время действия препарата. При этом сохраняется контакт с больным. Это осложнение, кстати, может быть весьма удобным при неприятных медицинских манипуляциях, в том числе и химиотерапии. Препараты этой группы являются анестетиками и в комплексе с другими средствами могут использоваться в паллиативной онкологии именно как обезболивающие.
Наличие весьма полезных свойств вызвало избыточное использование этих препаратов, что приводит к психологической и физической зависимости. В начале 90-х в США бензодиазепины были на 18-20 месте среди самых потребляемых лекарственных средств. В России все препараты этой группы находятся под наблюдением Комитета по контролю за оборотом наркотиков, так как являются сильнодействующими средствами, вызывающими привыкание. Это не делает их недоступными, просто имеются ограничения в выписке по количеству и частоте. Абсолютно незаменимы для профилактики предварительной тошноты и рвоты.
Для купирования отсроченной рвоты может пригодиться диазепам (сибазон, седуксен, реланиум), так как он имеет инъекционную форму [12,13]. Диазепам более липофилен, чем лоразепам, поэтому эффекты последнего на ЦНС отсрочены. Скорость метаболической трансформации и элиминации слишком низка, поэтому основные эффекты продолжительны. Период полувыведения лоразепама – от 10 до 18 часов, диазепама – 48-150 часов, фенозепама – до 18 часов.
Большие периоды полувыведения могут привести к нежелательному чрезмерному угнетению ЦНС и обусловлены образованием активных форм метаболитов. Период полувыведения диазепама увеличивается с возрастом, но элиминация его из организма остается постоянной величиной [37]. С другой стороны, чем короче период полувыведения, тем тяжелее протекает синдром «отмены», свойственный транквилизаторам, так как в плазме длительное время сохраняются следовые концентрации препарата. Синдром «отмены» сильно напоминает алкогольное похмелье. Для препаратов этой группы характерна выраженная кросс-зависимость, когда абстиненцию, вызванную, например, лоразепамом, можно купировать приемом диазепама или фенозепама, и наоборот. Классическая физическая зависимость, тем не менее, развивается очень редко, только при длительном приеме очень высоких доз, для диазепама – это по 8-10 таблеток в сутки более 2-3 месяцев. Для большинства снотворных (кроме бензодиазепинов) доза, в 10 раз превышающая снотворную, может стать летальной. Для бензодиазепинов существует антидот – флумазенил [37]. Но основным недостатком бензодиазепинов является усиление депрессии ЦНС при совместном приеме с другими седативно-снотворными средствами или алкоголем.
Мещерякова Н.Г.
Премедикация — DENTALMAGAZINE.RU
А. М. Кохан
врач-анестезиолог Medical On Group (Одинцово, Международный медицинский центр)
Часто стоматологи приглашают анестезиолога помочь им принять пациента, испытывающего боязнь перед лечением. При этом они говорят, что пациенту требуется премедикация. Очевидно, что здесь путаются понятия премедикации и седации. Правильнее было бы сказать, что пациенту требуется анестезиологическое пособие, попросту участие анестезиолога в лечении.
Что же такое премедикация? Вот какое определение дает «Руководство к практическим занятиям по анестезиологии, реаниматологии и интенсивной терапии» под редакцией Н. М. Федоровского, 2002 г.:
Премедикация (от лат. pre — перед; лат. medicamentum — лекарство) — предварительная медикаментозная подготовка больного к общей анестезии и хирургическому вмешательству. Цель данной подготовки — снижение уровня тревоги пациента, снижение секреции желез, усиление действия препаратов для анестезии.
Другими словами, премедикация — подготовка к лечению, как правило, хирургическому. Понятия хирургического и терапевтического лечения в общей медицине и стоматологии сильно различаются хотя бы тем, что для терапевтического лечения врач-интернист, как правило, не использует анестезию. В стоматологии, напротив, часто терапевтическое лечение требует местной анестезии.
Что же представляет собой премедикация, из каких компонентов она состоит? В упомянутом выше «Руководстве» приводится классический набор компонентов премедикации:
«Премедикация производится комбинацией препаратов и в большинстве случаев включает в себя наркотический анальгетик, седативный и антигистаминный препарат».
Премедикация — предварительная медикаментозная подготовка больного к общей анестезии и хирургическому вмешательству
Примером этой комбинации служит знаменитая «тройчатка» из стационаров времен развитого социализма: промедол, димедрол, атропин. Не буду подробно останавливаться на недостатках и достоинствах этого набора препаратов, скажу только, что далеко не всем пациентам этот стандарт подходил, и эффект от применения «тройчатки» был иногда совершенно противоположный. На современном этапе развития медицинской науки, при особенностях отечественного законодательства об обращении медицинских препаратов, возможности врача в области применения медикаментов значительно изменились, поэтому отвлечемся от классических схем и перейдем к реалиям сегодняшнего дня.
Для начала определимся, какой эффект необходимо получить от премедикации. Общей задачей медикаментозной подготовки к вмешательству является стабильное состояние пациента, которое можно разделить на несколько компонентов, соответственно можно разделить и меры, влияющие на каждый из них.
На первое место можно уверенно поставить анксиолитическое лечение. Любой пациент испытывает различной силы стресс при обращении к врачу [2]. Прием у стоматолога чаще вызывает страх и беспокойство [3], чем у других специалистов, поэтому следует назначить пациенту анксиолитики, которые снизят интенсивность переживаний от ожидания приема. Назначать анксиолитики рекомендуется в два этапа: на ночь, накануне лечения, и за один-два часа до начала лечения, принимая во внимание длительность действия препарата.
Учитывая обширность списка учетных препаратов, возможно применение анксиолитиков на растительной основе, например следующая схема:
- Персен, одна таблетка утром и одна таблетка днем за день до лечения.
- В это же день саносон, две таблетки за два часа до сна.
- За час до лечения две таблетки саносона.
Однако если у стоматолога имеется возможность назначить пациенту бензодиазепины, предпочтение следует отдать им [3]. В основе механизма действия бензодиазепинов лежит их влияние на ГАМК-эргические рецепторы, имеющиеся в различных структурах мозга, прежде всего в лимбических (эмоциогенных) структурах. Под влиянием бензодиазепинов происходит повышение чувствительности этих рецепторов к ГАМК, которая является тормозным медиатором, что и приводит к изменению функционирования нервной системы.
В связи с этим бензодиазепины обладают следующим спектром действия:
- Анксиолитическое действие (противотревожное), обусловленное влиянием бензодиазепинов на миндалевидный комплекс лимбической системы. Это приводит к снижению эмоциональной лабильности, психического напряжения, страха, тревоги.
- Седативный эффект, обусловленный влиянием бензодиазепинов на соответствующие рецепторы, локализованные в ретикулярной формации и неспецифических ядрах таламуса. Результатом такого действия является снижение быстроты и точности реакций на внешние раздражители, возникает сонливость, снижение умственной работоспособности, поэтому назначение бензодиазепинов людям точных профессий следует проводить с осторожностью.
- Снотворное действие, не являющееся истинным, а обусловленное анксиолитическим эффектом и пропорциональное психоседативному. Ускоряет процесс засыпания, увеличивает длительность сна, который близок к физиологическому [3].
Дозировку следует подбирать индивидуально, учитывая тип нервной системы пациента, степень его тревожности, вес, рост и возраст. Назначая бензодиазепины, необходимо предупредить пациента, а лучше взять с него расписку в том, что он не будет управлять автомобилем и работать с опасными механизмами, вести важные переговоры, сдавать экзамены и т. п. все время действия препарата (примерно в течение суток).
Применение антигистаминных препаратов, которое предлагает «Руководство к практическим занятиям по анестезиологии, реаниматологии и интенсивной терапии» под редакцией Н. М. Федоровского [1], и ранее назначалось рутинно в стационарах, по современным воззрениям на механизм развития аллергических реакций не рекомендуется: профилактировать анафилактический шок они не могут [4]. Однако целесообразно их применение, учитывая побочный седативный эффект и потенцирование действия анксиолитиков практически всеми препаратами против аллергии. Поэтому не следует исключать у тревожных пациентов антигистаминные лекарства.
Следующим компонентом премедикации должны быть медикаменты, стабилизирующие соматическое состояние пациента. У здорового человека с этим отлично справится анксиолитический компонент, но у человека, скомпрометированного по тем или иным органам и системам, назначать препараты следует, опираясь на anamnesis morbi и vitae.
Премедикация производится комбинацией препаратов и в большинстве случаев включает в себя наркотический анальгетик, седативный и антигистаминный препарат
Перед лечением пациентов, страдающих серьезным хроническим заболеванием (хроническая ишемическая болезнь сердца, сердечная недостаточность различного происхождения, гипертоническая болезнь второй — четвертой стадии, состояние после инфаркта миокарда, нарушения мозгового кровообращения и т. п.), рекомендуется назначить консультацию специалиста, который даст рекомендации по премедикации и скорректирует хроническое лечение пациента перед приемом у стоматолога. Вполне возможно привлечение анестезиолога для назначения премедикации и корректировки соматического состояния пациента во время лечения (терапевтическое сопровождение вмешательства).
Здесь особо следует остановиться на пациентах, постоянно принимающих антиагреганты и антикоагулянты. Как правило, необходимость в отмене или изменении схемы актикоагулянтной или антиагрегантной терапии перед выполнением малых хирургических операций в ротовой полости отсутствует. При этом нужно ориентироваться на тяжесть состояния пациента, результат анализа крови на свертываемость и наличие сопутствующих заболеваний.
Антиагреганты
Хотя ряд стоматологов, чтобы предотвратить возможность кровотечения, и рекомендует своим пациентам прекратить прием препаратов за несколько дней до операции, исследования показывают, что отменять низкие дозы приема препарата (75—100 мг/сутки) необходимости нет. В большинстве случаев время остановки кровотечения у пациентов, которые принимали антиагреганты, и у пациентов, отменивших прием, не различалось. Кроме того, согласно данным одного из исследований, в отмене высоких доз (325 мг/сут.) перед удалением одного зуба также нет необходимости. Таким образом, необходимо избавиться от практики отменять прием антиагрегантов в низких (а в ряде случаев — и в высоких) дозах перед малыми хирургическими операциями в ротовой полости.
На самом деле отмена приема антиагрегантов сама по себе может спровоцировать более высокий риск развития осложнений (например, приступа острой сердечной недостаточности), чем риск возникновения интра- и послеоперационного кровотечения.
Антикоагулянты
Большинство авторов считает, что если показатель МНО (Международное нормализованное отношение) или INR (International normal ratio), коагуляционного теста, с помощью которого определяют время свертывания плазмы крови пациента после добавления к ней смеси тканевого тромбопластина и кальция, ниже четырех, необходимости в отмене или изменении приема антикоагулянтов нет, поскольку гемостаза можно достичь местными средствами. Однако если МНО пациента выходит за пределы терапевтического коридора, стоматолог перед выполнением операции и коррекцией лечения обязан проконсультироваться с врачом, назначившим эти препараты, с целью их отмены за несколько дней до лечения [5]. Обычно препараты, влияющие на свертываемость крови, отменяют не менее чем за 5 суток до приема у стоматолога.
Отдельно следует сказать о профилактике побочных эффектов препаратов, применяемых стоматологами в лечении пациентов. На первом месте здесь анестетики, которые содержат адреналин, второе место по частоте применения, но не по производимому эффекту занимают ретракционные нити, пропитанные адреналином, применяемые ортопедами, так как генерализованное воздействие содержащегося в них адреналина зачастую превосходит эффект общего воздействия на организм адреналина анестетиков. Здесь играет роль еще и тот факт, что стоматологи не берут в расчет генерализованного действия адреналина, содержащегося в нитях, потому что врач не вводит никаких препаратов под слизистую пациента и ему кажется, что препарат в организм не попадает. Между тем возможности слизистой полости рта всасывать вещества превышают возможности слизистой желудочно-кишечного тракта: многие таблетированные препараты рекомендуется рассасывать под языком для ускорения и усиления эффекта [6]. Большинство современных анестетиков, применяемых в стоматологии, производятся на основе артикаина. По сравнению с другими современными анестетиками этот препарат обладает меньшим общим воздействием на организм в целом. Однако следует учесть, что артикаин проявляет антагонизм в отношении воздействия на скелетную мускулатуру с антимиастеническими лекарственными средствами, такими как калимин и прозерин, особенно при применении в высоких дозах, что требует дополнительной коррекции лечения миастении у лечащего врача перед приемом у стоматолога. Кроме того, как и другие местные анестетики, он снижает артериальное давление и замедляет ритм сокращения сердечной мышцы, поэтому на возможные возражения о том, что препарат применяется местно, можно возразить, что из такой щедро кровоснабжаемой ткани, как слизистая полости рта, он достаточно хорошо всасывается в кровоток и оказывает общее воздействие на организм [6].
Отмена приема антиагрегантов может спровоцировать более высокий риск развития осложнений, чем риск возникновения интра-и послеоперационного кровотечения
То же самое происходит и с адреналином, содержащимся в карпуле с анестетиком. Кроме того, большинство стоматологов не использует копьевидный наконечник поршня карпульного шприца для потягивания назад с целью определения возможного нахождения иглы в кровеносном сосуде, потому нельзя исключить прямое введение части содержимого или даже всей карпулы в кровоток. Однако не так опасно генерализованное воздействие на организм анестетика, как подобное воздействие адреналина [7].
Часто побочные генерализованные эффекты адреналина не берутся в расчет стоматологами, однако это следует делать, поскольку он не только вызывает состояние тревожности у пациента, но и провоцирует изменение соматического состояния: вызывает повышение АД, тахикардию, сменяющуюся брадикардией, нарушения ритма (в том числе фибрилляция предсердий и желудочков), похолодание и бледность кожных покровов, рвоту, головную боль, метаболический ацидоз. Может провоцировать инфаркт миокарда, черепно-мозговое кровоизлияние (особенно у пожилых пациентов) и отек легких, что по понятным причинам может привести к фатальному исходу.
Здесь необходимо отметить, что ретракционные нити, пропитанные адреналином, применяемые одновременно для нескольких зубов, в значительно большем количестве отдают организму содержащийся в них адреналин.
Для профилактики генерализованного воздействия адреналина следует включать в премедикацию антагонисты адреналина. Ими являются блокаторы альфа- и бета-адренорецепторов [7].
Отдельно хотелось бы развеять миф о возможности снижения рвотного рефлекса противорвотными препаратами.
Стоматологи, пытающиеся решить эту проблему пациента медикаментозно, делятся на две группы: одни советуют включить в премедикацию таблетки, применяемые для лечения транспортной болезни, другие — противорвотные препараты центрального действия. И те, и другие рекомендации ошибочны, ибо не учитывают механизма развития рвоты.
Тошнота и рвота — защитный рефлекс организма — возникает по разным причинам, и, соответственно, в его проявлении задействованы различные рефлекторные цепи.
На прерывание конкретных, отличающихся друг от друга механизмов возникновения рвоты, а не всех сразу рассчитаны и конкретные препараты [7].
Для профилактики генерализованного воздействия адреналина следует включать в премедикацию антагонисты адреналина. Ими являются блокаторы альфа- и бета- адренорецепторов
Так, локомоционная рвота (транспортная болезнь) провоцируется изменением положения тела в пространстве и, соответственно, нарушением работы всей цепи аппарата равновесия человека, от органа равновесия, расположенного во внутреннем ухе, до воспринимающих его сигналы отделов мозга.
Механизм развития рвоты, запущенный раздражением слизистой желудка, отличается не только от механизма, названного выше, но и от механизма рвоты, вызванной раздражением задней стенки глотки.
Снять раздражение задней стенки глотки можно поверхностной анестезией, наносимой на слизистую глотки путем опрыскивания.
Но у пациентов, за редчайшим исключением, рвота на приеме у стоматолога, вызвана страхом перед лечением, поэтому воздействовать в данном случае надо именно на эту причину. Лучшим препаратом для предупреждения возникновения такого рвотного рефлекса является анксиолитик.
Часто для лечения повышенной саливации врачи-стоматологи применяют атропин.
Во многих случаях премедикация антихолинэстеразным препаратом оправданна, однако не следует забывать, что антихолинэстеразные препараты провоцируют тахикардию, возникновение которой может быть опасно для пациентов, скомпрометированных со стороны сердечно-сосудистой системы. При назначении атропина следует проявлять известную осторожность и заменять его менее агрессивными препаратами, например платифиллином [7].
Отдельное место в премедикации занимают анальгетики. Применяются нестероидные противовоспалительные и жаропонижающие препараты, которые вызывают ряд возможных осложнений, потому их назначение оправданно только в случае наличия у пациента болевого синдрома и только в том случае, если применение этих препаратов значительно уменьшит или снимет боль [8].
Не следует забывать и о значении такого компонента премедикации, как предварительная беседа с пациентом. Хотя вербальное воздействие не является медикаментозным, его нельзя сбрасывать со счетов. Спокойная, в дружелюбном тоне проведенная беседа, подробное объяснение пациенту этапов лечения с указанием моментов, в которые он, возможно, испытает болевые или неприятные ощущения, с указанием их длительности и интенсивности (проведение местной анестезии, пульпэкстракция и т. п.), иногда оказывает действие более эффективное, чем набор грамотно подобранных для премедикации медикаментов [9].
Итак, современная премедикация перед амбулаторным стоматологическим приемом должна включать в себя следующие компоненты и проводиться не менее чем за сутки перед лечением:
- Вербальное воздействие на пациента в виде беседы с врачом, разъясняющим дружелюбным тоном в простой и понятной форме этапы лечения и указывающим на возможные неприятные ощущения пациента во время этого лечения. Лучше всего беседовать с пациентом подробно на первичном осмотре и кратко перед каждым последующим приемом, повторяя основные пункты первичной беседы.
- Анксиолитические препараты, назначаемые минимум дважды: на ночь перед лечением и за час-два перед приемом у стоматолога.
- Антигистаминные препараты с целью потенцирования действия анксиолитических лекарственных средств, также назначаемые на ночь и за час-два непосредственно перед лечением.
- Коррекция лечения сопутствующих хронических соматических состояний, которая, разумеется, осуществляется не за сутки, а занимает период, необходимый для достижения результата.
- Прием блокаторов альфа- и бета-адренорецепторов при подозрении на наличие у пациента возможных нежелательных реакций от введения адреналина.
- Антихолинэстеразные препараты при необходимости воздействия на повышенную продукцию слюнных желез.
- Если имеется болевой синдром — анальгетики, только способные значительно снизить или купировать его.
- «Руководство к практическим занятиям по анестезиологии, реаниматологии и интенсивной терапии» под редакцией Н. М. Федоровского, 2002.
- Сандомирский М. Е. Почему люди боятся обратиться к врачу, или Медицинский стресс глазами пациента. Помоги себе сам. — Июнь 2004, № 6 (117).
- Рабинович С. А. Современные технологии местного обезболивания в стоматологии, 2000.
- Анафилактический шок: методические рекомендации для студентов, курсантов высших учебных заведений, практических врачей. Составители: Ю. В. Котловский, Т. А. Соколова, В. В. Гладков, Н. В. Попов, В. Г. Самсонюк, Д. М. Усольцев, О. С. Котловская, Д. А. Кириченко. — Красноярск: КрасГМУ, 2011.
- Нужно ли отменять антиагреганты и антикоагулянты перед малыми хирургическими операциями на ротовой полости? Dr. Al-Harkan, Dr. Al-Ayoub.
- Пути всасывания лекарств. Поступление лекарств в полость рта и желудок (резидент КазНМУ им. С. Д. Асфендиярова Гасанов А.).
- Регистр лекарственных средств России.
- Хайкин С. С. Выбор и оценка эффективности премедикации у хирургических больных: диссертация кандидата медицинских наук.
- Психопрофилактика в стоматологии. Алямовская Е. Н. Издание: Новое в стоматологии, 2002.
Анксиолитики. Оксфордское руководство по психиатрии
Анксиолитики
Препараты, являющиеся анксиолитическими в малых дозах, вызывают сонливость и сон, если применяются в больших дозах. Прописывают эти средства очень широко и нередко без достаточных оснований. Прежде чем их назначать, всегда следует выяснить источники тревоги и попытаться воздействовать на них. Важно также иметь в виду, что определенная степень тревоги может формировать у больных мотивацию к принятию мер для решения проблем, порождающих эту тревогу. Поэтому полное купирование тревоги на короткое время не всегда благоприятно для больного в дальнейшем. Анксиолитики наиболее полезны, если их применять в течение короткого времени для того, чтобы помочь больному преодолеть кризис либо справиться с конкретной проблемой. Толерантность, по-видимому, раньше или позже развивается по отношению ко всем анксиолитическим средствам. Поскольку в настоящее время наиболее широко применяемыми анксиолитиками являются бензодиазепины, они довольно подробно будут рассмотрены первыми. Другим препаратам уделено меньше внимания. Во время чтения этого раздела важно помнить, что психологические методы лечения также могут применяться для борьбы с тревогой (см.).
БЕНЗОДИАЗЕПИНЫ
Фармакология
Бензодиазепины действуют анксиолитически, седативно, а в больших дозах вызывают и снотворный эффект. Они обладают также миорелаксирующим и противосудорожным действием. Их фармакологический эффект реализуется через специфические рецепторы, расположенные в супрамолекулярном комплексе с рецепторами ГАМК. Бензодиазепины усиливают нейротрансмиссию ГАМК, опосредованно изменяя активность других нейротрансмиттерных систем, в частности норадренергической и серотонинергической.
Доступные препараты
Исследования в коммерческих лабораториях привели к созданию множества препаратов на основе бензодиазепиновой структуры, но все полученные лекарства сходны по действию. Клиницисту в его практике необходимы только два препарата: один — кратковременного, а другой — длительного действия. Кратковременно действующие соединения — сюда входят оксазепам, лоразепам, темазепам и триазолам — наиболее показаны в случаях, когда необходимо кратковременное действие. Как уже отмечалось, лекарства кратковременного действия, видимо, чаще вызывают зависимость и должны назначаться с осторожностью. Соединения длительного действия (диазепам, хлордиазепоксид, нитразепам, клобазам, хлоразепат и др.) более соответствуют тем случаям, когда необходимо продолжительное действие. Хорошей комбинацией двух препаратов является лоразепам в дозе 3–10 мг в день, разделенной на несколько приемов, и диазепам 6–30 мг в день, также в несколько приемов. Обычно применяют нитразепам в качестве снотворного, но в общем более целесообразно использовать препарат с меньшей длительностью действия, чтобы избежать остаточных явлений на следующий день. Альпразолам считается более эффективным, чем другие бензодиазепины, для снятия панических приступов, но при сравнительных испытаниях альпразолама и других бензодиазепинов в эквивалентных дозах заметного его превосходства не отмечено (см.).
Фармакокинетика
Бензодиазепины всасываются быстро. Они крепко связываются с протеинами плазмы и благодаря липофильности легко проникают в мозг. Они метаболизируются в большое число соединений, многие из которых обладают собственным терапевтическим эффектом; например, среди продуктов метаболизма диазепама имеются темазепам и оксазепам. Выделяются в основном в виде конъюгатов с мочой (Schwartz 1973 — обзор).
Нежелательные эффекты
Бензодиазепины хорошо переносятся. В случаях применения их как анксиолитиков их главное побочное действие связано с седативными свойствами больших доз, что может привести к атаксии и сонливости (особенно у пожилых) и изредка — к спутанности мышления. Легкая степень сонливости, нарушение координации движений и способности к оценке ситуаций могут затруднить управление транспортными средствами и работу с потенциально опасными механизмами, тем более что люди, испытывающие такое воздействие, не всегда осознают это (Betts et al. 1972). Поэтому при назначении бензодиазепинов, особенно длительного действия, больных необходимо предупредить об этих опасностях, а также о потенцировании такого эффекта алкоголем. Назначающий эти препараты должен помнить, что подобные явления особенно часты у пожилых, а также у пациентов с поражениями функций почек и печени. Хотя бензодиазепины при некоторых обстоятельствах уменьшают напряжение и агрессию, в определенных дозах они могут привести к высвобождению агрессивности, подавляя сдерживающие начала у больных с тенденциями к агрессивному поведению (DiMascio 1973). В этом отношении они подобны алкоголю. Об этом эффекте следует помнить, назначая их женщинам, склонным к плохому обращению с детьми.
Токсические эффекты
У бензодиазепинов мало токсических эффектов. Больные выздоравливают после больших передозировок, поскольку эти лекарства не угнетают дыхания и не снижают давления, как это свойственно барбитуратам. Не было сообщено убедительных данных об их тератогенном действии, но желательно все же не назначать эти препараты в первой трети беременности, если нет достаточно веских показаний к их применению. Церебральная атрофия была отмечена при компьютерной томографии у некоторых больных, длительно принимавших бензодиазепины, но не было доказано, что она вызвана препаратами, а не сопутствующими болезни факторами (Lader et al. 1984).
Взаимодействие с другими лекарствами
Бензодиазепины, как и другие седативные анксиолитические средства, потенцируют эффект алкоголя и других угнетающих центральную нервную систему средств.
Эффекты отмены
Ныне общепризнанно, что при длительном применении бензодиазепинов развивается физическая зависимость, частота которой определяется препаратом и дозой. Испытывают ее от 5 до 50 % больных, принимающих эти препараты более шести месяцев (Hallstrom 1985). Зависимость приводит к синдрому абстиненции, характеризующемуся тревогой, бессонницей, тошнотой и рвотой, тремором и повышенной чувствительностью к перцептивным стимулам. В тяжелых случаях сообщается об эпилептических припадках (Petursson, Lader 1984). Поскольку многие из этих симптомов схожи с симптомами тревожных расстройств, иногда трудно решить, чем они обусловлены — отменой бензодиазепинов или обострением тревожного расстройства, по поводу которого и было назначено лекарство (Rodrigo, Williams 1986).
Симптомы абстиненции обычно развиваются в течение двух или трех дней после отмены кратковременно действующих бензодиазепинов и семи дней после отмены препаратов длительного действия. Эти симптомы обычно продолжаются от трех до десяти дней. Чаще они наблюдаются при отмене препаратов с более коротким периодом полувыведения (Tyrer et al. 1981). Если бензодиазепины применялись длительно, то перед отменой лучше снижать дозы постепенно в течение нескольких недель (Committee on the Review of Medicines 1980). В таком случае явления абстиненции можно свести к минимуму или даже избежать их вообще.
ДРУГИЕ ПРЕПАРАТЫ, УПОТРЕБЛЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ТРЕВОГИ
Антагонисты бета-адренорецепторов
Эти препараты облегчают некоторые нейровегетативные симптомы тревоги, такие как тахикардия, почти наверняка благодаря периферическому эффекту (Bonn et al. 1972). Они более всего подходят для тревожных больных, основными симптомами которых являются учащенное сердцебиение или тремор, не поддающиеся лечению бензодиазепинами. Обычно используется пропранолол в дозе 40 мг три раза в день. Противопоказания: блокада сердца, систолическое кровяное давление ниже 90 мм рт. ст. или частота пульса менее 60 ударов в минуту; бронхоспазм в анамнезе; метаболический ацидоз, например при диабете и после длительного голодания, как при anorexia nervoza. Необходима большая осторожность, когда наблюдаются признаки сердечной недостаточности. Антагонисты бета-адренорецепторов у некоторых больных могут преципитировать недостаточность сердечной деятельности; их не следует назначать больным с блокадой атриовентрикулярного узла, поскольку они снижают проводимость в А-V узле и пучке Гиса. Эти средства могут вызвать тяжелый бронхоспазм, обострить синдром Рейно и перемежающуюся хромоту. При диабете они могут вызвать гипогликемию. Некоторые препараты, взаимодействуя с бета-блокаторами, могут усиливать их неблагоприятное побочное действие. Поэтому важно установить, какие другие лекарства принимаются одновременно, и определить по специальным справочникам, нет ли сведений о наличии вредных взаимодействий.
Производные фенотиазина
Их иногда назначают больным, когда требуется анксиолитическое действие. В дозах, которые не приводят к побочным эффектам, они терапевтически обычно не более эффективны, чем бензодиазепины. Несмотря на это, фенотиазины с анксиолитическим действием иногда показаны двум группам пациентов: тем, у кого в связи с длительно существующей тревогой развилась зависимость от других лекарств, и больным с агрессивными чертами личности, плохо реагирующим на растормаживающее действие других анксиолитиков.
Трициклические антидепрессанты
Эти препараты используются для лечения тревоги, сопровождающей депрессивные расстройства. Иногда седативные трициклические антидепрессанты употребляются благодаря их анксиолитическому действию на пациентов, не страдающих депрессивными расстройствами. Эти препараты также целесообразно использовать для лечения больных с хроническими тревожными состояниями, не поддавшимися лечению бензодиазепинами. Применение имипрамина для лечения панических атак описано в гл. 7 (см.).
Барбитураты и другие седативные анксиолитики
В прошлом барбитураты широко использовались в качестве анксиолитиков. Хотя барбитураты и эффективны, но обычно они вызывают зависимость, поэтому их не следует применять по данному показанию. Седативный антигистаминный препарат гидроксизин иногда употребляется для снижения тревоги, но он обладает холинолитическим побочным эффектом и не имеет явных преимуществ как анксиолитик по сравнению с бензодиазепинами. Производные пропандиола, такие как мепробамат, также не имеют преимуществ перед производными бензодиазепина и обладают более сильным седативным эффектом в дозах, необходимых для снижения тревоги.
Нежелательные эффекты соответствуют тем, которые имеются и у бензодиазепинов, и обычно проявляются при дозах, необходимых для анксиолитического действия. Барбитураты могут вызвать раздражительность, сонливость и атаксию. В больших дозах седативные анксиолитики вызывают токсические эффекты в виде угнетения дыхания и снижения кровяного давления. Это особенно опасно в случае применения барбитуратов. Взаимодействие этих препаратов с другими сходно с наблюдаемым при применении бензодиазепинов. К тому же барбитураты взаимодействуют с кумариновыми препаратами, уменьшая их антикоагулирующее действие. Они усиливают также метаболизм трициклических антидепрессантов и тетрациклина. Симптомы абстиненции сходны с возникающими при отмене бензодиазепинов, которые описывались ранее. После прекращения применения барбитуратов наиболее выраженные проявления абстиненции таковы: психическое напряжение, потливость, тремор, раздражительность, а после отмены больших доз — судорожные припадки. Потому не следует прекращать прием барбитуратов внезапно, особенно если применявшиеся дозы были большими.
РЕКОМЕНДАЦИИ К ПРИМЕНЕНИЮ
До назначения анксиолитического средства всегда следует выяснить причину тревоги. Для большинства больных внимания к их жизненным проблемам, возможности поговорить о своих переживаниях, поддержки, оказанной врачом, бывает достаточно, чтобы снизить тревогу до переносимого уровня. Если же требуется анксиолитик, он должен быть назначен на короткое время (как правило, не более чем на три недели), а затем постепенно отменен. Важно помнить, что зависимость особенно часто развивается у людей, имеющих проблемы с алкоголем. Если лекарство принималось в течение нескольких недель, пациент должен быть предупрежден, что он может испытывать напряжение после отмены препарата.
Препаратом выбора является один из бензодиазепиновых транквилизаторов. Кратковременно действующие препараты показаны, если тревога преходящая, длительно действующие — при тревоге, продолжающейся в течение всего дня. Врач должен иметь знания и опыт применения хотя бы одного препарата из каждой группы, преимущественно наиболее дешевого, а также тщательно изучить его действие Другие препараты необходимо применять для решения специфических задач, описанных ранее: блокаторы бета-адренорецепторов — при тахикардии и треморе, вызванных тревогой и не поддающихся лечению бензодиазепинами; фенотиазины — для больных, плохо реагирующих на растормаживающее действие седативных анксиолитиков (например, крайне агрессивных больных), и для больных, ставших зависимыми от них; седативные трициклические антидепрессанты в малых дозах — для больных с длительной хронической тревогой, не поддающейся лечению другими препаратами. Ингибиторы моноаминоксидазы обладают анксиолитическим действием, но их не следует применять из-за риска несовместимости с другими лекарствами и с некоторыми пищевыми продуктами (см.).
Эмоции правят миром, транквилизаторы делают его спокойнее
Пока роботы не устроят бунт машин, эмоции будут править этим миром. Это значит, что время от времени нам нужно будет уметь совладать с зашкаливающими чувствами, страхами, тревогами. Помочь успокоить нервы способны противотревожные препараты, которые за последние 200 лет прошли большой путь — от опасных и вызывающих зависимость до практически безвредных и эффективных.
Один из главных новаторов прошлого века Зигмунд Фрейд декларировал следующее: «Мы находим жизнь слишком трудной для нас; она навлекает слишком много боли, череду разочарований, неосуществимые задачи. Мы не можем обойтись без успокоительных средств».
В «Илиаде» герои Троянской войны преображаются, когда боги начинают помогать им. Что с ними происходит с точки зрения современной науки? Быть может, это так на них действуют специальные противотревожные препараты? На смену обычному тревожному воину приходит герой — энергичный, бесстрашный, неостановимо движущийся к цели.
Доподлинно известно, что успокоительные вещества использовались уже в античном мире. Известный древнегреческий врач и фармаколог Диоскорид, живший в первом веке нашей эры считал валериану средством, способным управлять мыслями, а древнеримский писатель Плиний Старший называл ее препаратом, возбуждающим мыслительный процесс. Вряд ли можно этот успех приписывать возбуждению от настойки валерианы, но Плиний создал крупнейшее энциклопедическое сочинение античности — «Естественную историю»!
За годы проб и ошибок ученые древности и Средневековья сформировали список растений, оказывающих седативное (успокаивающее) воздействие, выяснили, в каких дозах их надо использовать. И эти природные лекарства, открытые тысячи лет назад, используются по сей день как компоненты современных препаратов.
Но природные препараты могли оказывать лишь ограниченное воздействие, а терапевтам нужны были более эффективные средства. Большие перемены в сфере успокоения нервов начали происходить во второй половине XIX века. Новые средства стали побочным продуктом поиска средства для предотвращения эпилепсии. Лекарственные средства противосудорожного действия, разработанные для эпилептиков, обычно также обладали противотревожными и успокоительными свойствами.
Первыми были бромиды, которые усиливали процессы торможения в ЦНС. Академик Иван Павлов восторженно писал о них: «Человечество должно быть счастливо тем, что располагает таким драгоценным для нервной системы препаратом, как бром».
На смену бромидам в начале XX века пришли более эффективные барбитураты. Но настоящая революция пришлась на 1950-е и начало 1960-х, когда были синтезированы многие популярные до сих пор психотропные вещества.
Важное открытие произошло в 1950 году, когда был синтезирован первый нейролептик — психотропный препарат, предназначенный в основном для лечения психотических расстройств. Психиатр Фрэнк Айд первым в США начал широко применять его в качестве успокаивающего. Этот препарат был настоящим прорывом в мировой психиатрии и первым антипсихотиком.
Позже он послужил основой для синтеза других успокоительных и противотревожных препаратов, которые начали стремительно вытеснять использовавшиеся барбитураты: новые препараты отличались меньшей токсичностью и гораздо меньшим седативным эффектом. Надо знать, что передозировка барбитуратов нередко приводила к смерти. Кроме того, у новых средств обычно было меньше побочных эффектов и, в отличие от барбитуратов, они вызывали зависимость лишь при длительном применении.
Любопытно, что термин «транквилизатор», который сейчас обычно используется для анксиолитиков — средств, снимающих тревогу, страх, — появился в 1957 году (от латинского tranquillare — успокаивать). Но слово вошло в обиход раньше. В знаменитой лондонской психлечебнице «Бедламе» особо буйных пациентов привязывали к специально изготовленному креслу, которое и называлось «транквилизатор».
Новые вызов для фармакологов в 1960-е годы бросили космические полеты. Помимо колоссальных физических перегрузок, работа космонавтов была связана с высочайшим уровнем перегрузок эмоциональных, и традиционные анксиолитики, успешно решавшие задачи в общей медицине, космонавтам не подходили. Они снимали тревогу, но вызывали седативный эффект, тем самым ухудшая концентрацию внимания и скорость реакции. От фармакологов требовалось новое средство, которое сохраняло бы работоспособность космонавтов на максимальном уровне.
В условиях масштабности этой задачи советская фармакология сделала большой шаг вперед. Первый в СССР бензодиазепиновый транквилизатор бромдигидрохлорфенилбензодиазепин был создан Сергеем Борисовичем Середениным (ныне академиком двух российских академий наук) и его научной командой. Уже позже появился фабомотизол, который в начале 2000-х годов был зарегистрирован под названием «Афобазол». Молекулы препарата воздействовали на особые белки, расположенные внутри нервных клеток. За счет этого они перемещались к поврежденному стрессом участку и восстанавливали его.
Принцип действия препаратов нового поколения развенчивал старый популярный миф о том, что нервные клетки не могут восстанавливаться. «Миф не соответствует реальности», — убедительно доказывает современная фармакология.
Так, спустя годы и даже десятилетия проб и ошибок, через поиск решений для людей, нуждающихся в психиатрической помощи, военных и космонавтов, были созданы по-настоящему эффективные и, главное, относительно безвредные препараты для повышения настроения и поддержания жизненного тонуса.
На правах рекламы
Анксиолитик — обзор | ScienceDirect Topics
Бензодиазепины
Анксиолитические свойства бензодиазепинов полезны при лечении ГТР и БП. Следовательно, логическая экстраполяция заключалась в оценке их эффективности при САР. Клинические испытания проводились только для лечения постоянными дозами, хотя клинический опыт показывает, что бензодиазепины также могут использоваться по мере необходимости из-за опасений по поводу эффективности.
Алпразолам и клоназепам — наиболее изученные бензодиазепины.Было проведено два открытых испытания и одно двойное слепое исследование алпразолама при SAD. В первом открытом испытании Lydiard, Laraia, Howell и Ballenger (1988) вводили алпразолам четырем пациентам в дозах от 3 до 8 мг / день. У всех пациентов наблюдалось уменьшение симптомов от умеренного до заметного. Один из пациентов, у которого первоначально был частичный ответ на алпразолам, имел полный ответ при добавлении фенелзина. Райх и Йейтс (1988) лечили 14 пациентов в течение восьми недель алпразоламом (диапазон доз = 1–7 мг / день; средняя доза = 2.9 мг / сут). В конце исследования 14 пациентов считались респондентами согласно шкале CGI-I. Однако через неделю после отмены препарата симптомы вернулись к исходному уровню. Было неясно, связано ли это, по крайней мере частично, с симптомами отмены алпразолама. В единственном двойном слепом исследовании алпразолама (описанном в разделе MOAI) Gelernter et al. (1991) сравнивали фенелзин, алпразолам (средняя доза = 4,2 мг / день; SD = 1,3), плацебо и КПТ. Только 38% пациентов, принимавших алпразолам, считались респондентами через 12 недель.Когда пациенты были повторно оценены через два месяца после прекращения приема алпразолама, в большинстве случаев симптомы вернулись, что свидетельствует о низкой продолжительности и без того ограниченных результатов. Учитывая время, прошедшее с момента отмены препарата, маловероятно, что эти симптомы означали отмену бензодиазепина.
В отличие от алпразолама, несколько открытых испытаний клоназепама дали положительные результаты. Versiani et al. (1989) пролечили 40 пациентов с SAD в течение восьми недель. Статистически значимое снижение тяжести CGI и баллов LSAS было отмечено между исходной оценкой и оценкой после лечения.Munjack, Baltazar, Bohn, Cabe и Appleton (1990) сравнили эффекты клоназепама по сравнению с плацебо у 10 пациентов с SAD, сопоставив их по исходной тяжести. Из пациентов, получавших клоназепам, у троих было значительное улучшение, а у троих — значительное улучшение. Хотя группа клоназепама также превосходила группу без лечения по LSAS и самооценке социальной тревожности, показатели социальной инвалидности не изменились.
В других открытых исследованиях Рейтер, Поллак, Розенбаум и Коэн (1990) лечили клоназепамом 11 пациентов.Шесть были значительно улучшены, а один — значительно улучшен. Онтиверос и Фонтейн (1990) сообщили об улучшении состояния у всех пяти пациентов, получавших клоназепам (средняя доза = 3 мг / день).
Дэвидсон, Форд, Смит и Поттс (1991) провели открытое испытание с участием 26 пациентов, лечившихся в среднем в течение 11,3 месяцев (диапазон = 1–20 месяцев). В конце испытания у 42% пациентов наблюдалось значительное улучшение, у 42% — значительное улучшение, а у 15% улучшение было минимальным или не улучшилось. Впоследствии та же группа продемонстрировала эффективность клоназепама в 10-недельном плацебо-контролируемом исследовании с участием 75 пациентов (Дэвидсон, Поттс, Ричичи, Кришнан, Форд и др., 1993). В конце лечения 78% пациентов, принимавших клоназепам (диапазон = 0,5–3 мг / день; среднее значение = 2,4 мг / день), были классифицированы как ответившие на лечение по шкале CGI по сравнению с 20% пациентов, принимавших плацебо.
Сообщалось также об использовании бромазепама, бензодиазепина, продаваемого за пределами США, для лечения SAD. В первом исследовании Versiani et al. (1989) в ходе восьминедельного открытого исследования лечили бромазепамом 10 пациентов (средняя доза = 26,4 мг / день; SD = 4,9).Оценка степени тяжести по шкале CGI снизилась с 5,0 ( SD = 0,8) на исходном уровне до 1,3 ( SD = 0,5), а оценка LSAS улучшилась с исходных 69,3 ( SD | = | 20,5) до 15,8 ( SD = 9,1). ) по окончании лечения. В последующем исследовании (Versiani, Nardia, & Figueira, 1997) бромазепам (доза до 36 мг / день) превосходил плацебо в 12-недельном рандомизированном исследовании.
Клоназепам также изучался как средство повышения эффективности лечения пароксетином. Seedat и Stein (2004) рандомизировали 28 пациентов, получавших пароксетин плюс клоназепам или пароксетин плюс плацебо.Больше пациентов с клоназепамом (79%), чем пациентов, получавших плацебо (43%), были классифицированы как пациенты, ответившие на CGI, но в этой небольшой выборке эффект был пограничным статистически значимым ( p = 0,06). Максимальная доза клоназепама в этом исследовании составляла 2,0 мг / день, а не 3,0 мг, как в исследовании Davidson et al. (1993) испытание. Клоназепам заслуживает дальнейшего изучения в качестве дополнения или альтернативного лечения пациентов, которые не полностью реагируют на первоначальное испытание СИОЗС.
Таким образом, все открытые исследования показывают, что бензодиазепины полезны при лечении SAD.В двойных слепых исследованиях клоназепам и бромазепам, но не алпразолам, превосходили плацебо. Связаны ли эти различия с истинной дифференциальной эффективностью или с дизайном исследования и выборкой, требует дальнейшего изучения. Бензодиазепины также могут быть полезны по мере необходимости при беспокойстве по поводу производительности. Польза от снижения тревожности должна быть уравновешена риском седативного эффекта, влияющего на качество выполнения. Пациенты с SAD нередко имеют сопутствующие психические расстройства, такие как депрессия.Бензодиазепины не рекомендуются в качестве монотерапии для пациентов с сопутствующей большой депрессией и должны применяться с осторожностью у пациентов с расстройствами, связанными с употреблением психоактивных веществ.
Анксиолитики — определение и побочные эффекты
Изображение: «Лекарство от беспокойства» от Practical Cures. Лицензия: CC BY 2.0
.Подходы к лечению определенных тревожных расстройств
Острая тревога
У любого человека может возникнуть острый эпизод тяжелых тревожных симптомов из-за факторов жизненного стресса, продолжающегося психического заболевания, заранее запланированной операции или по другой причине.Если симптомы достаточно тяжелые, показано экстренное лечение с экстренной анксиолитической терапией . Известно, что бензодиазепины эффективны в этих чрезвычайных ситуациях, но они несут в себе собственные риски, такие как лекарственная зависимость.
Помимо бензодиазепинов, пациенты с острыми и значительными симптомами тревоги должны также получать адекватную социальную поддержку со стороны семьи, друзей и лечащих врачей . Экстренная консультация психиатра может быть показана, если пациент представляет значительную опасность для себя или других.К пациентам с хроническим тревожным расстройством, у которых наблюдается обострение симптомов, следует относиться более осторожно и, возможно, при сотрудничестве с психиатрическим отделением.
Генерализованное тревожное расстройство
В отличие от неотложного лечения симптомов острой тревоги, лечение генерализованного тревожного расстройства обычно более сложное. Когнитивно-поведенческая терапия в сочетании с фармакотерапией — лучший подход для этих пациентов.Фактически, некоторые исследования показали, что одна только когнитивно-поведенческая терапия при генерализованном тревожном расстройстве так же эффективна, как и фармакотерапия.
Пациенты с тяжелым генерализованным тревожным расстройством, у которых есть серьезные нарушения повседневной деятельности, суицидальные мысли или значительный дефицит социальных навыков, следует госпитализировать.
Фармакологических вариантов здесь много, включая антидепрессантов и снотворных . Трициклические антидепрессанты, ингибиторы обратного захвата серотонина и ингибиторы обратного захвата серотонин-норадреналина показали эффективность в лечении генерализованного тревожного расстройства.
Паническое расстройство
Основное лечение панического расстройства — это симптоматическое лечение симптомов панических атак и предотвращение будущих приступов . Селективные ингибиторы обратного захвата серотонина, бензодиазепины или когнитивно-поведенческая терапия показали отличную эффективность в качестве начального лечения панических расстройств. Кроме того, успокоение пациента и успокоение показали хорошую эффективность при лечении острой панической атаки.
Особые классы анксиолитиков
Общие анксиолитики
Селективные ингибиторы обратного захвата серотонина
Селективные ингибиторы обратного захвата серотонина являются терапией первой линии при тревожных расстройствах. Флуоксетин, пароксетин, циталопрам, эсциталопрам, сертралин и миртазапин. — все это хорошие варианты лечения симптомов тревоги.
Флуоксетин — предпочтительный препарат для лечения симптомов тревоги у пациентов с большим депрессивным расстройством. К сожалению, флуоксетин с большей вероятностью вызывает серьезные побочные эффекты и, как правило, плохо переносится леченными пациентами.
Пароксетин превосходит флуоксетин в том, что вероятность развития значительных побочных эффектов ниже. К сожалению, пароксетин является мощным ингибитором P450 2D6 и может взаимодействовать с другими лекарствами, которые метаболизируются этим путем. Период полувыведения пароксетина ограничен по сравнению с флуоксетином.
Эсциталопрам превосходит ранее упомянутые лекарства и обычно хорошо переносится. Циталопрам также обладает хорошей эффективностью и меньшим риском лекарственного взаимодействия, но связан с повышенным риском удлинения интервала QT.
Миртазапин связан со значительными побочными эффектами , такими как увеличение веса и остаточная утренняя седация.Седативный эффект миртазапина обычно проходит через несколько недель после его приема.
Сертралин — это селективный ингибитор обратного захвата серотонина нового поколения с ограниченным профилем побочных эффектов и хорошей эффективностью при лечении симптомов тревоги. К сожалению, сертралин, как известно, взаимодействует с другими лекарствами, которые метаболизируются через путь P450 3A4.
Эти антидепрессанты, когда они используются для лечения симптомов тревоги, связаны с временным ухудшением симптомов тревоги в первые несколько дней лечения.Пациенты должны быть предупреждены об этом временном осложнении использования антидепрессантов для лечения симптомов тревоги, и пациенты должны находиться под тщательным наблюдением на предмет возможности возникновения убийственных или суицидальных мыслей.
Трициклические антидепрессанты
Трициклические антидепрессанты являются терапией второй линии для лечения симптомов тревоги и должны использоваться только в том случае, если селективные ингибиторы обратного захвата серотонина не смогли справиться с симптомами. Имипрамин, амитриптилин и дезипрамин используются для лечения симптомов тревоги.
Недостатком использования трициклических антидепрессантов является тот факт, что они связаны с более высоким риском летальной токсичности при передозировке пациента.
Кломипрамин, трициклический антидепрессант, был одобрен FDA для использования при обсессивно-компульсивном расстройстве. Кломипрамин очень эффективен при лечении симптомов заболевания, особенно если селективные ингибиторы обратного захвата серотонина не помогли.
Ингибиторы обратного захвата серотонина и норэпинефрина
Опять же, этот класс антидепрессантов следует использовать только в том случае, если селективные ингибиторы обратного захвата серотонина не проявляют эффективности.Венлафаксин и дулоксетин были одобрены FDA для использования при лечении генерализованного тревожного расстройства. Паническое расстройство и социальные тревожные расстройства у взрослых можно лечить венлафаксином.
Бензодиазепины
Бензодиазепины обычно используются для оказания неотложной помощи при панических атаках или приступах тревоги. Длительное использование бензодиазепинов немного сложно для тревожных пациентов, поскольку высок риск суицидальной попытки и пациенты могут стать зависимыми.
Алпразолам используется для неотложной помощи приступов тревоги с превосходной эффективностью. Также можно использовать лоразепам, он доступен в формах для перорального, внутривенного и внутримышечного введения. Клоназепам имеет более длительный период полувыведения, следовательно, более низкий риск зависимости и может использоваться у пациентов с менее острой потребностью в облегчении симптомов.
Хлордиазепоксид и оксазепам — очень сильные ингибиторы центральной нервной системы , которые действуют, увеличивая уровни ГАМК в лимбической и ретикулярной формации.Их можно использовать для неотложной и неотложной помощи при тяжелых приступах паники, особенно если пациент представляет опасность для себя или других.
Бензодиазепины средней продолжительности действия
| длительного действия (1–3 дня) | Промежуточного действия (10–20 часов) |
|
|
Агенты, вызывающие тревогу
Недавно буспирон прошел обширные доклинические и клинические испытания в качестве дополнительного противотревожного препарата для лечения неотложных состояний панических атак или симптомов тревоги.Буспирон показал отличную эффективность в качестве дополнительной терапии и при использовании в качестве монотерапии. Единственным недостатком использования буспирона является то, что для полной эффективности ему требуется до 3 недель, что может быть нецелесообразно в экстренных случаях. Буспирон имеет более низкий риск когнитивного или психомоторного замедления по сравнению с бензодиазепинами.
| Буспироне (Буспар) | Пропанолол |
|
|
определение анксиолитика по The Free Dictionary
Более того, хотя есть некоторые исследования, в которых не сообщалось о половых различиях (23), большинство результатов действительно предполагают, что женщины могут быть более чувствительны к анксиолитическим эффектам упражнений с отягощениями по сравнению с мужчинами и, возможно, могут лучше реагировать на них. силовые тренировки высокой интенсивности.ФЕНАЗЕПАМ — это бензодиазепин с анксиолитическим, эйфорическим, противосудорожным, амнестическим, миорелаксирующим и снотворным (сонным) эффектами. Поднятый крестообразный лабиринт — это тест, используемый для проверки анксиолитических и анксиогенных эффектов фармакологических агентов. темы: препараты, используемые для лечения нервно-мышечных расстройств, антипсихотические и анксиолитические препараты, противосудорожные средства, средства, влияющие на путь ренин-ангиотензин, инсулин и препараты, используемые для лечения диабета, антигистаминные препараты и родственные противоаллергические и противоязвенные средства, ожирение и питание.Снотворные препараты длительного действия показаны пациентам с плохим сном (раннее утреннее пробуждение), что вызывает дневные эффекты, когда необходим анксиолитический эффект в течение дня или когда допустима седация на следующий день. Фактически, масляный экстракт этого коричневого прополиса оказывали стимулирующее, анксиолитическое и антидепрессивное действие в более низких дозах [18] .mexicana собирали в трех различных регионах Мексики и, кроме того, исследовали их анксиолитическую и седативную активность, а также механизм действия.Авторы пришли к выводу, что B-GOS может иметь анксиолитический эффект и снижать стресс-реактивность у здоровых субъектов. Tybetica, а также оценить их анксиолитический потенциал по сравнению с эталонными синтетическими (диазепам) и природными (апигенин) молекулами. * Низкие дозы анксиолитика могут принести пользу пациентам. Исследование, проведенное в Уорикском университете, показывает, что несколько анксиолитических (успокаивающих) препаратов или снотворных (снотворных) повышают риск смерти вдвое. Он принимал циамемазин, успокаивающее и анксиолитическое средство. антипсихотический препарат, в течение нескольких лет, а также гидроксизин, инсулин, тамсулозин и аторвастатин.В ПОИСКАХ СВЯТОГО ГРАЛЯ
Trends Pharmacol Sci. Авторская рукопись; доступно в PMC 1 ноября 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC3482271
NIHMSID: NIHMS407888
Phil Skolnick
Отдел фармакотерапии и медицинских последствий злоупотребления наркотиками, Национальный институт последствий злоупотребления наркотиками Национальные институты здравоохранения, 6001 Executive Boulevard, Suite 4123, Bethesda, MD 20892, телефон: 301 443-6173
Фил Сколник, Отдел фармакотерапии и медицинских последствий злоупотребления наркотиками, Национальный институт злоупотребления наркотиками, Национальные институты здравоохранения, 6001 Executive Boulevard, Suite 4123, Bethesda, MD 20892, телефон: 301 443-6173;
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Открытие «бензодиазепиновых рецепторов» дало толчок к открытию и разработке анксиоселективных анксиолитиков («Валиум ® без побочных эффектов»). Потенциал рынка для анксиоселективного препарата на основе рецептора GABA A привел к тому, что несколько соединений вошли в клинические испытания. В отличие от анксиоселективного профиля, показанного на доклинических моделях, такие соединения, как бретазенил, TPA023 и MRK 409, вызывали бензодиазепиноподобные побочные эффекты (седативный эффект, головокружение) в исследованиях фазы I, тогда как альпидем и оцинаплон демонстрировали многие характеристики анксиоселективного препарата. клиника.Альпидем на короткое время продавался для лечения тревожности, но был отменен из-за токсичности для печени. Обратимое повышение ферментов печени остановило развитие оцинаплона в фазе III. Клинические профили этих двух молекул демонстрируют возможность разработки анксиоселективных средств на основе рецептора GABA A . Однако, несмотря на огромный набор молекулярных инструментов, имеющихся в нашем распоряжении, мы не лучше осведомлены о рецепторах GABA A , ответственных за анксиоселективный профиль в клинике.Здесь я обсуждаю эволюцию продолжающегося 4 десятилетия поиска молекул, которые сохраняют быстрое и надежное успокаивающее действие бензодиазепинов без побочных эффектов, ограничивающих их полезность.
Анксиолитики: прошлое, настоящее и необходимость в анксиоселективных средствах
Бензодиазепины (BZ) используются для лечения тревожных расстройств более 50 лет, и это коммерческий успех хлордиазепоксида (Librium ® ) и диазепама (Valium ). ® ) к началу 1980-х годов привело к появлению более десятка аналогов.БЗ по-прежнему широко используются [1], несмотря на сдвиг в практике назначения препаратов, при этом большинство авторитетных источников [2] отдают предпочтение серотонин-специфическим ингибиторам обратного захвата (СИОЗС) в качестве терапии первой линии при генерализованном тревожном расстройстве (ГТР). Принятие терапии на основе серотонина для лечения ГТР, наиболее распространенного среди тревожных расстройств [3], связано с проблемами безопасности при долгосрочном использовании БЖ, в первую очередь с возможностью возникновения синдрома отмены и предрасположенности к злоупотреблениям. Начало облегчения симптомов при терапии на основе серотонина (например, СИОЗС и буспирон) происходит медленно; Для значимого облегчения симптомов часто требуется четыре или более недель лечения СИОЗС [4].Напротив, BZ имеют значительное преимущество в отношении скорости начала и, по крайней мере, на начальном этапе, эффективности [5,6]. Более того, пациенты, которым прописан aSSRI, могут испытывать первоначальное увеличение на симптомов тревоги, и BZ часто назначаются в течение этого «прикрывающего» периода.
Прошло пятнадцать лет между коммерциализацией хлордиазепоксида (1961) и первым сообщением, показывающим, что BZ усиливают эффекты гамма-аминомасляной кислоты (ГАМК), главного тормозного медиатора центральной нервной системы (ЦНС) млекопитающих [6].Идентификация высокоаффинных, насыщаемых и стереоселективных сайтов узнавания для BZ (первоначально названных «бензодиазепиновые рецепторы») 1 в 1977 году и демонстрация того, что анксиолитическая и противосудорожная активности ряда 1,4-BZ сильно коррелировали с потенциалом вытеснения [ 3 H] диазепама из ткани мозга [10,11] предположили, что эти сайты были фармакологически релевантными, и предоставили средства для исследования большого количества структурно не связанных соединений на предмет потенциальных BZ-подобных свойств.
CL 218 872 (триазолопиридазин), первый небензодиазепин (), описанный [12] после идентификации рецепторов BZ, был использован для демонстрации гетерогенности этих рецепторов. Возможно, наиболее поразительными были значительные региональные различия в очевидном сродстве CL 218 872, которые не проявляются с 1,4-BZ. Таким образом, CL 218 872 был наиболее эффективен в замещении [3H] BZ из мозжечка, значительно менее эффективен в гиппокампе и проявлял промежуточную эффективность в коре головного мозга.Подобно 1,4-BZ, CL 218 872 проявлял мощное антиконфликтное действие [12–14] в доклинических моделях [15], предсказывающих анксиолитическую активность. Однако, в отличие от BZ, для достижения седативного эффекта и расслабления мышц требовались гораздо более высокие дозы CL 218 872 [12–14]. Уникальный фармакологический профиль этой молекулы 2 послужил толчком для многих компаний к разработке соединений с аналогичным профилем, скрининговых библиотек, основанных на вытеснении [ 3 H] BZ из ткани мозга в качестве отправной точки.
Типичные молекулы, демонстрирующие анксиоселективные профили в доклинических моделях. Из девяти проиллюстрированных здесь соединений шесть (бретазенил, абекарнил, альпидем, оцинаплон, MRK 409, TPA023, TPA 023B) были доставлены в клинику.
Проще говоря, профиль препарата анксиоселективного агента — «Валиум ® без побочных эффектов» — убедителен. Между фармакологическими свойствами BZ существует небольшое разделение доз. Например, в условиях двойного слепого плацебо-контролируемого приема дозы БЖ, которые значительно снижают тревожность, также вызывают седативный эффект примерно у половины пациентов [5].Способность быстро и эффективно снимать тревогу без ущерба для повседневной деятельности (например, вождение, работа с механизмами), исключение возможности падений (переломы бедра особенно проблематичны у пожилых людей), снижение вероятности злоупотреблений и отсутствие синдрома отмены. все терапевтические атрибуты, которые принесут большую пользу как пациенту, так и лечащему врачу. С коммерческой точки зрения, как широкое использование бензодиазепинов (в 1980 году было подсчитано, что в США использовалось 8000 тонн бензодиазепинов).S. [17]) и истечение срока действия патентов на коммерчески успешные бензодиазепины (Valium ® и Librium ® ) послужили сильным стимулом для разработки анксиоселективных агентов. Можно утверждать, что использование терапевтических средств на основе серотонина 3 снизило значимость такого соединения. Тем не менее, убедительный профиль продукта (быстрое и надежное успокаивающее действие БЖ без побочных эффектов) и перспектива значительного экономического роста (в 2010 году оценки продаж анксиолитиков в США оценивались более чем в 11 миллиардов долларов). [18]) продолжали исследования и разработки в этой области вплоть до нынешнего тысячелетия [9, 19, 20].
Обзор рецепторов GABA
AНачиная с конца 1980-х [21, 22], были клонированы множественные кДНК, которые кодируют субъединицы рецептора GABA A . На основе гомологии последовательностей существует восемь семейств субъединиц (α, β, γ, δ, ε, θ, π, ρ), включающих 20 различных генных продуктов [7]. Подавляющее большинство рецепторов GABA A в центральной нервной системе млекопитающих представляют собой гетеропентамеры, состоящие из двух α, двух β и одной субъединицы γ в структуре γ-β-α-β-α [23], со второй трансмембранной структурой. домен каждой субъединицы, образующий поры ГАМК-зависимого хлоридного канала [24] ().Хотя исследования иммунопреципитации показывают, что около половины всех рецепторов GABA A в ЦНС взрослых состоят из субъединиц α 1 β 2 γ 2 [25], существует значительный потенциал гетерогенности рецепторов. Даже при ограничении количества гетеропентамеров рецепторами, содержащими только субъединицы α, β и γ, и введении правила однородности внутри субъединицы (например, только один тип субъединицы α разрешен в рецепторе), существует потенциал для (6α · 3β · 3γ) 54 изоформы рецептора.Тем не менее, анатомически ограниченная экспрессия субъединиц [24, 26] заметно ограничивает потенциальное количество рецепторов α n β n γ n GABA A рецепторов; Исследования иммунопреципитации предполагают присутствие возможно 10 различных α n β n γ n гетеропентамеров [25]. Многие лекарства, включая барбитураты, летучие анестетики, судорожные средства (например, пентилентетразол), нейростероиды и спирты (этанол), модулируют функцию рецептора GABA A [24].Однако субъединица α1, 2, 3 или 5 и субъединица γ необходимы для связывания 1,4-BZ с высоким сродством (и других структурно различных молекул, обсуждаемых в этом обзоре) 1 . Следовательно, рецепторы GABA A , содержащие субъединицу α 1,2,3 или 5 , были названы «диазепамочувствительными» (DS), тогда как изоформы рецепторов, несущие субъединицу α 4 или α 6 . называются «нечувствительными к диазепаму» (DI) [8].
Схематическое изображение рецептора GABA A .Этот рецептор GABA A представляет собой гетеропентамер αβγ с 3 различными субъединицами. Левая панель: вид сбоку в постсинаптической мембране. Правая панель: вид сверху. Второй трансмембранный домен (TM2) каждой субъединицы образует просвет ГАМК-зависимого хлоридного канала. Сайт связывания для BZ и других молекул, выделенных на рисунке, образован внеклеточными доменами субъединиц α и γ * 8,24 +. Этот рисунок взят из работы Бережного и др. [24].
Остаток гистидина в положении 101 субъединицы α 1 (и гомологичные остатки в субъединицах α , 2,3 и 5 ) имеет решающее значение для связывания с высоким сродством BZ и других молекул, обсуждаемых в этом обзоре; Точечная мутация этого остатка в аргинин, соответствующую аминокислоту в субъединицах α 4 и α 6 , приводит к резкому снижению сродства этих молекул [27].Последующие исследования показали, что множественные аминокислотные остатки на субъединицах α и γ могут влиять как на активность, так и на эффективность этих молекул [8]. Однако способность резко снижать сродство BZ с помощью этой мутации His → Arg была критической для второй волны усилий по разработке анксиоселективных агентов. Таким образом, применение технологии «knock-in» привело к созданию мышей [28], содержащих мутацию His → Arg в субъединице α1, 2, 3 или 5. Мыши, полученные с помощью этого подхода, имеют резкую потерю сродства к BZ только в отношении рецепторов GABA A , содержащих мутированную субъединицу.Потеря фармакологического действия (например, анксиолитического эффекта) затем свяжет рецептор GABA A , несущий эту мутированную субъединицу, с этим фармакологическим действием, обеспечивая доказательства, которые должны совпадать с исследованиями с использованием селективных подтипов соединений как в нокауте, так и в дикой природе. типа мышки.
Частичные агонисты, селективные молекулы подтипа и гибридные растворы
Коммерческий интерес к разработке анксиоселективных средств вместе с технологией, позволяющей исследовать большое количество молекул [10, 11], и достижениями в молекулярной биологии рецепторов GABA A [7,8, 28], в результате было идентифицировано более дюжины молекул () [7,8, 29] с доклиническими профилями, соответствующими анксиоселективности.Подмножество этих соединений получило дальнейшее развитие, и клинические эффекты по крайней мере восьми молекул были опубликованы в рецензируемых журналах. Четыре из этих молекул (бретазенил, абекарнил, альпидем и оцинаплон) находились в разработке до широкого использования рекомбинантных рецепторов GABA A . Эти соединения, первоначально идентифицированные радиорецепторными анализами (с использованием [ 3 H] BZ и нативных рецепторов, полученных из мозга грызунов), проявляли анксиолитическое действие на многих моделях, но были лишены BZ-подобных «побочных эффектов» (например.грамм. седация, расслабление мышц, атаксия, амнезия) или вызывали эти эффекты только в дозах, во много раз превышающих их. Напротив, разделение доз БЗ на анксиолитические и «побочные» обычно очень скромно как в доклинических моделях, так и в клинике [5, 30, 31].
Бретазенил, разработанный в Hoffman-LaRoche, на 3–4 порядка более эффективен в доклинических исследованиях анксиолиза как у грызунов, так и у приматов по сравнению с дозами, вызывающими «побочные эффекты» [32]. В дополнение к очевидному отсутствию BZ-подобных побочных эффектов, бретазенил, как сообщалось, противодействовал эффектам вызванного диазепамом двигательного нарушения (например,g., на тесте с горизонтальной проволокой) и для получения гораздо меньшего потенцирования вызванного этанолом седативного эффекта, чем диазепам [32]. В клинике бретазенил (0,5–4 мг) уменьшал симптомы ГТР в плацебо-контролируемом двойном слепом исследовании с использованием диазепама в качестве средства сравнения [32]. Небольшое исследование также продемонстрировало, что, как и BZ, бретазенил снижает частоту и тяжесть панических атак [32]. Несмотря на заметную диссоциацию фармакологического действия, описанную в доклинических исследованиях, бретазенил в анксиолитических дозах оказывал сильное седативное действие [33].У нормальных добровольцев седативный эффект был отмечен при дозах от 0,2 до 0,5 мг, большинство испытуемых находились под седативным действием до такой степени, что они не могли адекватно выполнять тесты слежения за глазами и движения [33]. Более того, при сочетании бретазенила с алкоголем было отмечено значительное снижение работоспособности, большее, чем при приеме алкоголя и диазепама [33].
Большое разделение между дозами, вызывающими анксиолитическое действие, и побочными эффектами, такими как атаксия и миорелаксация, также было зарегистрировано для β-карболина, абекарнила (), разработанного Schering AG [34].В исследованиях фазы I [35] наиболее частыми побочными эффектами были головокружение, нестабильность ворот и отсутствие концентрации. Несмотря на побочные эффекты, которые, вероятно, отражают атаксию и седативный эффект, эти нормальные добровольцы не оценили абекарнил как седативный эффект с использованием визуальной аналоговой оценочной шкалы (ВАШ). Баллы по ВАШ используются для оценки определенного параметра либо в исходном состоянии пациента, либо в ответе на лечение. Субъекта просят оценить размер (в данном случае седативный эффект), поставив отметку на линии 100 мм, где 0 мм означает отсутствие седативного эффекта, а 100 мм — сильное седативное действие.Абекарнил был продвинут на стадии испытаний эффективности, несмотря на очевидное несоответствие между доклиническим профилем и профилем нежелательных явлений в исследованиях фазы I, предполагающих наличие BZ-подобных побочных эффектов. Профиль эффективности и побочных эффектов абекарнила оценивался у более чем 450 пациентов с диагнозом ГТР в двойных слепых плацебо-контролируемых исследованиях, которые также включали активный компаратор BZ. Наиболее заметными побочными эффектами как абекарнила (диапазон доз 7,5–30 мг), так и препаратов сравнения BZ были сонливость и головокружение; Частота побочных эффектов, вызываемых абекарнилом, находилась в пределах диапазона компараторов BZ, при этом частота во всех активных группах значительно превышала плацебо.Эффективность абекарнила в снижении баллов по шкале Гамильтона для тревожности (оценки HAM-A), «золотому стандарту», используемому в клинических испытаниях для оценки тревожности, была переменной; в 4 из 5 исследований BZ приводили к быстрому (одна неделя) и стойкому отрыву от плацебо. Абекарнил показал BZ-подобный паттерн только в одном из пяти исследований; в других исследованиях абекарнил не продемонстрировал последовательного отделения от плацебо в течение четырехнедельного периода исследования [36]. Поллак и др. . [37] сравнили эффективность двух уровней доз абекарнила в двойном слепом плацебо-контролируемом исследовании.Буспирон, частичный агонист 5HT 1A , одобренный для лечения GAD, был использован в качестве средства сравнения в этом 6-недельном исследовании. Группы как с низкой (3–9 мг / день), так и с высокой (7,5–22,5 мг / день) дозой абекарнила испытали быстрое снижение баллов по шкале HAM-A, достигнув статистической значимости после одной недели приема дозы, самой ранней измеренной временной точки. Анксиолитический эффект в группе с высокой, но не с низкой дозой сохранялся в течение шестинедельного испытания. В соответствии с отсроченным началом приема других анксиолитиков на основе серотонина [4], статистически значимое разделение с плацебо не наблюдалось в когорте буспирона до шестой недели лечения.Профиль побочных эффектов абекарнила был поразительно похож на BZ, со значительным увеличением частоты возникновения сонливости (45% в группе высоких доз абекарнила по сравнению с 13% в группе плацебо), головокружения, усталости, отсутствия концентрации и атаксии по сравнению с группа плацебо. Клинический профиль абекарнила, в частности профиль побочных эффектов, так напоминающий BZ, в конечном итоге привел к решению прекратить дальнейшую разработку в середине 1990-х годов.
Оцинаплон (CL 273 547), пиразолопиримидин, был разработан на платформе химии Lederle, которая произвела CL 218 872 [12].Доклинический профиль оцинаплона () напоминает другие молекулы, описанные в этом обзоре: BZ-подобные эффекты в доклинических тестах, предсказывающие анксиолитическое действие, с побочными эффектами, проявляющимися только при гораздо более высоких дозах [30, 38]. В «испытании конфликта на крысах с жаждой» * 15], пожалуй, наиболее широко используемой методике для оценки потенциальных успокаивающих действий, оцинаплон и диазепам были равноэффективны (минимальная эффективная доза [МЭД] ~ 3,1 мг / кг) в увеличении количества ответных реакций (что То есть крысы, испытывающие жажду, увеличивают количество облизываний, взятых из носика с водой, несмотря на возможность получения неприятного шока; это увеличение не отражает обезболивание, потому что опиаты не активны в этой парадигме).Эти эффекты были чувствительны к флумазенилу (Ro 15–1788), что свидетельствует о действии, опосредованном рецептором GABA A (). Однако в тестах, разработанных [31] для оценки BZ-подобных побочных эффектов, оцинаплон оказался гораздо менее мощным, чем диазепам. Например, ED 50 для снижения двигательной активности (часто используемый в качестве заменителя седативного эффекта) составлял ~ 17,5 и 82 мг / кг для диазепама и оцинаплона, соответственно. В тестах с наклонным экраном и ходьбой со штангой, используемых для оценки расслабления мышц и атаксии соответственно, оцинаплон был в ~ 11 и ~ 7 раз менее активен, чем диазепам [30].В модели конфликта приматов оцинаплон и диазепам увеличивали количество наказываемых реакций со значениями MED 4 и 0,5 мг / кг соответственно. Однако диазепам значительно снизил реакцию без наказания (что указывает на неспецифическое снижение поведения) при дозе 4 мг / кг; у этих животных наблюдалось сильное седативное действие. Оцинаплон значительно снижал реакцию без наказания только при дозах 128 мг / кг, при этом явных признаков седативного действия не отмечалось [30].
Сравнение фармакологических свойств оцинаплона и диазепама. Взрослым самцам крыс CD (Charles River) вводили носитель, оцинаплон или диазепам через желудочный зонд.Панель A: Противоконфликтное действие оцинаплона и диазепама: блокада флумазенилом. Животных оценивали 60 мин. позже в тесте «измученный жаждой крысиного конфликта», по сути, как описано [31]). Вкратце, крыс лишали воды в течение 48 часов и лишали пищи в течение 24 часов перед тестированием. Крыс помещали в испытательную камеру и через носик из нержавеющей стали подавали 10% раствор глюкозы. После обнаружения носика крысе давали 25 секунд бесплатного питья (без шока). Затем была активирована схема, которая производила легкий электрический шок через носик в 5-секундном режиме «включено», 5-секундное «выключено» в течение 5 минут.Количество нанесенных разрядов (животное должно соприкасаться с носиком для получения разряда) записывается. Параллельные группы получали флумазенил (12,5 мг / кг, внутрибрюшинно) 30 мин. перед тестированием. Эта доза флумазенила не влияет на производительность в тесте конфликта на крысах с жаждой (данные не показаны). Минимальная эффективная доза (MED; первая доза, показывающая статистически значимое отличие от крыс, получавших носитель) оцинаплона и диазепама составляла 3,1 мг / кг. Значения представляют собой среднее (n ≥ 8 животных / доза)% увеличения ответной реакции на наказание по сравнению с крысами, получавшими носитель.Символы: открытые треугольники, оцинаплон; закрытые квадраты, диазепам; закрытые треугольники, оцинаплон + флумазенил; открытые квадраты квадраты: диазепам + флумазенил.
Панель B: Влияние оцинаплона и диазепама на двигательную активность крыс. Соединения оценивали через 60 минут после перорального введения. Значения представляют собой средний% снижения двигательной активности у 12–24 крыс на дозу по сравнению с животными, которым вводили носитель. ED 50 диазепама и оцинаплона составлял 17,5 и 81,7 мг / кг соответственно. Условные обозначения: открытые треугольники, оцинаплон; закрытые квадраты, диазепам.
Панель C: Влияние оцинаплона и диазепама на наклонный экран. Действие диазепама и оцинаплона оценивали на способность крыс оставаться на наклонном экране (60 °) в течение 30 мин. ED 50 диазепама и оцинаплона составлял 15,5 (3,5–24,9, 95% ДИ) и 172,2 (123,3–244,5, 95% ДИ) мг / кг соответственно. Обозначения как на панели B.
Панель D: Влияние оцинаплона и диазепама на ходьбу на штанге: животных обучали перемещать штангу, наклоненную под углом 17 °. Значения представляют собой среднее значение 10 крыс на дозу.ED 50 диазепама и оцинаплона составлял 13,8 (2,7–20,4, 95% ДИ) и 92 (68–124, 95% ДИ) мг / кг соответственно. Символы: как на панели B. Эти данные взяты из работы Lippa, et al. [30].
В исследованиях фазы I была принята консервативная стратегия выбора доз, основанная на эффективности оцинаплона на доклинических моделях [30]. Однако в исследованиях как однократных, так и многократных возрастающих доз оцинаплон был безопасен и хорошо переносился при однократных дозах до 90 мг и общих суточных дозах до 270 мг.При использовании этих доз побочных эффектов, подобных BZ, не отмечалось. Четырехнедельное двойное слепое плацебо-контролируемое исследование с использованием дозы 270 мг (90 мг, три раза в день) оцинаплона продемонстрировало быстрое улучшение показателей HAM-A, сохраняющееся на протяжении всего исследования [19]. Ocinaplon снизил баллы HAM-A на 12,9 балла по завершении испытания по сравнению с 5,4 баллами в группе плацебо. Для сравнения, четырехнедельные испытания анксиолитиков обычно сообщают об изменениях в баллах HAM-A на 2–3,5 балла по сравнению с плацебо [19].В соответствии с данными, полученными на здоровых добровольцах, не было доказательств наличия BZ-подобных побочных эффектов [19]. Это исследование было прекращено досрочно из-за одного случая желтухи; пациент полностью выздоровел, и было обнаружено, что у него ранее существовало состояние, которое могло способствовать этому серьезному нежелательному явлению. Второе, более короткое испытание оцинаплона у пациентов с ГТР продемонстрировало анксиолиз в дозе 180–240 мг; отделение от плацебо было очевидным уже в первую неделю лечения [30]. Анксиолитический эффект оцинаплона в этом исследовании был устойчивым: несмотря на высокий ответ на плацебо (9.Снижение HAM-A на 7 баллов за две недели), снижение баллов HAM-A было на 4,4 и 5,6 балла больше, чем в группе плацебо в группах 180 и 240 мг, соответственно. Частота и частота нежелательных явлений в этом исследовании не выявили никаких намеков на BZ-подобные побочные эффекты. Эти результаты положили начало более крупному (373 пациента), четырехнедельному исследованию, в котором сравнивали 60 и 120 мг оцинаплона с плацебо у пациентов с ГТР с целью установления MED. Это испытание было остановлено после того, как около 200 субъектов были рандомизированы, поскольку у небольшого числа пациентов наблюдались повышения показателей функции печени; у одного пациента наблюдалось заметное повышение уровня ферментов печени, которое в конечном итоге нормализовалось.Учитывая регуляторные препятствия, вызванные этими событиями, разработка оцинаплона была прекращена, несмотря на доклинические обширные токсикологические исследования, которые не дали предварительных признаков поражения печени.
Хотя количество субъектов, которым вводили дозу оцинаплона, было, возможно, слишком мало, чтобы однозначно продемонстрировать анксиоселективный профиль, одобрение альпидема для лечения ГТР демонстрирует возможность разработки эффективного, быстродействующего анксиолитика с уменьшенной частотой побочных эффектов, подобных BZ.Альпидем () является структурным аналогом золпидема, снотворного, продаваемого более двадцати лет назад. Несмотря на это структурное сходство, фармакологический профиль альпидема заметно отличается как от золпидема, так и от BZ. Альпидем был активен в нескольких доклинических исследованиях, предсказывающих анксиолитическую активность (тест конфликта на крысах с жаждой, закапывание мрамора), но неактивен в других (например, тест с четырьмя пластинами, подавление боевых действий, вызванных шоком), чувствительных к BZ [39,40]. Противоконфликтное действие альпидема подавлялось флумазенилом, что указывает на то, что эти эффекты опосредуются рецепторами GABA A .Хотя альпидем снижал исследовательскую активность у мышей в дозах в пределах анксиолитического диапазона [39, 41], дефицит производительности вращающегося стержня (обычно используется для моделирования атаксии) и мышечной силы проявлялся только при дозах,> 20 раз превышающих дозу, активную в антиконфликтных тестах [39]. ]. Более того, не было обнаружено никаких признаков амнестического воздействия [42].
На основании исследований с участием более 1500 пациентов, страдающих различными тревожными расстройствами, в 1991 г. альпидем был продан во Франции (Ananxyl ® ) для лечения ГТР.В клинических испытаниях, ведущих к регистрации, снижение баллов по шкале HAM-A, произведенное альпидемом, было значительно больше, чем плацебо. Например, в 3-недельном испытании, сравнивавшем 150 мг альпидема (50 мг три раза в день) с плацебо, разделение оценок HAM-A между двумя группами было очень значимым (6,1 балла; p <0,0001) [43]. При общей суточной дозе 75–150 мг, вводимой 2–3 раза в день (т. Е. Однократные дозы 25–75 мг), снижение показателей HAM-A было эквивалентно гибкому или фиксированному дозированию BZ, таких как лоразепам, хлоразепат и диазепам.Не было доказательств ни симптомов отмены, ни возвратной тревожности у пациентов, которые прекратили прием алпидема после периодов до одного года.
Здоровые добровольцы, как правило, очень чувствительны к побочным эффектам БЖ — головокружение, мышечная слабость, утомляемость и сонливость часто регистрируются как побочные эффекты при эффективных анксиолитических дозах или ниже, и все же они не были заметными побочными эффектами при приеме альпидема. Например, у здоровых добровольцев дозы 50–100 мг (диапазон доз анксиолитика: 75–150 мг вводятся в двух или трех дневных дозах — i.е., разовые дозы 25–75 мг) не снижали внимательность и не влияли на психомоторную работоспособность. В более высокой дозе (200 мг) альпидем действительно снижал бдительность и психомоторную работоспособность, равную 10–15 мг диазепама [44]. Тем не менее, по некоторым параметрам, в том числе по рейтингу ВАШ «ясновидение», отсутствие дозы альпидема снижало рейтинги, тогда как диазепам приводил к дозозависимому (10–15 мг) снижению этого показателя [44]. В другом исследовании дозы 25-50 мг альпидема не вызывали каких-либо значительных психомоторных нарушений, но доза 100 мг вызывала, хотя и в гораздо меньшей степени, чем стандартная доза лоразепама (2 мг) у здоровых добровольцев.У пациентов с ГТР сравнение алпидема с лоразепамом не показало влияния на память с альпидемом, тогда как лоразепам вызывал значительное снижение памяти. Более того, время реакции замедлялось лоразепамом, но не альпидемом. После резкого прекращения приема альпидема не было проявлений тревожности или абстинентного синдрома; Группа исследования, изучающая реакции отмены на резкое прекращение приема лоразепама, должна была быть прекращена по этическим причинам [45]. Примечательно, что альпидем (50 мг) значительно противодействовал амнестическим эффектам лоразепама (2 мг) и вызывал аналогичные тенденции в отношении других когнитивных параметров, что приводило к меньшим нарушениям, чем после приема одного лоразепама [46].В целом, альпидем оказался эффективным анксиолитиком, столь же эффективным, как и стандартные BZ в прямых сравнительных испытаниях, обеспечивая быстрое и надежное снижение баллов по шкале HAM-A. Некоторые психомоторные нарушения наблюдались при дозах, в 2-8 раз превышающих рекомендованную разовую дозу (25-50 мг). Таким образом, не демонстрируя большого разделения доз, предсказанного на основе доклинических испытаний, альпидем не ухудшал память при терапевтических дозах (и сообщалось, что он противодействует амнестическому действию BZ), а также при длительном лечении не вызывало реакции отмены после резкого прекращения.Эти последние свойства также наблюдались в доклинических исследованиях для многих предполагаемых анксиоселективных агентов, описанных здесь [47], но альпидем — единственное соединение, для которого эти эффекты также были задокументированы в клинике. На основании этих клинических исследований профиль побочных эффектов альпидема значительно отличается от BZ. Постмаркетинговые сообщения о нескольких случаях тяжелого гепатита привели к одной смерти и нескольким пациентам, потребовавшим трансплантации печени [48]. Альпидем был снят с продажи в 1995 году.
Несмотря на то, что все четыре молекулы демонстрируют анксиоселективные профили в лаборатории, в клинике сложилась совершенно иная картина. Общей нейрохимической нитью среди этих молекул, идентифицированной до появления рекомбинантных рецепторов GABA A , был профиль частичного агониста, выявленный в нативных рецепторах с использованием нейрохимических и электрофизиологических методов [30, 32, 34, 38, 49–51]. Поскольку препараты мозга, используемые для характеристики этих соединений как частичных агонистов, содержат несколько изоформ рецепторов, поучительно сравнить профили бретазенила (сильно седативный) и альпидема (который, по-видимому, вызывает гораздо меньшее седативное действие в анксиолитических дозах) в рекомбинантной ГАМК A рецепторы определенного состава.Бретазенил проявляет очень высокую аффинность (<1 нМ), но не обладает селективностью среди рекомбинантных рецепторов GABA A , содержащих α 1,2, 3 и 5 субъединиц . Однако он является частичным агонистом этих рецепторов GABA A с эффективностью от 20 до 44% по сравнению со стандартным BZ [52, 53]. Напротив, альпидем более чем в 500 раз более селективен в отношении рецепторов GABA A , несущих α 1 , по сравнению с α 5 субъединицами [54]. Более того, несмотря на убедительные нейрохимические доказательства того, что альпидем является частичным агонистом в нескольких анализах с использованием нативных рецепторов [50, 51], он ведет себя как полный (т.е.д, BZ-подобный) агонист в электрофизиологических анализах с использованием рекомбинантных рецепторов, несущих субъединицы α 1 [55, 56] или α 2 [57]. Если теперь рассматривать профиль оцинаплона (который не показал никаких признаков BZ-подобных побочных эффектов в клинике), будет мало доказательств селективности подтипа с эффективностью (по сравнению с диазепамом) в диапазоне от 0,85 в α 1 β 2 γ 2 рецепторов до 0,25 при α 5 β 2 γ 2 содержащих рецепторов [30].Взятые вместе, эти данные, по-видимому, согласуются с гипотезой о том, что высокая эффективность в отношении рецепторов, содержащих α 1 , не обязательно приводит к седативному эффекту. Тем не менее, эта гипотеза не согласуется с профилем золпидема, который, как и альпидем, проявляет как селективность α 1 , так и высокую эффективность в отношении рекомбинантных рецепторов GABA A , но в дополнение к анксиолитической активности обладает седативным действием и продавался в основном как успокаивающее. Эта загадка была обнаружена на раннем этапе [58, 59] и до недавней публикации клинических данных с такими соединениями, как TPA 023 и MRK 409 [20, 29], в значительной степени игнорировалась, что было омрачено исследованиями на генно-инженерных мышах [28, 60].Эти последние исследования привели к развитию еще одной волны предполагаемых анксиоселективных средств, перемещающихся в клинику, основанных на эффективности при α 2 (и в меньшей степени α 3 ), содержащих рецепторы с низкой или нулевой эффективностью при α 1 , содержащие рецепторы. .
Генная инженерия и меняющиеся теории анксиоселективности
В конце 1990-х годов были проведены исследования с использованием генно-инженерных «нечувствительных к диазепаму» мышей, несущих точечную мутацию в ключевых остатках гистидина на α 1,2,3 и 5 субъединицах ( стратегия столкновения) изменила современные представления о рецепторах GABA и , ответственных за анксиолитическое действие BZ.Выводы, сделанные из этих исследований, можно рассматривать как удивительные в свете существующего массива опубликованных клинических данных. Таким образом, независимые исследования с использованием мышей, полученных из разного происхождения, показали, что мутация α 1 (h201R) устраняет способность диазепама снижать двигательную активность [60, 61], что авторы использовали в качестве суррогатной меры седативного эффекта. Эта мутация также устраняет амнестические эффекты диазепама [61], в то время как анксиолитическая активность сохраняется [60,61].МакКернан и др. . [60] также продемонстрировали, что L-838,417, частичный агонист (с аналогичным сродством) α 2,3, и 5 , содержащий рецепторы и нулевой эффективный (т. Е. Антагонист) на α 1 , содержащий рецепторы, сохраняет анксиолитический- подобна активности в приподнятом крестообразном лабиринте, но не снижает двигательную активность. Авторы пришли к выводу, что рецепторы GABA A , несущие субъединицу α 1 , не требуются для анксиолитического действия, но имеют решающее значение для седативных свойств BZ.Löw и др. . [62] расширили эти результаты, продемонстрировав, что анксиолитическое действие диазепама в тестах выбора «приподнятый крестообразный лабиринт» и «свет / темнота» было отменено у мышей с нокаутом α 2 (h201R), тогда как действие диазепама на обоих двигательная активность и вращательное поведение (используемые как заменители седативного эффекта и атаксии) не пострадали. Используя эту стратегию подбрасывания, Löw et al. . [63] также пришли к выводу, что α 3 , содержащий рецепторы GABA A , не способствует анксиолитическому действию диазепама.
Однако дальнейшие исследования показали более сложную картину. Исследования с предпочтительным соединением α 3 (TP 003) у мышей с нокаутом α 2 продемонстрировали, что интактная субъединица α 2 не является необходимой для анксиолитической активности этого соединения [63]. Электроэнцефалографические исследования (ЭЭГ) на мышах с нокаутом α 1 [64] продемонстрировали, что эффекты диазепама на ЭЭГ сна (возможно, лучший суррогат седативного потенциала соединения, чем двигательная активность) у этих мышей не были затронуты, а скорее в зависимости от наличия субъединицы α 2 [65].Другие исследования с использованием мышей knock-in [66] показали, что субъединица α 2 и в меньшей степени субъединица α 3 вносят вклад в миорелаксантное действие диазепама. Несмотря на появление несоответствий в «новой фармакологии бензодиазепинов» * 28], несколько компаний приняли концептуальную основу, согласно которой активация рецепторов, содержащих субъединицу α 1 , приводит к седативному эффекту, тогда как селективный анксиолиз может быть достигнут путем активации субъединицы α 2 , содержащей рецепторы.Из-за трудностей синтеза соединений, которые являются высокоселективными в отношении рецепторов, содержащих α 2 , была принята альтернативная стратегия: разработка соединений с низкой или нулевой эффективностью в отношении рецепторов, несущих субъединицу α 1 , и частичными агонистическими свойствами при α 2 3 и 5 несущих рецепторов. Эта стратегия могла быть частично основана на привлекательном доклиническом профиле L-838,417, который проявлял анксиолитические свойства в нескольких моделях без каких-либо доказательств двигательной недостаточности [60].В клинику поступило множество соединений с таким нейрохимическим профилем, что привело к разочаровывающим или, в лучшем случае, неоднозначным результатам. Некоторые из этих соединений были разработаны Merck, и данные, полученные с помощью этих молекул, особенно поучительны из-за возможности проводить прямые сравнения между молекулами, включая исследования с помощью ПЭТ-изображений (для измерения занятости рецепторов) у грызунов, не относящихся к человеку. приматы и люди.
MRK 409 (также известный как MK 0343) представляет собой триазолопиридазин, структурно связанный с L-838,417 ().MRK 409 также связывается с очень высоким сродством (Ki <1 нМ), хотя и неселективно, с рецепторами DS GABA A . MRK 409 является агонистом с низкой эффективностью в отношении рецепторов, экспрессирующих субъединицы α 1 (0,18 относительно хлордиазепоксида), а также проявляет свойства частичного агониста (с эффективностями 0,23, 0,45 и 0,18) при α , 2,3 и 5 , несущих рецепторы соответственно [20]. MRK 409 вызывал дозозависимые анксиолитические эффекты на нескольких доклинических моделях (как на грызунах, так и приматах) с пероральными МЭД в диапазоне от 0.1–3 мг / кг. Эти дозы соответствуют занятости рецепторов на уровне 35–65%, по оценкам ПЭТ-исследований с использованием флумазенила 11 C в качестве радиоактивного индикатора. Напротив, при гораздо более высоких дозах, соответствующих занятости рецепторов, оцененных в 79–99%, седативный эффект был незначительным или отсутствовал вовсе. Возможно, наиболее примечательными были открытия на беличьих обезьянах, у которых не наблюдалось никаких признаков седативного действия при дозах, в 100 раз превышающих MED для анксиолитических эффектов [20]. Однако у здоровых добровольцев мужского пола MRK 409 (0.75 мг) снижали как пиковую скорость саккад [67] (чувствительный индикатор седативного действия лекарств), так и показатели настороженности, оцениваемые с помощью ВАШ. При дозе 1 мг (максимально переносимая доза, MTD) были сообщения об усталости, сонливости и головокружении, а при дозе 2 мг пять из шести субъектов сообщили о выраженном седативном действии. В MTD занятость рецепторов, определенная с помощью ПЭТ, находилась на пределе чувствительности (т. Е. Занятость <10%). Хотя заметный контраст между доклиническими и клиническими данными можно рассматривать как удивительный, профиль in vitro MRK 409 на рекомбинантных рецепторах GABA A напоминает бретазенил, который также проявлял анксиоселективный профиль на доклинических моделях и вызывал глубокий седативный эффект. у здоровых добровольцев.
Седативные эффекты MRK 409 были приписаны его частичным агонистическим свойствам рецепторов α 1 [20], но клинические данные с двумя другими соединениями, разработанными в этой программе, не согласуются с этой точкой зрения. TPA023 () представляет собой монофторированный аналог L-838,417 [60] с нулевой эффективностью при α 1 и низкой эффективностью при α 2,3 и 5 рецепторов, несущих рецепторы (0,11, 0,21, 0,05 по сравнению с хлордиазепоксидом, соответственно). . Принимая во внимание гипотезу о том, что анксиолиз требует активации рецепторов, несущих α 2 , очень низкая эффективность TPA 023 может рассматриваться как препятствие.Однако БЗ оказывают анксиолитическое действие при низкой занятости рецепторов (15–20%) [40,68]. TPA 023 проявлял анксиолитическую активность как у грызунов, так и у приматов с пероральными значениями MED в диапазоне 0,3–3 мг / кг, без седативных эффектов при дозах в 10–30 раз выше (в исследованиях ПЭТ с использованием флумазенила 11 C эти дозы соответствуют> 99% занятости рецепторов) [29]. Однако у здоровых добровольцев мужского пола дозы 0,5–1,5 мг TPA 023 снижали пиковую скорость саккад [29], что свидетельствует о седативном действии.В исследованиях безопасности и переносимости наблюдались головокружение, сонливость и нарушение координации движений при приеме 2 мг (определенная МПД), что, по-видимому, обеспечивает занятость рецепторов на 35–65% [29]. Это соединение было продвинуто к множеству исследований возрастающей дозы с использованием состава с пролонгированным высвобождением, с сонливостью и моторной несогласованностью в качестве ограничивающих побочных эффектов [29]. Несмотря на эти BZ-подобные побочные эффекты, TPA 023 был оценен в нескольких небольших исследованиях GAD, прежде чем программа была прекращена из-за доклинических данных о токсичности [29].Объединив данные отдельных исследований с использованием гибкого дозирования от 1,5–4,5 до 3–8 мг состава с пролонгированным высвобождением, можно было продемонстрировать значительное (3,5 балла) отличие от плацебо по общему баллу HAM-A через одну неделю дозирования. . Этот эффект сохранялся в течение трех недель, но больше не проявлялся на 4 неделе исследования [29].
Третье соединение из программы развития Merck, исследованное в клинике, TPA 023B, структурно отличается от TPA 023 и MRK 409 ().TPA 023b связывается с высокой аффинностью (0,7–2 нМ) с рекомбинантными рецепторами DS GABA A и демонстрирует «идеальный» профиль агонистов: практически нулевая эффективность (0,03 относительно хлордиазепоксида) в отношении α 1 рецепторов с умеренной эффективностью при α 2,3 и 5 , несущие рецепторы (0,38, 0,50 и 0,37 относительно хлордиазепоксида соответственно). Как и его предшественники, TPA 023B был однозначно анксиоселективным в доклинических моделях. Об анксиолитических эффектах сообщалось как у приматов, так и у грызунов [69], при этом седативный эффект не наблюдался при дозах до 30 раз выше, что соответствует занятости рецепторов> 98% [69].В исследованиях фазы I усталость / усталость и сонливость / сонливость были отмечены у четырех из восьми субъектов в дозе 1 мг. Ограничивающими дозу побочными эффектами при МПД (2 мг) были утомляемость и сонливость, что соответствовало ~ 55% занятости рецепторов, определенной с помощью ПЭТ-изображений [69].
Было заявлено, что такие соединения, как TPA 023 и 023B, обладают относительно меньшим седативным действием, чем BZ, потому что для создания седативного эффекта требуется более высокая занятость рецепторов (50–60% по сравнению с занятостью рецепторов <25% для BZ) [29].Это различие, по-видимому, не имеет большого клинического значения в отношении развития анксиоселективности. Таким образом, хотя TPA 023 давал некоторые признаки положительного сигнала при ГТР [29], сонливость и нарушение координации мышц ограничивали побочные эффекты. BZ-подобные побочные эффекты, наблюдаемые с этими соединениями, несмотря на демонстрацию нулевой эффективности в отношении рекомбинантных рецепторов, несущих α 1 , представляют собой убедительные доказательства того, что клиническое проявление седативного эффекта требует активации других подтипов рецепторов GABA A .В соответствии с этой гипотезой MRK 409 оказывает седативный эффект при более низкой занятости рецепторов (на уровне или ниже пределов обнаружения), чем обычно наблюдается с BZ [69], несмотря на внутреннюю эффективность при α 1 , содержащем рецепторы <20%, чем у хлордиазепоксида [20, 69].
Есть ли путь вперед?
Тридцать пять лет прошло с тех пор, как основополагающее открытие рецепторов BZ послужило катализатором разработки анксиоселективных средств на основе рецепторов GABA A , и многие сотни миллионов долларов были потрачены на поиски «Святого Грааля».’Экономические стимулы для успешного развития анксиоселективного метода позволили сделать несколько «ударов по воротам». Основываясь на коммерциализации (хотя и кратковременной) альпидема и двух многоцентровых исследований фазы II с оцинаплоном, цель разработки анксиолитиков на основе рецептора GABA A с улучшенным профилем побочных эффектов в принципе была достигнута. Тем не менее, мы, вероятно, не лучше осведомлены о рецепторах GABA и , ответственных либо за клинические профили этих соединений, либо за седативный эффект, вызываемый такими соединениями, как MRK 409, бретазенил и TPA 023.С точки зрения трансляции поразительно, что усталость, сонливость / сонливость, головокружение и головокружение являются заметными побочными эффектами молекул, обладающих нулевой или низкой эффективностью в отношении α 1 , несущих рецепторы GABA A . Измерение двигательной активности у видов (крыс и мышей), живущих горизонтально, может моделировать седативный эффект (успокаивающий, успокаивающий эффект), но не может предсказывать способность способствовать сну (снотворное). Это различие, согласующееся с более строгими исследованиями ЭЭГ на α 1 и α 2 мышей с нокаутом [64, 65], имеет небольшое клиническое значение для развития анксиоселективного метода.Возможно, еще более загадочным является сообщение об отсутствии седативных эффектов таких соединений, как бретазенил, TPA 023 и MRK 409 у приматов. Эти исследования, как правило, полагались на снижение оперантной реакции (нажатие на рычаг) для прогнозирования седативного эффекта [30], и, следовательно, могут быть не очень чувствительными. Хотя исследования ЭЭГ с этими соединениями на приматах, кроме человека, не были опубликованы, явные признаки седативного действия должны быть очевидны для обученного наблюдателя [30].
Одно из возможных объяснений неспособности точно предсказать фармакологические свойства этих соединений у разных видов может быть связано с видовыми различиями в составе и распределении рецепторов GABA A .Таким образом, в то время как α 1 β 2 γ 2 рецепторы GABA A являются наиболее распространенной изоформой в головном мозге грызунов, значительная часть (> 25%) рецепторов, несущих α 1 , является гетерогенной (содержащей либо α 2 или α 3 субъединиц) [70]. Более того, субъединицы α 2 и α 3 существуют как преимущественно гетеромерные рецепторы GABA A в головном мозге грызунов [70], но ни пропорция, ни распределение этих гетерогенных рецепторов у других видов, включая человека, неизвестны.Различия между видами в пропорции или распределении этих гетерогенных рецепторов могут резко изменить поведенческие действия соединения. Кроме того, свойства описанной молекулы (например, ее эффективность) в рекомбинантных рецепторах GABA A , которые являются гомогенными по отношению к субъединице α, могут не отражать фармакологию нативных рецепторов, обогащенных этими гетерогенными рецепторами. Ответ на лекарство у мышей с мутированной, нечувствительной к диазепаму α-субъединицей (например,, субъединица α 2 (h201R)), где большинство этих рецепторов являются гетерогенными [70], может объяснить некоторые из противоречивых результатов между исследованиями на этих мышах и фармакологическими исследованиями с использованием селективных подтипов агентов. Некоторые яркие примеры этих противоречивых результатов включают анксиолитическое действие соединения, предпочитающего α 3 (TP 003), как у мышей дикого типа, так и у мышей, несущих мутированную субъединицу α 2 [63], и способность селективного α 1 антагониста β-CCT (3- t- бутокси-β-карболин) [71] для блокирования анксиолитических (но не миорелаксантных или атаксических) эффектов BZ [72,73] .
Заключительные замечания
Несмотря на очевидные терапевтические преимущества анксиоселективного средства на основе рецептора GABA A , поиски Святого Грааля были оставлены. Если рассматривать в контексте среды, не допускающей риска, которая заставила многие фармацевтические компании отказаться от разработки лекарств от психических расстройств, отсутствие последовательной гипотезы для объяснения клинических профилей молекул, от оцинаплона до бретазенила, делает маловероятным, что дополнительный ресурсы будут направлены на разработку анксиоселективных препаратов на основе рецептора GABA A .Как минимум, разработка модели на животных, которая может прогнозировать седативные свойства (например) бретазенила и MRK 409, устраняет ближайшую причину этих неудач в клинике. Такая модель, вместе с доступностью множества соединений с определенными клиническими профилями и мощным молекулярным набором инструментов, вполне могла бы оживить поиск анксиоселективных средств на основе рецептора GABA A .
Благодарности
Эта статья посвящена моему другу и коллеге докторуАрнольд С. Липпа. Его энергия и видение предоставили многие инструменты, позволившие осуществить этот поиск.
Footnotes
1 Соединения, которые связываются с этим аллостерическим модуляторным доменом на рецепторах GABA A [7], включают 1,4-BZ и более десятка структурно различных видов. Молекулярные и структурные требования для связывания лиганда с высоким сродством к рекомбинантным рецепторам GABA A хорошо изучены [8,9].
2 1,4-BZ также являются прекрасными снотворными, снотворными, миорелаксантами, амнезиаками (полезными в качестве предоперационных препаратов) и противосудорожными средствами.Демонстрация гетерогенности рецепторов привела к гипотезе о том, что эти фармакологические действия разделимы; профиль CL 218 872 in vivo является принципиальным доказательством того, что такое разделение может быть достигнуто [16].
3 Ряд СИОЗС и СИОЗСН были одобрены для лечения ГТР, начиная с конца 1990-х годов; многие из этих соединений в настоящее время являются универсальными.
Заявление об ограничении ответственности: мнения, выраженные в этой статье, не обязательно отражают точку зрения Национального института по борьбе со злоупотреблением наркотиками, Национальных институтов здравоохранения или Министерства здравоохранения и социальных служб.
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации. В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Ссылки
1. Шталь С. Не спрашивайте, не говорите, но бензодиазепины по-прежнему являются ведущими препаратами для лечения тревожного расстройства. Журнал клинической психиатрии. 2002; 63: 756–757. [PubMed] [Google Scholar] 2. Нэш Дж. Р., Натт Д. Фармакотерапия тревоги. В: Сибли Д.Р. и др., Ред. Справочник по современной нейрофармакологии. Джон Уайли и сыновья; 2007. С. 59–91. [Google Scholar] 3. Wittchen HU, Hoyer J. Общее тревожное расстройство: природа и течение. J Клиническая психиатрия. 2011; 62 (Приложение 11): 15–21.[PubMed] [Google Scholar] 4. Поллак MH. Пароксетин в лечении генерализованного тревожного расстройства: результаты плацебо-контролируемого исследования с гибкой дозировкой. Журнал клинической психиатрии. 2001. 62: 350–357. [PubMed] [Google Scholar] 5. Панде А. и др. Прегабалин при генерализованном тревожном расстройстве: плацебо-контролируемое исследование. Американский журнал психиатрии. 2003. 160: 533–540. [PubMed] [Google Scholar] 6. Choi DW, et al. Хлордиазепоксид избирательно усиливает действие ГАМК в культурах клеток спинного мозга.Природа. 1977; 269: 342–344. [PubMed] [Google Scholar] 7. Барнард Э.А. и др. Международный союз фармакологии. XV. Подтипы рецепторов γ-аминомасляной кислоты (A) : классификация на основе субъединичной структуры и функции рецептора. Фармакологические обзоры. 1998. 50: 291–313. [PubMed] [Google Scholar] 8. Lüddens H, Korpi ER. Бензодиазепины. В: Сибли Д.Р. и др., Ред. Справочник по современной нейрофармакологии. Vol. 2. Джон Уайли и сыновья; 2007. С. 93–131. [Google Scholar] 9. Richter L, et al.Модели диазепам-связанных рецепторов GABAA идентифицируют новые лиганды сайта связывания бензодиазепина. Nat Chem Biol. 2012; 8: 455–464. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Mohler H, Okada T. Бензодиазепиновый рецептор: проявление в центральной нервной системе. Наука. 1977; 198: 849–851. [PubMed] [Google Scholar] 11. Сквайрс Р.Ф., Брейструп С. Бензодиазепиновые рецепторы в мозге крысы. Природа. 1977; 266: 732–734. [PubMed] [Google Scholar] 12. Липпа А.С. и др. Синтетический небензодиазепиновый лиганд для бензодиазепиновых рецепторов — зонд для исследования нервных субстратов беспокойства.Фармакология, биохимия и поведение. 1979; 11: 99–106. [PubMed] [Google Scholar] 13. Липпа А.С. и др. Бензодиазепиновые рецепторы — клеточные и поведенческие характеристики. Фармакология, биохимия и поведение. 1979; 10: 831–843. [PubMed] [Google Scholar] 14. Липпа А.С. и др. Роль ГАМК в обеспечении противосудорожных свойств бензодиазепинов. Бюллетень исследований мозга. 1980; 5 (Приложение 2): 861–865. [Google Scholar] 15. Vogel JR и др. Простая и надежная конфликтная процедура для тестирования успокаивающих средств.Психофармакология. 1971; 21: 1–7. [PubMed] [Google Scholar] 16. Липпа А.С. и др. Молекулярные субстраты беспокойства: ключи от гетерогенности бензодиазепиновых рецепторов. Естественные науки. 1982; 31: 1409–1417. [PubMed] [Google Scholar] 17. Таллман Дж. Ф. и др. Рецепторы для возраста беспокойства — фармакология бензодиазепинов. Наука. 1980; 207: 274–281. [PubMed] [Google Scholar] 18. Abbott A. Novartis закрывает центр исследования мозга. Природа. 2011; 480: 161–162. [PubMed] [Google Scholar] 19. Czobor P, et al.Многоцентровое плацебо-контролируемое двойное слепое рандомизированное исследование эффективности и безопасности Оцинаплона (DOV 273 547) при генерализованном тревожном расстройстве. ЦНС неврологии и терапии. 2010; 16: 63–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Атак Дж. Р. и др. MRK-409 (MK-0343), частичный селективный агонист рецептора GABAA по подтипу, является неседативным анксиолитиком у доклинических видов, но вызывает седативный эффект у людей. Журнал психофармакологии. 2011; 25: 314–328. [PubMed] [Google Scholar] 21. Schofield PR, et al.Последовательность и функциональная экспрессия рецептора GABA A демонстрирует суперсемейство лиганд-зависимых рецепторов. Природа. 1987. 328: 221–227. [PubMed] [Google Scholar] 22. Shivers BD, et al. Две новые субъединицы рецептора GABAA существуют в разных субпопуляциях нейронов. Нейрон. 1989; 3: 327–337. [PubMed] [Google Scholar] 23. Minier F, Sigel E. Позиционирование изоформ α-субъединицы придает функциональную сигнатуру рецепторам γ-аминомасляной кислоты типа A. Труды Национальной академии наук Соединенных Штатов Америки.2004. 101: 7769–7774. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Бережной Д. и др. Фармакология рецептора ГАМК. В: Сибли Д.Р. и др., Ред. Справочник по современной нейрофармакологии. Джон Уайли и сыновья; 2007. С. 465–568. [Google Scholar] 25. МакКернан Р.М., Уайтинг П.Дж. Какие подтипы рецепторов GABA A действительно встречаются в головном мозге? Тенденции в неврологии. 1996. 19: 139–143. [PubMed] [Google Scholar] 26. Wisden W, et al. Распределение мРНК субъединицы рецептора GABA A в головном мозге крысы.I. Конечный мозг, промежуточный мозг, средний мозг. Журнал неврологии. 1992; 12: 1040–1062. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Wieland HA, et al. Один гистидин в рецепторах GABA A необходим для связывания бензодиазепиновых агонистов. Журнал биологической химии. 1992; 267: 1426–1429. [PubMed] [Google Scholar] 28. Möhler H, et al. Новая фармакология бензодиазепинов. J Pharmacol Exper Ther. 2002; 300: 2–8. [PubMed] [Google Scholar] 29. Атак Младший. Подтип-селективная модуляция рецептора GABA A дает новый фармакологический профиль: дизайн и разработка TPA023.В: Enna SJ, Williams M, редакторы. Достижения фармакологии Современные аспекты открытия лекарств в биомедицинских исследованиях. Vol. 57. Academic Press; 2009. С. 137–185. [PubMed] [Google Scholar] 30. Липпа А. и др. Селективный анксиолиз, производимый оцинаплоном, модулятором рецепторов ГАМК. Труды Национальной академии наук Соединенных Штатов Америки. 2005. 102: 7380–7385. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Липпа А. и др. Доклинические процедуры нейропсихофармакологического тестирования анксиолитических препаратов.В: Филдинг С., Лал Х, редакторы. Анксиолитики. Издательская компания Futura; 1979. С. 41–82. [Google Scholar] 32. Haefely W, et al. Новые анксиолитики, действующие как частичные агонисты бензодиазепиновых рецепторов. Направления фармакологических наук. 1990; 11: 452–456. [PubMed] [Google Scholar] 33. Ван Стивенинк А. и др. Фармакокинетические и фармакодинамические взаимодействия бретазенила и диазепама с алкоголем. Br J Clin Pharmacol. 1996. 41: 565–573. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Стивенс Д. Н. и др.Абекарнил, метаболически стабильный, анксиоселективный бета-карболин, действующий на бензодиазепиновые рецепторы. Журнал фармакологии и экспериментальной терапии. 1990; 253: 334–343. [PubMed] [Google Scholar] 35. Дука Т. и др. Исследования на людях абекарнила, нового анксиолитика бета-карболина: безопасность, переносимость и предварительный фармакологический профиль. Br J Clin Pharmacol. 1993; 35: 386–394. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Aufdembrinke B. Abecarnil, новый бета-карболин, в лечении тревожных расстройств.Брит Дж. Психиатр. 1998. 173: 55–63. [PubMed] [Google Scholar] 37. Pollack MH, et al. Абекарнил для лечения генерализованного тревожного расстройства: плацебо-контролируемое сравнение двух диапазонов доз абекарнила и буспирона. J Клиническая психиатрия. 1997; 58 (прил. 11): 19–23. [PubMed] [Google Scholar] 38. Чилман-Блэр К. и др. Оцинаплон. Наркотики будущего. 2003. 28: 115–120. [Google Scholar] 39. Живкович Б. и др. Фармакологический и поведенческий профиль альпидема как анксиолитика. Фармакопсихиатрия.1990; 23: 108–113. [PubMed] [Google Scholar] 40. Джонс Г. Х. и др. Сравнение нескольких лигандов бензодиазепиновых рецепторов в двух моделях анксиолитической активности у мышей: анализ, основанный на фракционной занятости рецепторов. Психофармакология. 1994; 114: 191–199. [PubMed] [Google Scholar] 41. Хаскоет М., Бурин М. Противоконфликтный эффект альпидема по сравнению с бензодиазепином альпразоламом у крыс. Фармакология, биохимия и поведение. 1997. 56: 317–324. [PubMed] [Google Scholar] 42. Dimsdale M, et al.Альпидем. Наркотики будущего. 1988. 13: 106–109. [Google Scholar] 43. Musch B и др. Клинические исследования нового анксиолитического альпидема у тревожных пациентов: обзор европейского опыта. Pharmacol, Biochem и Behav. 2012; 29: 803–806. [PubMed] [Google Scholar] 44. Розенцвейг П. и др. Альпидем: отсутствие седативного действия на психомоторную работоспособность в терапевтических дозах. Hum Psychopharmacol. 1993. 8: 409–415. [Google Scholar] 45. Мортон С., Ладер М. Исследования альпидема на нормальных добровольцах и тревожных пациентах.Фармакопсихиатрия. 1990; 23: 120–123. [PubMed] [Google Scholar] 46. Патат А. и др. Оценка взаимодействия между частичным агонистом и полным агонистом бензодиазепиновых рецепторов на основе психомоторных характеристик и памяти у здоровых добровольцев. Журнал психофармакологии. 1995; 9: 91–101. [PubMed] [Google Scholar] 47. Perrault G, et al. Повторное лечение альпидемом, новым анксиолитиком, не вызывает толерантности или физической зависимости. Neuropharmacol. 1993; 9: 855–863. [PubMed] [Google Scholar] 48.Батый В. и др. Гепатит, вызванный альпидемом (ананксилом). Четыре случая, один из которых закончился летальным исходом. Гастроэнтерол Clin Biol. 1994; 18: 1129–1131. [PubMed] [Google Scholar] 49. Прибилла I и др. Абекарнил является полным агонистом некоторых подтипов и частичным агонистом других подтипов рекомбинантных рецепторов ГАМК. Psychopharmacol Ser. 1993; 11: 50–61. [PubMed] [Google Scholar] 50. Живкович Б. и др. Альпидем, частичный агонист рецепторов омега-1: новый подход к лечению тревоги. Европейская нейропсихофармакология. 1991; 1: 202–205.[Google Scholar] 51. Langer SZ, et al. Золпидем и Альпидем: два имидазопиридина с селективностью к подтипам Ω1- и Ω3-рецепторов. В: Biggio G, Costa E, редакторы. Подтипы ГАМК и бензодиазепиновых рецепторов. Raven Press; 1990. С. 61–72. [PubMed] [Google Scholar] 52. Грэм Д. и др. Фармакологический профиль лигандов бензодиазепиновых сайтов с рекомбинантными подтипами рецепторов GABA A . Европейская нейропсихофармакология. 1996. 6: 119–125. [PubMed] [Google Scholar] 53. Смит А.Дж. и др. Влияние субъединицы α на аллостерическую модуляцию функции ионных каналов в стабильно экспрессируемых человеческих рекомбинантных рецепторах γ-аминомасляной кислоты A , определенных с использованием потока ионов 36Cl.Молекулярная фармакология. 2001; 59: 1108–1118. [PubMed] [Google Scholar] 54. Faure-Halley C, et al. Экспрессия и свойства рекомбинантных форм α1β2γ2 и α5β2γ2 крысиного рецептора GABA A . Eur J Pharmacol — Mol Pharmacol Sect. 1993; 246: 283–287. [PubMed] [Google Scholar] 55. Ducic I, et al. Триазолам более эффективен, чем диазепам, в широком спектре рекомбинантных рецепторов GABA (A) . Европейский журнал фармакологии — раздел молекулярной фармакологии. 1993. 244: 29–35. [PubMed] [Google Scholar] 56.Im HK, et al. Усиление индуцированных γ-аминомасляной кислотой хлоридных токов различными агонистами бензодиазепиновых сайтов с подтипами α1γ2, β2γ2 и α1 β 2 γ 2 клонированных рецепторов типа A γ-аминомасляной кислоты. Молекулярная фармакология. 1993; 44: 866–870. [PubMed] [Google Scholar] 57. Wafford KA. Функциональное сравнение роли гамма-субъединиц в рекомбинантных человеческих рецепторах γ-аминомасляной кислоты A / бензодиазепина. Молекулярная фармакология. 1993; 44: 437–442. [PubMed] [Google Scholar] 58. Сколник П.Имеет ли отношение гетерогенность рецепторов к анксиолитическому действию лигандов бензодиазепиновых рецепторов? В: Briley M, File S, редакторы. Новые концепции в тревоге. Macmillan Press Ltd; 1991. С. 190–202. [Google Scholar] 59. Сэнгер DJ. Последние достижения в поведенческой фармакологии бензодиазепиновых (Ω) рецепторов: доказательства функционального значения подтипов рецепторов. Обзоры неврологии и биоповеденческих исследований. 1994; 18: 355–372. [PubMed] [Google Scholar] 60. McKernan RM. Седативные, но не анксиолитические свойства бензодиазепинов опосредуются подтипом α1 рецептора GABA (A) .Природа нейробиологии. 2000; 3: 587–592. [PubMed] [Google Scholar] 61. Рудольф У. Действие бензодиазепина опосредовано специфическими подтипами рецепторов γ-аминомасляной кислоты (A) . Природа. 1999; 401: 796–800. [PubMed] [Google Scholar] 62. Лёв К. и др. Молекулярный и нейрональный субстрат для избирательного ослабления беспокойства. Наука. 2000. 290: 131–134. [PubMed] [Google Scholar] 63. Диас Р. и др. Доказательства значительной роли α3-содержащих рецепторов ГАМК и в опосредовании анксиолитических эффектов бензодиазепинов.Журнал неврологии. 2005; 25: 10682–10688. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Tobler I, et al. Диазепам-индуцированные изменения сна: роль подтипа рецептора α1 GABA A . Труды Национальной академии наук. 2001. 98: 6464–6469. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Копп С. и др. Модуляция ритмической активности мозга диазепамом: GABA Подтип рецептора и специфичность состояния. Труды Национальной академии наук Соединенных Штатов Америки.2004. 101: 3674–3679. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Crestani F, et al. Молекулярные мишени миорелаксирующего действия диазепама. Молекулярная фармакология. 2001; 59: 442–445. [PubMed] [Google Scholar] 67. де Хаас С.Л. и др. Фармакодинамические и фармакокинетические эффекты MK-0343, селективного агониста подтипа GABA A α2,3, по сравнению с лоразепамом и плацебо у здоровых добровольцев мужского пола. Журнал психофармакологии. 2008; 22: 24–32. [PubMed] [Google Scholar] 68. Липпа А.С. и др. Связь бензодиазепиновых рецепторов и экспериментального беспокойства у крыс.Фармакология, биохимия и поведение. 1978; 9: 853–856. [PubMed] [Google Scholar] 69. Атак Дж. Р. и др. Доклиническая и клиническая фармакология TPA023B, частичного селективного агониста подтипа α2 / α3 рецептора GABA A . Журнал психофармакологии. 2011; 25: 329–344. [PubMed] [Google Scholar] 70. Бенке Д. и др. Анализ присутствия и изобилия рецепторов GABA и , содержащих два различных типа α-субъединиц в мозге мышей, с использованием точечно-мутированных α-субъединиц. Журнал биологической химии.2004; 279: 43654–43660. [PubMed] [Google Scholar] 71. Джун Х.Л., Эйлер ВДж. Дофаминергическая и ГАМКергическая регуляция алкогольного поведения: новые нейроанатомические субстраты. В: Сибли Д. и др., Ред. Справочник по современной нейрофармакологии. Vol. 2. Джон Уайли и сыновья; 2007. С. 465–533. [Google Scholar] 72. Шеннон Х. и др. β-карболин-3-карбоксилат-трет-бутиловый эфир; селективный антагонист бензодиазепиновых рецепторов BZ1. Естественные науки. 1984; 35: 2227–2236. [PubMed] [Google Scholar] 73. Belzung C, et al.β-CCT, селективный антагонист рецептора BZ-Ω1, блокирует успокаивающее, но не амнестическое действие хлордиазепоксида у мышей. Behav Pharmacol. 2000. 11: 125–131. [PubMed] [Google Scholar]определение анксиолитика в Медицинском словаре
Однако ни одно исследование не сравнивало анксиолитические эффекты силовых тренировок в разных возрастных группах, хотя в одном исследовании, проведенном на популяции со средним возрастом 32,8 года, наблюдалось снижение тревожности после силовых тренировок (32). BLA коррелирует с тревожным поведением, при котором повышение возбудимости является анксиогенным, а снижение — анксиолитическим (50,51,52).Кроме того, тест OF показывает, что EEYP проявляет анксиолитическую активность. Мексикана, собранная в различных регионах Мексики, таких как Мичоакан, (6) Эстадо-де-Мехико, (17) Герреро, Идальго и Веракрус (7), оказывает анксиолитическое и седативное действие на Мыши.Ряд природных молекул, таких как неполярные кумарины (императорин и изоимператорин), мирицитрин, госсипин, кверцетин, нарингин, кемпферол, апигенин, гиперицин, кардиоспермин, хризин, коричная кислота, пкумариновая кислота, кофейная кислота, феруловая кислота, синаповая кислота. кислота, санджоинин А, обоватол, магнолол, хонокиол и линалоол, выделенные из растений, показали многообещающую анксиолитическую активность (Fernandez et al.Диб, «Сродство циамемазина, анксиолитического антипсихотического препарата, к рекомбинантному дофамину человека по сравнению с ранее опубликованными сообщениями, анксиолитические вещества, такие как диазепам, увеличивали процент попаданий в открытые руки и время, проведенное животными в открытых руках [24-26]. ] .armatum, настоящее исследование было разработано для того, чтобы сначала извлечь эфирное масло из листьев растения с помощью метода паровой дистилляции; скрининг седативно-снотворных, анксиолитических, антидепрессивных и миорелаксантных эффектов с использованием различных установленных животных моделей с последующей GC / ГХ-МС анализ для идентификации химических компонентов.Однако эффекты, которые были сравнимы с диазепамом, наблюдались только с самым высоким исследованным объемом, который содержал такое же количество FAT, как и человеческие амниотические жидкости, что свидетельствует о способности такой концентрации FAT вызывать анксиолитическое действие и важность использования положительного контроля в этом случае. тип исследования. Однако у животных, не подвергавшихся воздействию MCS, субхронический флуоксетин вызывал ожидаемый анксиолитический эффект [30]. Но, несмотря на хорошо установленные клинические данные, демонстрирующие, что препараты, действующие на серотонинергические системы, обладают анксиолитическим действием, точные механизмы действия, конкретный подтип 5-HT рецептора, который отвечает за это, и расположение в мозге, которое задействовано, остаются неясными.Тест социального взаимодействия на тревожность оказался чрезвычайно полезным для выявления как анксиогенных, так и анксиолитических эффектов лекарств.Список анксиолитиков, седативных и снотворных средств — только дженерики
Что такое анксиолитики, седативные и снотворные средства?
Анксиолитики, седативные и снотворные средства — это лекарства, которые воздействуют на центральную нервную систему, снимая тревогу, улучшая сон или оказывая успокаивающее действие.
Бензодиазепины — основной класс препаратов, подпадающих под эту категорию.Хотя существует более двадцати производных бензодиазепина, только некоторые из них были одобрены для лечения тревожности (например, алпразолам, клоназепам, диазепам и лоразепам), бессонницы (например, эстазолам, флуразепам, квазепам, темазепам и триазолам) или паническое расстройство (например, алпразолам). Барбитураты — это более старый класс лекарств, который также использовался по этим показаниям; однако барбитураты имеют узкий терапевтический индекс (интервал эффективности до появления токсичности) и с большей вероятностью вызывают угнетение дыхания, кому и смерть, и в настоящее время используются очень редко.Основная проблема при использовании бензодиазепинов — это зависимость. Бензодиазепины различаются по своей способности вызывать седативный эффект и по продолжительности действия. Считается, что все бензодиазепины работают за счет усиления ингибирующего действия γ-аминомасляной кислоты (ГАМК).
Другие классы препаратов, которые также считаются эффективными для снятия тревоги, включают СИОЗС, СИОЗСН, трициклические антидепрессанты и буспирон; другие лекарства также могут быть прописаны не по назначению. Эти препараты часто предпочтительнее бензодиазепинов при тревоге, потому что они вряд ли вызовут зависимость; однако они могут действовать не так быстро, как бензодиазепины.СИОЗС обычно имеют отсроченное начало действия и могут поначалу усиливать тревогу.
Другие классы препаратов, обладающих седативным действием, включают антигистаминные препараты первого поколения, агонисты рецепторов мелатонина, анестетики, эзопиклон, залеплон, золпидем, зопиклон и некоторые другие. Многие из этих препаратов также обладают снотворным действием.
Типы анксиолитиков, седативных и снотворных средств
Дополнительную информацию см. В классах препаратов, перечисленных ниже.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы убедиться, что информация, отображаемая на этой странице, применима к вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Обновленная информация об анксиолитических и нейропротекторных свойствах этифоксина
Введение
Тревога, эмоциональное переживание, характеризующееся состоянием возбуждения и ожиданием опасности, было частью человеческого опыта на протяжении веков. Со временем были предложены многочисленные концепции тревоги и классификации, особенно в области медицины. Классификации тревожности регулярно меняют границы между ее различными клиническими проявлениями, и новые исследования продолжают выявлять дополнительные уровни сложности в ее патофизиологических механизмах.В настоящем обзоре мы сосредоточились на лечении тревоги этифоксином, небензодиазепиновым (БЗД) анксиолитиком. Наша цель состояла в том, чтобы представить общую картину анксиолитических свойств этифоксина как в рамках традиционных концептуальных рамок тревожных расстройств, так и с учетом новых перспектив, открытых недавними исследованиями.
Мы сосредоточились на лечении расстройств адаптации (AD), категории, которая была недавно пересмотрена в DSM-5 и ICD-11. Раньше акцент делался на субъективном дистрессе и эмоциональных расстройствах при АД, в основном с точки зрения тревожной или депрессивной симптоматики, что приводило к идентификации АД с тревогой (ADWA) и АД с депрессией.ADWA были описаны как более частые, чем их депрессивные коллеги, в основном затрагивающие молодых и профессионально активных людей. 1 Проявления тревоги при ADWA считались такими же тяжелыми, как и при генерализованных тревожных расстройствах. 2 Тем не менее, критика была высказана в отношении достоверности диагностических критериев DSM-IV и МКБ-10 для AD. Некоторые из них были рассмотрены в недавно опубликованных классификациях, в которых произошел сдвиг в сторону представления БА как расстройств, связанных с травмами и стрессорами.Диагностические критерии DSM-5 для AD включают преходящие дезадаптивные или патологические реакции на идентифицируемые стрессоры или изменения жизненных обстоятельств, с симптомами, появляющимися в течение 3 месяцев после стресса или начала. Тревога, депрессия и поведенческие расстройства теперь рассматриваются как потенциально связанные квалификаторы, а не как спецификаторы. Клинические проявления описываются как несоразмерные событию. В дополнение к его внутренней природе, стрессор должен рассматриваться в личном и межличностном контексте, в котором он возник, а также в культурных нормах.Классификация МКБ-11 идет еще дальше, определяя основные клинические проявления, а именно: 1) «озабоченность фактором стресса или его последствиями, включая чрезмерное беспокойство, повторяющиеся и тревожные мысли о факторах стресса или постоянные размышления о его последствиях» и 2 ) «Неспособность адаптироваться к стрессору, который вызывает значительные нарушения в личной, семейной, социальной, образовательной, профессиональной или других важных сферах жизнедеятельности». Если функционирование поддерживается, это достигается только за счет значительных дополнительных усилий, а если имеет место нарушение, оно должно быть намного сильнее, чем можно было бы ожидать, учитывая предыдущее функционирование человека.
Более точное определение БА может позволить идентифицировать ассоциированные биомаркеры ЦНС и всего тела на основе психобиологии травмы и фактора стресса и, в конечном итоге, улучшить их лечение. В частности, важно изучить роль ГАМК в AD 3 наряду с нейроэндокринными процессами и процессами в организме, такими как воспаление, иммунитет и окислительный стресс. 4
Традиционная концепция патофизиологии тревоги сосредоточена на структурной и функциональной дисфункции мозга. 5 Он рассматривает тревогу как результат изменения скоординированной активности мозговых путей, модулируемой локальными и удаленными синаптическими реле через нейротрансмиттеры. Структурно набор лимбических структур вовлечен в тревогу. К ним относятся миндалевидное тело, которое тесно связано с префронтальной корой и, по-видимому, имеет решающее значение для регуляции негативных эмоций. Различные нейротрансмиттеры и модуляторы играют важную функциональную роль в модуляции поведения, связанного с тревогой.К ним относятся медиаторы, связанные с осью гипоталамус-гипофиз-надпочечники (HPA), моноаминергические и ГАМКергические системы нейротрансмиссии, 7,8 нейропептидов, таких как холецистокинин, и липидные нейромодуляторы. 9
В дополнение к этому подходу к патофизиологии тревоги, ориентированному на мозг, появляется все больше доказательств того, что тревожные состояния также могут модулироваться воздействием на мозг соматических физиологических процессов, таких как воспаление, иммунитет и окислительный стресс. как кишечная микробиота. 10 Например, дисфункциональные взаимодействия с участием оси HPA и кишечной микробиоты 11 были описаны как вносящие вклад в патофизиологию тревоги. Было показано, что у людей стресс, общая черта всех тревожных расстройств, связан с несколькими фенотипами провоспалительной реакции, которые могут не реагировать на противовоспалительное действие глюкокортикоидов. 12 Кроме того, было показано, что несколько лекарств, снижающих клинические проявления тревоги (антидепрессанты, некоторые BZD и анксиолитики, не относящиеся к BZD), ослабляют вышеупомянутые аномальные физиологические процессы, указывая на возможный — и ранее недооцененный — аспект механизма действия анксиолитических препаратов. 13
Таким образом, возможно, потребуется расширить текущее понимание тревожных расстройств и их лечение, чтобы принять подход, охватывающий все тело. В частности, нам необходимо переоценить наше понимание механизмов действия анксиолитических препаратов, чтобы включить недавно выявленные механизмы внутри или вне ЦНС. Этифоксин, не-BZD анксиолитическая молекула, которая действует как положительный аллостерический модулятор ГАМКергической передачи, не является исключением из этого правила. Недавние исследования показали, что этифоксин может проявлять значительную противовоспалительную активность в ЦНС. 14 Влияние на иммунную систему 15 и нейроэндокринную систему, в частности, через связывание с транслокаторным белком внешней мембраны митохондрий (TSPO) 16 и синтез нейротрофического фактора, 17 также может способствовать анксиолитической активности этифоксина. Этот подход открывает новые захватывающие возможности для изучения механизмов действия этого анксиолитического агента.
Стратегии лечения тревожных расстройств основаны на исследованиях, основанных на фактах, а также на эмпирических экспериментах с лекарствами.Учитывая большое разнообразие клинических условий, в которых могут возникать проявления тревоги, и хронический характер этих проявлений, нереально ожидать найти единственное, оптимальное, основанное на доказательствах лечение для всех клинических ситуаций. Поэтому клиницистам необходимо глубже понять разнообразные механизмы действия анксиолитических средств, чтобы выбрать наиболее многообещающие анксиолитические препараты для своих пациентов.
В этом контексте мы провели подробный обзор механизмов, посредством которых этифоксин проявляет свою анксиолитическую активность.Выходя за рамки классических взаимодействий рецепторов GABA A , мы представляем новые данные исследований о других предполагаемых анксиолитических механизмах этифоксина.
Взаимодействие этифоксина с рецептором GABA
AРоль ГАМК
A нейротрансмиссии в патофизиологии тревогиИсследования на животных и визуализация головного мозга показали, что длительное нарушение регуляции сетей мозга, включающих корковые и определенные подкорковые области (миндалевидное тело, гиппокамп, таламус, префронтальную и поясную части коры головного мозга), способствует выражению симптомов тревоги. 5 В частности, было показано, что снижение ингибирующей ГАМКергической передачи в ЦНС имеет решающее значение для проявления тревоги. 18 В этом отношении структура и функция рецептора GABA A были под пристальным вниманием.
Рецептор GABA A представляет собой управляемый лигандом хлорид-селективный ионный канал. Это гетероолигомерный белок, состоящий из пяти субъединиц, пересекающих нейрональную мембрану. Большинство рецепторов GABA и включают две субъединицы α, две субъединицы β и одну субъединицу γ. 19 Субъединицы α и β обеспечивают связывание с ГАМК, в то время как субъединица γ придает чувствительность BZD, поскольку эти препараты связываются на границе раздела между субъединицами α и γ, увеличивая вероятность открытия канала в ответ на ГАМК. 20 Открытие этого проницаемого для хлоридов / бикарбонатов канала 21 по крайней мере двумя молекулами ГАМК вызывает приток отрицательно заряженных ионов хлорида, что приводит к временному снижению способности нейрональной мембраны проводить потенциалы действия, что приводит к фазовое торможение нейрона.Анксиолитический эффект лекарств, связывающихся с рецептором GABA A , объясняется облегчением открытия хлоридных каналов, тем самым усиливая ингибирование нейронов в ответ на GABA.
За последние полвека были разработаны многочисленные лиганды рецептора GABA A в качестве терапевтических агентов, включая анксиолитики, снотворные, миорелаксанты и противоэпилептические средства. Одним из таких анксиолитических препаратов является этифоксин (6-хлор-2-этиламино-4-метил-4-фенил-4H-3,1-бензоксазин), не содержащий BZD анксиолитический препарат, принадлежащий к классу бензоксазинов. 22–24 Сродство этифоксина к хлоридному каналу, связанному с рецептором GABA A , находится в микромолярном диапазоне, тогда как сродство BZD к тому же каналу находится в наномолярном диапазоне. 25 Этифоксин имеет двойной механизм действия на ГАМКергическую передачу, за счет как прямого воздействия на рецептор ГАМК, так и косвенного воздействия через синтез нейростероидов, позволяющий аллостерическую модуляцию рецептора ГАМК A . 26,27
Прямое действие этифоксина на рецептор GABA
AИсследования in vitro продемонстрировали, что этифоксин может ингибировать связывание специфического лиганда рецептора GABA A (т-бутилбиклофосфоротионат, TBPS) в коре головного мозга грызунов, что позволяет предположить наличие сайтов связывания этифоксина на рецепторе GABA A . .Доказательства in vivo функциональных последствий связывания этифоксина с рецептором GABA A получены в исследованиях на мышах, в которых было обнаружено, что этифоксин блокирует клонические припадки, вызванные TBPS, демонстрируя противосудорожный эффект, опосредованный рецептором GABA A . . 25
Более подробная информация о природе взаимодействия между этифоксином и рецептором GABA A была получена в исследованиях связывания радиолиганда, оценивающих конкуренцию со стороны этифоксина за сайты связывания агониста ГАМК [ 3 H] -мусцимола и модулятора BZD. [ 3 H] -флунитразепам на рецепторе GABA A .Эксперименты in vitro на препаратах мембран головного мозга крыс 28 показали, что этифоксин не препятствует связыванию этих лигандов, что указывает на то, что его сайт связывания отличается от сайта связывания ГАМК и BZD. Вместо этого связывание этих двух радиоактивно меченых лигандов увеличивается в присутствии этифоксина, демонстрируя положительную аллостерическую модуляцию. Наблюдение in vivo о том, что анксиолитическое действие этифоксина не ингибируется флумазенилом, специфическим антагонистом сайта связывания BZD на рецепторе GABA A , 29 , также согласуется с представлением о том, что этифоксин и BZD связываются с разными сайтами.Это свойство может объяснить отсутствие пагубного воздействия этифоксина на седативный эффект и память по сравнению с BZD (рис. 1).
Рисунок 1 Сравнение механизма действия этифоксина и бензодиазепинов на рецептор GABA A . ( A ) Бензодиазепины связываются в основном между α и γ 2 субъединицами рецептора GABA A . Природа субъединицы α влияет на фармакологические свойства связывающихся с ней агентов (седативный эффект, миорелаксация, амнезия и т. Д.).Флумазенил специфически ингибирует связывание бензодиазепинов с рецептором GABA A . ( B ) Этифоксин действует на рецептор GABA A , как напрямую связываясь с субъединицами β 2 / β 3 , так и косвенно стимулируя выработку нейростероидов (аллопрегнанолон). Флумазенил не влияет на связывание этифоксина с рецептором GABA A . Воспроизведено с любезного разрешения Biocodex. Сокращение: TSPO, белок-транслокатор 18 кДа. |
Исследования рекомбинантных рецепторов ГАМК A показали, что этифоксин-стимулированная ГАМКергическая передача сохраняется в отсутствие α- или γ-субъединиц, что позволяет предположить, что именно β-субъединица рецептора GABA A имеет решающее значение для этифоксина. привязка. Различные субъединицы гетероолигомера рецептора GABA A отличаются друг от друга по составу ограниченного набора аминокислотных последовательностей, каждое семейство состоит из ограниченного числа вариантов.Несколько подтипов рецептора GABA A присутствуют в ЦНС, и эти подтипы демонстрируют специфические анатомические и субклеточные паттерны экспрессии, а также функционально разные свойства. Кажущееся сродство рецепторов GABA A к GABA и этифоксину зависит от состава субъединиц и, более конкретно, от димеров α-β субъединиц, образующих сайты связывания агонистов для GABA. В этом контексте этифоксин имеет более высокое сродство к рецепторам, содержащим субъединицы β 2 или β 3 , чем к рецепторам, содержащим субъединицы β 1 . 30 Таким образом, эффекты этифоксина в основном определяются наличием субъединиц β, что четко отличает этот анксиолитический препарат от других положительных аллостерических модуляторов рецептора GABA A , таких как BZD, активность которых зависит в первую очередь от природы α и субъединицы γ. 31 Связывание этифоксина с субъединицами β приводит к положительной аллостерической модуляции хлоридных токов в результате открытия рецепторов GABA A , что связано с увеличением продолжительности и амплитуды тока в случае ненасыщающих концентраций GABA .Также было показано, что этифоксин увеличивает частоту спонтанных миниатюрных ГАМКергических тормозных постсинаптических токов без изменения их амплитуды или кинетических характеристик. 3
Поведенческие последствия специфичности этой субъединицы были элегантно продемонстрированы Verleye et al. Две разные инбредные линии мышей (BALB / cByJ и C57BL / 6J) сравнивали по эмоциональному и тревожному поведению. Сверхэкспрессия субъединицы β 2 в ЦНС была обнаружена у мышей BALB / cByJ по сравнению с мышами C57BL / 6J, причем первые были более реактивны на стрессовые стимулы, чем вторые. 32 Не было обнаружено различий в субъединицах β 3 между двумя штаммами. Штамм BALB / cByJ также был более чувствителен к анксиолитическому и противоэпилептическому эффектам этифоксина, что указывает на положительную корреляцию между долей субъединиц рецептора ГАМК A , содержащей β A , и эффективностью этифоксина. 33
Непрямое действие этифоксина на рецептор GABA
AВ дополнение к своему прямому действию на рецептор GABA A посредством связывания с β-субъединицей, этифоксин может замещать [ 3 H] -PK11195, высокоспецифичный лиганд TSPO, в зависимости от концентрации. 16,34 Точная роль TSPO в синтезе нейростероидов в нейронах и глиальных клетках ЦНС, особенно индуцированного этифоксином, сегодня не так ясна, как раньше. 35 Первоначально считалось, что TSPO находится в зоне контакта между внешней и внутренней мембранами митохондрий и играет ключевую роль в организации транслокации митохондриального холестерина, играя роль лимитирующей стадии нейростероидогенеза. Однако недавний эксперимент, показывающий, что линия TSPO — / — мышей не модифицируется в стероидогенезе 36,37 и что PK11195 может стимулировать стероидогенез даже в отсутствие TSPO, указывает на существование другой целевой молекулы. 38 Исследование эксплантата гипоталамуса лягушки, опубликованное в том же году, показало, что этифоксин может действовать через механизм, не зависящий от TSPO, что приводит к усилению нейростероидогенеза. 16
Некоторые нейростероиды, продуцируемые в митохондриях, взаимодействуют с рецептором GABA A . Прегненолон, который синтезируется из холестерина в митохондриях, превращается в прогестерон с помощью 3α-гидроксистероиддегидрогеназы. В свою очередь, прогестерон превращается в цитоплазме в его 3α, 5α-производные (3α, 5α-тетрагидропрогестерон или аллопрегнанолон и аллотетрагидродезоксикортикостерон или алло-THDOC) за счет последовательного действия 5α-редуктазы и 3α-гидроксистероид дегидрогеназы.Интересно, что прогестерон, дезоксикортикостерон и метаболиты тестостерона, особенно аллопрегнанолон, являются наиболее мощными из известных положительных аллостерических модуляторов рецепторов ГАМК А . 39 Они увеличивают длительность всплеска открытия рецепторного канала GABA A , а также среднее время открытия. 21
Предполагается, что увеличение уровней аллопрегнанолона в головном мозге после введения этифоксина, наблюдаемое на животных моделях, оказывает синергетический и облегчающий эффект на ГАМКергическую нейротрансмиссию, 27 , дополняя прямое действие этифоксина на β-субъединицу рецептора ГАМК A .Таким образом, молекулярный механизм действия этифоксина (рис. 2) приписывается как его прямому действию на рецептор GABA A , так и косвенному влиянию на рецептор через усиленный синтез определенных нейростероидов в результате связывания и активации TSPO. 40,41
Рисунок 2 Механизм действия этифоксина. Этифоксин стимулирует ГАМКергическую передачу посредством двух взаимодополняющих механизмов. Во-первых, этифоксин связывается непосредственно с субъединицами β 2 / β 3 рецептора GABA A .Во-вторых, этифоксин усиливает ГАМКергическую передачу через — косвенный механизм, связываясь с рецептором TSPO на митохондриях, тем самым облегчая синтез нейростероидов, которые являются мощными положительными аллостерическими модуляторами рецептора GABA A . Воспроизведено с любезного разрешения Biocodex. |
Этот двойной механизм действия коррелировал с анксиолитическим эффектом этифоксина, наблюдаемым на животных моделях тревоги. 42,43 Например, этот эффект был подтвержден в исследовании тревожных мышей BALB / cByJ, подвергшихся острому иммобилизационному стрессу.Также оценивались эффекты различных веществ, блокирующих центральную ГАМКергическую функцию или синтез нейроактивных стероидов. 44 Авторы пришли к выводу, что, связываясь с разными сайтами узнавания на рецепторе GABA A , этифоксин и аллопрегнанолон проявляют аддитивные эффекты, усиливая ингибирующую ГАМКергическую передачу, что отражается в усилении противосудорожного эффекта. 45
Этифоксин и серотонинергическая система
Другие системы нейротрансмиттеров помимо ГАМКергической системы, такие как серотонинергическая система, также вовлечены в тревожное поведение.Учитывая многочисленные взаимодействия между этими двумя системами нейротрансмиссии, актуально изучить возможные взаимодействия между этифоксином и лигандами серотонинергических рецепторов. Bourin et al. Продемонстрировали на мышиной модели беспокойства, что анксиолитический эффект этифоксина модулируется совместным введением лигандов 5-HT 2A . 46 Таким образом, в анксиолитическом эффекте этифоксина участвует серотонинергический механизм. Поскольку этифоксин не имеет прямого взаимодействия с серотонинергической системой, эти результаты предполагают, что анксиолитическая активность этифоксина обусловлена взаимосвязью между серотонинергической и ГАМКергической системами.
Поведенческая фармакология этифоксина: проявления тревоги
В нескольких исследованиях оценивались прямые или косвенные ГАМКергические механизмы, посредством которых этифоксин регулирует вегетативные реакции, связанные с тревогой.
ЭффектЭтифоксина на вегетативные реакции на стресс был исследован на крысах, испытывающих беспокойство (гипертермия, вызванная стрессом, замораживание, вызванное условным страхом, и активация моторики толстой кишки). Обработка этифоксином ослабляла гипертермию, уменьшала замораживание и частоту сокращений слепой и толстой кишки у крыс, подвергшихся стрессовым событиям.Таким образом, анксиолитические эффекты этифоксина включают ослабление как поведенческих, так и вегетативных проявлений тревоги. 47
Другая модель на животных, в которой использовалась церебральная инъекция кортикотропин-рилизинг-фактора (CRF) для воспроизведения вегетативных и поведенческих реакций на стресс, показала, что анксиолитические свойства этифоксина связаны с его влиянием на ГАМКергическую нейротрансмиссию, а не с взаимодействием с CRF1. и рецепторы CRF2. 48
ГАМКергическое участие в анксиолитических и противосудорожных свойствах этифоксина также было выявлено на модели алкогольной абстиненции у мышей, в которой этифоксин снижал гипервозбудимость и тревожность у мышей с симптомами отмены алкоголя. 49
В модели тревожного теста с четырьмя пластинами было обнаружено, что анксиолитическая активность как этифоксина, так и габапентина сопоставима с таковой у BZD (диазепама) или серотонинергического агониста (DOI гидрохлорид). Анксиолитическая активность этифоксина и габапентина в этой модели, в отличие от диазепама, имела тенденцию сохраняться во время процедуры повторного тестирования, хотя и в меньшей степени, чем у гидрохлорида DOI. 50 Эти данные позволяют предположить, что этифоксин и габапентин могут быть более эффективными при лечении тревожных проявлений стресса и страха, чем БЖД.
Анксиолитическая активность этифоксина: клинические испытания и практика
Анксиолитическая активность этифоксина: исследования у пациентов
,00Клиническая фармакология
Были проведены исследования на здоровых добровольцах для характеристики фармакокинетического профиля этифоксина. После приема разовой дозы этифоксина (150 мг) молекула становится чрезвычайно биодоступной (примерно 90%) и не связывается с клетками крови. Однако он прочно связывается с белками плазмы (88–95%).После приема внутрь этифоксин быстро всасывается в желудочно-кишечном тракте. Время достижения максимальной концентрации в крови — 2–3 часа. Он быстро метаболизируется в печени с образованием нескольких метаболитов. Один из этих метаболитов, диэтилэтифоксин, является активным. Также он может проникать через плацентарный барьер. Период полувыведения этифоксина составляет около 6 часов, а его активного метаболита — почти 20 часов. Он в основном выводится с мочой в виде метаболитов, но также выводится с желчью. Небольшие количества выводятся в неизмененном виде. 51
Клиническая эффективность
Первые исследования этифоксина в программе клинических разработок с целью получения регистрационного удостоверения были проведены на пациентах с тревожными расстройствами и расстройствами настроения. По сравнению с сульпиридом и плацебо этифоксин продемонстрировал эффективность в уменьшении симптомов тревоги и сердечно-сосудистых признаков, таких как одышка и тахикардия.
Поскольку анксиолитический эффект этифоксина на животных моделях был наиболее убедительно продемонстрирован на стрессовых моделях, клинические разработки в последние годы были сосредоточены на пациентах с AD, в основном с ADWA, в соответствии с классификациями DSM-III и DSM-IV.При интерпретации исследований этифоксина, проведенных с использованием предыдущей классификации ADWA DSM, необходимо учитывать недавние изменения в классификации AD в системах DSM и ICD.
Клинические исследования у пациентов с ADWA
Первое многоцентровое рандомизированное контролируемое двойное слепое исследование по оценке эффективности этифоксина по сравнению с буспироном у 170 пациентов с первичным диагнозом ADWA было проведено во Франции в 1998 году (таблица 1). 52 Пациенты получали лечение этифоксином (150–200 мг / день; n = 83) или буспироном (15–20 мг / день; n = 87) в течение 4 недель.Все пациенты при включении имели клиническую тревогу согласно шкале оценки тревожности Гамильтона (HAM-A) (≥18). Первичной конечной точкой был показатель HAM-A через 4 недели, скорректированный до исходного значения. Вторичными конечными точками были шкала общего клинического впечатления (CGI) — общее улучшение и индекс эффективности CGI (взаимосвязь между анксиолитической эффективностью и нежелательными эффектами). 53
Таблица 1 Эффективность и переносимость этифоксина у пациентов |
Результаты показали превосходство этифоксина над буспироном по среднему баллу HAM-A через 4 недели ( p = 0.05). Более того, группа этифоксина имела значительно лучший показатель CGI-Global Improvement, чем группа буспирона, начиная с 7-го дня лечения ( p <0,001 на 7-й день и p = 0,02 на 14-й и 28-й дни). Наконец, индекс эффективности CGI на 14 и 28 дни также был лучше для этифоксина ( p = 0,01 и p = 0,05). Группы лечения не различались по количеству нежелательных явлений. 52 Нежелательные явления, связанные с ЦНС (сонливость, головокружение и головная боль), были зарегистрированы у 40 пациентов.7% пациентов, получавших этифоксин, и 58,6% пациентов в группе буспирона.
Во втором многоцентровом контролируемом рандомизированном двойном слепом исследовании этифоксин сравнивали с лоразепамом у амбулаторных пациентов с ADWA, за которыми следовали врачи общей практики (таблица 1). 54 Пациенты получали этифоксин (50 мг 3 раза в день; n = 93) или лоразепам (2 мг / день, разделенные на три приема: 0,5 мг утром и в полдень и 1,0 мг вечером; n = 96) в течение 28 лет. дней. Все пациенты при включении имели клиническую тревогу в соответствии с их оценкой HAM-A (≥20).Основным критерием оценки эффективности был показатель HAM-A на 28-й день, скорректированный до 0-го дня. Вторичные конечные точки включали CGI, шкалу инвалидности Шихана 56 и самоотчет по шкале социальной адаптации 57 баллов. Оба лечения были эффективны в снижении оценки HAM-A, начиная с 7-го дня. Анксиолитический эффект этифоксина не уступал таковому у лоразепама (критерий не меньшей эффективности Шюрмана: p = 0,0002 для оценки HAM-A на 28 день и p = 0,0001 на 7 день).Однако большее количество пациентов ответили на лечение, что выражается в общем снижении оценки HAM-A по сравнению с исходным уровнем до 28 дня на ≥50% в группе этифоксина (72% против 56%; p = 0,0288). . Показатель CGI улучшился в обеих группах лечения к 28 дню, но большее количество пациентов показало заметное улучшение (показатель CGI <3) в группе этифоксина, чем в группе лоразепама ( p = 0,022). Индекс эффективности CGI на 28 день был лучше для этифоксина ( p = 0,038). Агенты показали сопоставимую эффективность в снижении инвалидности и улучшении социальной адаптации.
Не было значительной разницы в количестве побочных эффектов между группами, получавшими этифоксин или лоразепам. 54 Сонливость наблюдалась у 10,7% пациентов, получавших этифоксин, и у 18,7% пациентов, получавших лоразепам. Результаты тестов немедленной и отсроченной свободной памяти через 28 дней были сопоставимы в обеих группах лечения. Симптомы отмены оценивались через 1 неделю после прекращения лечения. Число пациентов, которые испытали рикошетную тревогу после прекращения лечения, было значительно больше ( p = 0.034) в группе лоразепама (восемь пациентов), чем в группе этифоксина (один пациент). 54
В исследовании среди пациентов с ADWA, проведенном в России, 58 сравнивали эффективность этифоксина с феназепамом, анксиолитическим БЗД, широко используемым в России для лечения рекламы (таблица 1). В этом многоцентровом открытом рандомизированном исследовании приняли участие 90 пациентов, которые получали этифоксин (150 мг / день) или феназепам (1 мг / день) в течение 6 недель. Первичной конечной точкой был HAM-A на 42-й день, скорректированный до 0-го дня.Вторичными критериями оценки были CGI-Severity, CGI-Global Improvement и CGI-Efficacy Index. Оба лечения привели к эквивалентному снижению показателей тревожности согласно оценке неполноценности методом наименьших квадратов (95% этифоксин-феназепам: -3,2 [-5,3; -1,1]). Однако второй подход показал, что этифоксин превосходит феназепам ( p = 0,003 для оценки HAM-A на 42-й день). У большего количества реципиентов этифоксина, чем у реципиентов феназепама, наблюдалась тенденция к заметному улучшению (показатель CGI <3) на 42-й день. .Показатель CGI-Severity снизился в обеих группах со значительной разницей в пользу этифоксина на 42-й день ( p = 0,004). Индекс эффективности CGI на 42-й день также был лучше для этифоксина ( p = 0,004).
В этом исследовании 23 из 24 пациентов в группе феназепама сообщили о нежелательных явлениях. Наиболее частой из них была сонливость (наблюдалась у 32,6% реципиентов феназепама). Между двумя группами лечения наблюдалась значительная разница в отношении количества побочных эффектов, приведших к прекращению лечения (8 в группе феназепама против 0 в группе этифоксина; p = 0.002). 58 Что касается абстинентного синдрома после прекращения лечения, три пациента в группе этифоксина по сравнению с 26 пациентами в группе феназепама испытали возвратную тревогу между 42 и 49 днями, согласно шкале irHAM-A ( p <0,001). 59
Многоцентровое двойное слепое рандомизированное клиническое исследование по оценке эффективности этифоксина по сравнению с алпразоламом у 201 амбулаторного пациента с ADWA было недавно проведено в Южной Африке (таблица 1). 55 Пациенты получали этифоксин (150 мг / день; n = 100) или алпразолам (1.5 мг / сут; n = 101) в течение 4 недель. Все пациенты при включении имели клиническую тревогу в соответствии с их оценками по шкале HAM-A (≥20). Первичной конечной точкой был общий балл по шкале HAM-A на 28 день, скорректированный с учетом его значения на день 1. Вторичные конечные точки включали CGI-Global Improvement и процент респондеров (определяемый снижением на ≥50% балла HAM-A между 1 и 1 днями). 28). Симптомы тревоги начали улучшаться с первой недели в обеих группах. К 28 дню средний общий балл по шкале HAM-A снизился на 72,5% в группе этифоксина и на 79.7% в группе алпразолама, тогда как скорректированная средняя разница в баллах HAM-A составила 1,78 (90% ДИ [0,23; 3,33]) в пользу алпразолама. Поскольку верхний предел 90% ДИ был больше контрольного значения 2,5, не было продемонстрировано превосходство этифоксина перед алпразоламом. Через неделю после прекращения лечения (день 35) показатель HAM-A в группе этифоксина все еще снижался, тогда как в группе алпразолама он начал расти, а разница между группами по среднему изменению между 28 и 35 днями составила значительный ( p = 0.019). Аналогичным образом, показатель CGI-Severity снизился между 28 и 35 днями в группе этифоксина, тогда как он увеличился в группе алпразолама ( p = 0,004). Что касается вторичных критериев оценки, не было значительных различий между двумя группами, ни по шкале CGI, ни по статусу респондента на 28 день.
В ходе этого исследования 35 пациентов (35%) в группе этифоксина испытали по крайней мере одно нежелательное явление по сравнению с 48 (47,5%) в группе алпразолама. Нежелательные явления гораздо чаще оценивались исследователями как связанные с лечением в группе алпразолама (62.3%; 13, возможно, и 25, вероятно, родственные), чем в группе этифоксина (34,3%; 13, возможно, и 11, вероятно, родственные). Побочные эффекты привели к исключению семи пациентов из группы этифоксина и шести пациентов из группы алпразолама, в основном из-за симптомов со стороны ЦНС или желудочно-кишечного тракта. Симптомы со стороны ЦНС (в основном сонливость, седативный эффект или утомляемость) отмечались у 16% реципиентов этифоксина и 24,8% реципиентов алпразолама. О желудочно-кишечных симптомах сообщили 12 пациентов в группе этифоксина и восемь пациентов в группе алпразолама.После прекращения лечения больше пациентов (11%) испытали побочные эффекты в группе алпразолама (16 событий), чем в группе этифоксина (4% пациентов и 4 события) ( p = 0,063). В группе алпразолама 50% этих нежелательных явлений были связаны с лечением (пять возможных и три вероятных), по сравнению с отсутствием в группе этифоксина.
Эти клинические исследования ясно демонстрируют эффективность этифоксина как анксиолитика у пациентов с ADWA. Они также подчеркивают хороший профиль переносимости этифоксина, особенно его сохранение когнитивной функции и бдительности.Более того, этифоксин не связан ни с рикошетной тревогой, ни с симптомами отмены после прекращения лечения. 60
Фармаконадзор
За 30 лет, прошедших с момента получения лицензии на этифоксин, мониторинг безопасности лекарств подтвердил низкий риск лекарственной зависимости или симптомов отмены после прекращения лечения61. Немногочисленные нежелательные явления, о которых сообщалось, в основном касаются кожных и подкожных заболеваний (например, токсидермии), которые обычно проходят с прекращение лечения.Были описаны гепатобилиарные расстройства, такие как повышение уровня ферментов печени, но их частота неизвестна. Повышение уровня трансаминазы обычно обратимо после прекращения лечения. Как и в случае с любым психотропным препаратом, рекомендуется эпизодический мониторинг функции печени. Последние данные фармаконадзора приведены на https://www.has-sante.fr.
Когнитивные эффекты этифоксина у здоровых людей
Психомоторные эффекты и эффекты памяти пероральных доз этифоксина и лоразепама сравнивались у здоровых участников в рандомизированном двойном слепом плацебо-контролируемом исследовании с параллельными группами 62 (таблица 2).В общей сложности 48 здоровых участников были разделены на одну из четырех групп, которые получали либо разовую дозу этифоксина (50 мг или 100 мг), либо разовую дозу лоразепама (2 мг), либо плацебо. Нейропсихологическое тестирование оценивало психомоторные характеристики (время реакции выбора), внимание (тест заграждения) и память (диапазон цифр, немедленное и отсроченное свободное воспроизведение списка слов). Визуальная аналоговая шкала (ВАШ) использовалась для измерения седативного эффекта и настроения. Участники сообщили о семи побочных эффектах: пять в группе лоразепама (потливость, чувство интоксикации и три случая сонливости) и одно (сонливость) в группе этифоксина.Психомоторные характеристики через 2 часа различались между четырьмя группами. Время реакции в группе лоразепама было значительно больше, чем в трех других группах ( p <0,001). Кроме того, реципиенты лоразепама дали меньше правильных ответов в тесте Barrage, чем участники, получавшие 50 мг этифоксина или плацебо ( p <0,002). Прием лоразепама значительно ухудшил как немедленное, так и отсроченное свободное воспроизведение ( p <0,001). Результаты ВАШ показали, что через 2 и 4 часа участники, получавшие лоразепам, испытали значительно большую утомляемость, сонливость, сонливость и неуклюжесть и чувствовали себя менее энергичными, чем участники других групп.
Таблица 2 Переносимость этифоксина у здоровых добровольцев |
Это исследование не предоставило доказательств того, что однократные пероральные дозы этифоксина (50 и 100 мг) оказывали пагубное влияние на психомоторные характеристики, внимание или память по сравнению с 2 мг лоразепама, использованным в качестве положительного контроля.
В недавней публикации 63 30 здоровых добровольцев пожилого возраста (65-75 лет) были протестированы на бдительность и когнитивные функции в исследовании, сравнивающем этифоксин (2-50 мг), лоразепам (2-1 мг) и плацебо (таблица 2).Рандомизированный плацебо-контролируемый, двойной слепой, перекрестный дизайн включал три однодневных сеанса, разделенных периодом вымывания 14–30 дней. Тестирование проводилось через 2 часа после введения препарата. Участники прошли когнитивные тесты, включающие автоматизированные батареи Кембриджского нейропсихологического теста и другие психологические тесты (Струп, Рей, тест на слуховое вербальное обучение, диапазон цифр). Время реакции было основным критерием эффективности. По сравнению с плацебо этифоксин не оказывает вредного воздействия на настороженность, тогда как, как и ожидалось, лоразепам значительно снижает ее.Кроме того, введение этифоксина не оказало вредного воздействия на внимание, быструю обработку зрительной информации, тест Струпа или показатели зрительно-пространственной, вербальной или рабочей памяти. Аналогичный процент побочных эффектов наблюдался при приеме этифоксина и плацебо. Большинство из них были обнаружены после приема лоразепама. Наиболее частым нежелательным явлением была сонливость. Только одно нежелательное явление было оценено как серьезное в группе этифоксина по сравнению с четырьмя в группе лоразепама.
Нейропротекторное действие этифоксина в центральной и периферической нервной системе
Также было обнаружено, что этифоксин оказывает защитное действие на животных моделях нейровоспаления, ноцицепции и нейродегенерации, что может частично объяснять его благотворное влияние при неврологических и психических расстройствах. 64,65 Особый интерес представляет его активность в повышении синтеза нейротрофических факторов, которые, как известно, участвуют в нейропластичности, которая возникает в ответ на развитие и хронизацию нервно-психических расстройств, особенно на синаптическом уровне. 66,67 Эти исследования также подтверждают благоприятный профиль переносимости этифоксина по сравнению с BZD. 68
Этифоксин усиливает синтез нейропротекторных факторов
Было разработано несколько экспериментальных процедур для изучения нейропротекторных и нейрорепаративных свойств этифоксина.На модели поражения периферических нервов у крыс (криоповреждение седалищного нерва) Girard и др. Продемонстрировали, что этифоксин способствует регенерации периферических нервов и росту аксонов, что приводит к ускоренному и улучшенному восстановлению локомоции, координации движений и сенсорных функций. 17 Активность этифоксина в отношении разрастания нейритов также была исследована. Zhou et al. Использовали четко определенную клеточную модель PC-12, в которой было обнаружено, что этифоксин способствует синтезу и высвобождению нейротрофического фактора, происходящего из глии. 69 Dai et al. Показали, что этифоксин увеличивает нейрональный рост в клетках PC-12 в зависимости от концентрации. Они также продемонстрировали, что этифоксин улучшает регенерацию седалищного нерва, модулирует иммунные ответы и повышает экспрессию нейротрофина. 70 В модели аллотрансплантата бесклеточного нерва крысы (для лечения повреждения периферического нерва) Zhou et al. Сообщили, что этифоксин увеличивал экспрессию нейрофиламентов в регенерированных аксонах, улучшая регенерацию седалищного нерва, увеличивая скорость проводимости нерва, улучшая ходьбу экспрессия нейротрофина. 69
Этифоксин обладает противовоспалительными и иммуномодулирующими свойствами
Несколько моделей повреждения головного мозга использовались для оценки противовоспалительного, иммуномодулирующего и нейрозащитного действия этифоксина. Потенциальный нейрозащитный эффект этифоксина был оценен Ли и др. На мышиной модели окклюзии средней мозговой артерии (MCAO) и реперфузии. В этой модели ишемия увеличивала рекрутирование определенных популяций микроглиальных клеток, таких как экспрессирующие (ионизированная кальций-связывающая адаптерная молекула 1 (Iba1 +) и CD11b + CD45int.В этих клетках активность TSPO увеличивалась после ишемии. В этой модели этифоксин значительно уменьшал неврологический дефицит и объем инфаркта после MCAO и реперфузии. Этифоксин снижает выработку провоспалительных цитокинов микроглией. В частности, у животных, получавших этифоксин, наблюдали снижение уровня интерлейкина-1β, интерлейкина-6, фактора некроза опухоли-α и индуцибельной синтазы оксида азота. 71 Совсем недавно на двух моделях внутримозгового кровоизлияния на мышах было показано, что этифоксин (50 мг / кг / день, внутрибрюшинный путь) значительно снижает неврологический дефицит и перигематомный отек головного мозга на срок до 3 дней после кровоизлияния.Этот защитный эффект этифоксина был связан с уменьшением инфильтрации лейкоцитов в мозг и увеличением продукции IL-6 и TNFα клетками микроглии. 72 Наконец, на модели черепно-мозговой травмы Саймон-О’Брайен и др. Продемонстрировали, что этифоксин (50 мг / кг / день / 7 дней, внутрибрюшинный путь) снижает продукцию провоспалительных цитокинов, инфильтрацию макрофагов, активация глии и дегенерация нейронов. 14
В модели боли у крыс с моноартритом 50 мг / кг этифоксина эффективно уменьшали симптомы нейропатической боли независимо от того, вводили ли этифоксин до или после индукции артрита.Было обнаружено, что этифоксин усиливает общее ингибирование в заднем роге спинного мозга, уменьшая некоторые воспалительные процессы в позвоночнике и защищая от глицинергического растормаживания, вызванного PGE2. 73 Используя экспериментальную модель рассеянного склероза (экспериментальный аутоиммунный энцефаломиелит; EAE), Догерти и др. Показали, что этифоксин может уменьшить тяжесть воспалительной демиелинизации и уменьшить инфильтрацию периферических иммунных клеток в спинной мозг. Опять же, этот противовоспалительный эффект можно было увидеть независимо от того, вводили ли этифоксин до или после индукции EAE.Выздоровление коррелировало с уменьшением воспалительной патологии в поясничном отделе спинного мозга и увеличением регенерации олигодендроглии. 74 Этот эффект этифоксина может быть опосредован модуляцией активности TSPO, при этом введение этифоксина связано с увеличением уровней мРНК 3α-гидроксистероиддегидрогеназы (ark1c14).
Защитные эффекты нейростероидогенеза, индуцированного этифоксином
Было обнаружено, что инъекции 50 мг / кг этифоксина взрослым самцам крыс увеличивают концентрацию прегненолона, прогестерона и его 5α- и 3α, 5α-восстановленных метаболитов в головном мозге и плазме через 30–60 минут после внутрибрюшинного введения.Эта реакция произошла в надпочечниках в течение нескольких часов. 75 Учитывая это нейростероидогенное свойство этифоксина, его потенциальный модулирующий эффект был исследован на крысиной модели нейропатической боли, вызванной противораковым агентом винкристином. Предварительное назначение этифоксина предотвращало сенсибилизацию боли винкристином и уменьшало установленную гипералгезию. Эндогенный синтез 3α, 5α-восстановленных нейростероидов, индуцированный связыванием этифоксина с TSPO, по-видимому, ответственен за наблюдаемые антигипералгезические эффекты. 76 На модели крыс с хроническим сужением седалищного нерва Aouad et al. Продемонстрировали, что этифоксин подавляет симптомы нейропатической боли. Этот эффект полностью опосредован 3α, 5α-восстановленными нейростероидами и, вероятно, также аллопрегнанолоном, который был обнаружен в высоких концентрациях в спинном мозге обработанного животного. 77
Заключение
Этифоксин является анксиолитическим препаратом, не относящимся к BZD, с селективностью в отношении β-субъединицы рецептора GABA A . Он обладает специфическими фармакологическими свойствами, включая прямое и косвенное (через синтез нейростероидов) облегчение ГАМКергической нейротрансмиссии, что приводит к потенциальной непрямой серотонинергической активности.Кроме того, этифоксин ослабляет воспаление ЦНС и всего тела, а также процессы иммунитета, которые, как известно, связаны с тревогой.
Клинические исследования продемонстрировали эффективность этифоксина в симптоматическом лечении тревоги, особенно у пациентов с ADWA, в суточных дозах 150–200 мг. Профиль переносимости этифоксина лучше, чем у BZD, в частности из-за отсутствия влияния на память и бдительность. Кроме того, прекращение лечения не вызывает лекарственной зависимости, синдрома отмены или возвратного беспокойства.До сих пор в исследованиях участвовали в основном женщины (2/3), что соответствует соотношению полов по тревожности и БА в общей популяции. Однако нельзя исключать гендерный эффект этифоксина.
Следует отметить, что резолюция Совета Европы 1990 г. подчеркнула опасность неправильного или чрезмерного назначения снотворных или анксиолитических BZD. 78 В этой резолюции рекомендовалось, чтобы лица, назначающие препараты, ограничили использование анксиолитических BZD случаями тяжелой или инвалидизирующей тревожности и ограничили продолжительность лечения.
Анксиолитическая эффективность этифоксина, его хорошая переносимость и отсутствие лекарственной зависимости — веские аргументы в пользу использования этифоксина при лечении ADWA.
Раскрытие
Доктор Нусс получил исследовательский грант и гонорары за консультационные услуги от Biocodex. Авторы не сообщают о других конфликтах интересов в этой работе.
Список литературы
1. Семаан В., Хергета Т., Блох Дж. И др. [Поперечное исследование распространенности расстройства адаптации с тревогой в общей практике]. Энцефала . 2001. 27 (3): 238–244.
2. Слуга Д., Пелиссоло А., Шаншарм Л., Ле Герн, Мэн, Буленжер, JP. [Расстройства адаптации с тревогой. Клинико-психометрическая характеристика пациентов, обращающихся к терапевту. Энцефала . 2013. 39 (5): 347–351. DOI: 10.1016 / j.encep.2012.10.004
3. Poisbeau P, Gazzo G, Calvel L. Анксиолитики, нацеленные на рецепторы GABAA: информация об этифоксине. World J Biol Psychiatry . 2018; 19 (sup1): S36 – S45.DOI: 10.1080 / 15622975.2018.1468030
4. Штамм JJ. Психобиология стресса, депрессии, нарушений адаптации и устойчивости. World J Biol Psychiatry . 2018; 19 (sup1): S14 – S20. DOI: 10.1080 / 15622975.2018.1459049
5. Нусс П. Тревожные расстройства и нейротрансмиссия ГАМК: нарушение модуляции. Нейропсихиатр Dis Treat . 2015; 11: 165–175. DOI: 10.2147 / NDT.S58841
6. Хаугер Р.Л., Рисбро В., Браунс О., Даутценберг FM. Передача сигналов рецептора рилизинг-фактора кортикотропина (CRF) в центральной нервной системе: новые молекулярные мишени. Наркотики ЦНС, поражающие нейрол, нацелены на . 2006. 5 (4): 453–479.
7. Бойер П. Имеют ли тревога и депрессия общий патофизиологический механизм? Acta Psychiatr Scand Suppl . 2000; (406): 24–29. DOI: 10.1111 / j.0065-1591.2000.acp29-04.x
8. Mehta AK, Ticku MK. Обновленная информация о рецепторах ГАМК. Brain Res Brain Res Ред. . 1999. 29 (2–3): 196–217.
9. Банделов Б., Болдуин Д., Абелли М. и др. Биологические маркеры тревожных расстройств, ОКР и посттравматического стрессового расстройства: согласованное заявление.Часть II: нейрохимия, нейрофизиология и нейропознание. World J Biol Psychiatry . 2017; 18 (3): 162–214. DOI: 10.1080 / 15622975.2016.11
10. Микопулос В., Пауэрс А., Гиллеспи К.Ф., Ресслер К.Дж., Йованович Т. Воспаление при расстройствах, основанных на страхе и тревоге: ПТСР, ГТР и другие. Нейропсихофармакология . 2017; 42 (1): 254–270. DOI: 10.1038 / npp.2016.146
11. Шарон Г., Сэмпсон Т.Р., Гешвинд Д.Х., Мазманян СК. Центральная нервная система и микробиом кишечника. Ячейка . 2016; 167 (4): 915–932. DOI: 10.1016 / j.cell.2016.10.027
12. Коэн С., Яницки-Девертс Д., Дойл В. Дж. И др. Хронический стресс, резистентность к рецепторам глюкокортикоидов, воспаление и риск заболеваний. Proc Natl Acad Sci U S A . 2012. 109 (16): 5995–5999. DOI: 10.1073 / pnas.1118355109
13. Ghareghani M, Zibara K, Sadeghi H, et al. Флувоксамин стимулирует олигодендрогенез культивируемых нервных стволовых клеток и ослабляет воспаление и демиелинизацию на животной модели рассеянного склероза. Научный сотрудник . 2017; 7 (1): 4923. DOI: 10.1038 / s41598-017-04968-z
14. Саймон-О’Брайен Э., Готье Д., Рибан В., Верлей М. Этифоксин улучшает сенсомоторный дефицит и снижает активацию глии, дегенерацию нейронов и нейровоспаление в модели черепно-мозговой травмы на крысах. Дж Нейровоспаление . 2016; 13 (1): 203. DOI: 10.1186 / s12974-016-0687-3
15. Juif PE, Melchior M, Poisbeau P. Характеристика быстрого ГАМКергического ингибирующего действия этифоксина во время ноцицептивной обработки спинного мозга у самцов крыс. Нейрофармакология . 2015; 91: 117–122. DOI: 10.1016 / j.neuropharm.2014.12.022
16. Do Rego JL, Vaudry D, Vaudry H. Небензодиазепиновый анксиолитический препарат этифоксин вызывает быструю, независимую от рецепторов стимуляцию биосинтеза нейростероидов. PLoS One . 2015; 10 (3): e0120473. DOI: 10.1371 / journal.pone.0120473
17. Жирар С., Лю С., Кадепонд Ф. и др. Этифоксин улучшает регенерацию периферических нервов и функциональное восстановление. Proc Natl Acad Sci U S A .2008. 105 (51): 20505–205 10. DOI: 10.1073 / pnas.0811201106
18. Бенхам Р.С., Энгин Э., Рудольф У. Разнообразие нейронального ингибирования: путь к новым методам лечения нервно-психических расстройств. JAMA Psychiatry . 2014; 71 (1): 91–93. DOI: 10.1001 / jamapsychiatry.2013.3059
19. Рудольф У., Крестани Ф., Молер Х. Подтипы рецепторов ГАМК (А): анализ их фармакологических функций. Trends Pharmacol Sci . 2001. 22 (4): 188–194.
20. Сигель Э., Люшер Б.П. Более пристальный взгляд на высокоаффинный сайт связывания бензодиазепина на рецепторах ГАМК. Curr Top Med Chem . 2011; 11 (2): 241–246.
21. Olsen RW. Рецептор ГАМК: положительные и отрицательные аллостерические модуляторы. Нейрофармакология . 2018; 136 (Pt A): 10–22. DOI: 10.1016 / j.neuropharm.2018.01.036
22. Kruse HJ, Kuch H. Этифоксин: оценка его противосудорожного профиля у мышей по сравнению с вальпроатом натрия, фенитоином и клобазамом. Arzneimittelforschung . 1985. 35 (1): 133–135.
23. Hamon A. Etifoxine et récepteurs GABAA. Энцефала . 2008; (Дополнение 1): S29–34. DOI: 10.1016 / S0013-7006 (08) 71389-7
24. Буасье Дж. Р., Саймон П., Зачинска М., Фишель Дж. [Экспериментальное психофармакологическое исследование нового психотропного препарата, 2-этиламино-6-хлор-4-метил-4-фенил-4H-3,1-бензоксазина]. Терапия . 1972. № 27 (2): 325–338.
25. Verleye M, Schlichter R, Gillardin JM. Взаимодействие этифоксина с хлоридным каналом, связанным с рецепторным комплексом ГАМК (А). Нейроотчет .1999. 10 (15): 3207–3210.
26. Rupprecht R, Holsboer F. Нейроактивные стероиды: механизмы действия и нейропсихофармакологические перспективы. Trends Neurosci . 1999. 22 (9): 410–416.
27. Белелли Д., Ламберт Дж. Дж. Нейростероиды: эндогенные регуляторы рецептора ГАМК (А). Nat Rev Neurosci . 2005. 6 (7): 565–575. DOI: 10.1038 / nrn1703
28. Verleye M, Pansart Y, Gillardin J. Влияние этифоксина на связывание лиганда с рецепторами GABA (A) у грызунов. Neurosci Res . 2002. 44 (2): 167–172.
29. Squires RF, Casida JE, Richardson M, Saederup E. [35S] трет-бутилбициклофосфоротионат связывается с высоким сродством со специфическими для мозга сайтами, связанными с гамма-аминомасляной кислотой-A и сайтами распознавания ионов. Мол Фармакол . 1983; 23 (2): 326–336.
30. Хамон А, Морель А, Хюэ Б, Верлей М., Гиллардин Дж. Модулирующие эффекты анксиолитического этифоксина на рецепторы ГАМК (А) опосредуются бета-субъединицей. Нейрофармакология .2003. 45 (3): 293–303.
31. Корпи ER, Sinkkonen ST. Подтипы рецепторов ГАМК (А) как мишени для разработки психоневрологических препаратов. Pharmacol Ther . 2006. 109 (1–2): 12–32. DOI: 10.1016 / j.pharmthera.2005.05.009
32. Verleye M, Dumas S, Heulard I, Krafft N, Gillardin JM. Дифференциальные эффекты этифоксина на тревожное поведение и судороги у мышей BALB / cByJ и C57BL / 6J: есть ли связь со сверхэкспрессией субъединиц бета2 центрального рецептора ГАМКА? Eur Neuropsychopharmacol .2011. 21 (6): 457–470. DOI: 10.1016 / j.euroneuro.2010.09.008
33. Verleye M, Heulard I, Nuss P, Gillardin JM. Влияние стресса и этифоксина на вызванную пентобарбиталом потерю рефлекса выпрямления у мышей Balb / cByJ и C57BL / 6J. Neurosci Lett . 2003. 353 (2): 127–130.
34. Шлихтер Р., Рыбальченко В., Пуазбо П., Верлей М., Гиллардин Дж. Модуляция ГАМКергической синаптической передачи небензодиазепиновым анксиолитическим этифоксином. Нейрофармакология . 2000. 39 (9): 1523–1535.
35. Selvaraj V, Tu LN. Текущее состояние и перспективы на будущее: TSPO в стероидной нейроэндокринологии. Дж Эндокринол . 2016; 231 (1): R1 – R30. DOI: 10.1530 / JOE-16-0241
36. Morohaku K, Pelton SH, Daugherty DJ, Butler WR, Deng W., Selvaraj V. Транслокаторный белок / периферический бензодиазепиновый рецептор не требуется для биосинтеза стероидных гормонов. Эндокринология . 2014; 155 (1): 89–97. DOI: 10.1210 / en.2013-1556
37. Ту Л.Н., Морохаку К., Манна П.Р. и др.Мыши с глобальным нокаутом периферического бензодиазепинового рецептора / белка-транслокатора жизнеспособны, не влияя на биосинтез стероидных гормонов. Дж. Биол. Хим. . 2014. 289 (40): 27444–27454. DOI: 10.1074 / jbc.M114.578286
38. Tu LN, Zhao AH, Stocco DM, Selvaraj V. Влияние PK11195 на стероидогенез не опосредуется через белок-транслокатор (TSPO). Эндокринология . 2015; 156 (3): 1033–1039. DOI: 10.1210 / en.2014-1707
39. Majewska MD. Нейростероиды: эндогенные бимодальные модуляторы рецептора ГАМКА.Механизм действия и физиологическое значение. Прог Нейробиол . 1992. 38 (4): 379–395.
40. Вольф Л., Бауэр А., Мельхнер Д. и др. Повышение синтеза нейростероидов — взаимосвязь с фармакологией лигандов транслокаторного белка (18 кДа) (TSPO) и бензодиазепинов. Фармакопсихиатрия . 2015; 48 (2): 72–77. DOI: 10.1055 / с-0034-1398507
41. Коста Б., Каваллини С., Да Поццо Е., Талиани С., Да Сеттимо Ф, Мартини С. Анксиолитический этифоксин связывается с сайтом связывания TSPO Ro5-4864 с длительным временем пребывания, демонстрируя высокую нейростероидогенную активность. ACS Chem Neurosci . 2017; 8 (7): 1448–1454. DOI: 10.1021 / acschemneuro.7b00027
42. Verleye M, Akwa Y, Liere P, et al. Анксиолитический этифоксин активирует периферический бензодиазепиновый рецептор и увеличивает уровни нейростероидов в головном мозге крысы. Pharmacol Biochem Behav . 2005. 82 (4): 712–720. DOI: 10.1016 / j.pbb.2005.11.013
43. Угале Р.Р., Шарма А.Н., Кокаре Д.М., Хирани К., Субхедар Н.К., Чопде СТ. Нейростероид аллопрегнанолон опосредует анксиолитический эффект этифоксина у крыс. Мозг Res . 2007; 1184: 193–201. DOI: 10.1016 / j.brainres.2007.09.041
44. Verleye M, Heulard I, Gillardin JM. Исследование противосудорожного эффекта острого иммобилизационного стресса у тревожных мышей Balb / cByJ с использованием механических зондов, связанных с ГАМК А. Психофармакология (Берл) . 2008. 197 (4): 523–534. DOI: 10.1007 / s00213-007-1066-7
45. Verleye M, Schlichter R, Neliat G, Pansart Y, Gillardin JM. Функциональная модуляция рецепторов гамма-аминомасляной кислоты (A) этифоксином и аллопрегнанолоном у грызунов. Neurosci Lett . 2001. 301 (3): 191–194.
46. Бурин М., Хаскоет М. Влияние подтипов рецепторов 5-HT2 в механизме действия этифоксина ГАМКергического соединения в тесте с четырьмя пластинами на швейцарских мышах. Behav Brain Res . 2010. 208 (2): 352–358. DOI: 10.1016 / j.bbr.2009.11.046
47. Verleye M, Gillardin JM. Влияние этифоксина на вызванную стрессом гипертермию, замораживание и активацию моторики толстой кишки у крыс. Physiol Behav . 2004. 82 (5): 891–897.DOI: 10.1016 / j.physbeh.2004.07.010
48. Verleye M, Andre N, Gillardin JM. Отсутствие взаимодействия этифоксина с рецепторами CRF1 и CRF2 у грызунов. Neurosci Res . 2006. 56 (1): 53–60. DOI: 10.1016 / j.neures.2006.05.005
49. Verleye M, Heulard I, Gillardin JM. Анксиолитический этифоксин защищает от судорожных и анксиогенных аспектов синдрома отмены алкоголя у мышей. Спирт . 2009. 43 (3): 197–206. DOI: 10.1016 / j.alcohol.2009.02.003
50.Bourin M, Hascoet M. Понимание механизма процедуры повторного тестирования с четырьмя пластинами с использованием этифоксина по сравнению с габапентином. Текущая психофармакология . 2012; 1 (1): 2-8. DOI: 10.2174 / 2211556011201010002
51. Чой Ю.М., Ким К.Х. Этифоксин при болях у пациентов с тревогой. Корейский J Pain . 2015; 28 (1): 4–10. DOI: 10.3344 / kjp.2015.28.1.4
52. Слуга D, Graziani PL, Moyse D, Parquet PJ. [Лечение расстройства адаптации с тревогой: эффективность и переносимость этифоксина в двойном слепом контролируемом исследовании]. Энцефала . 1998. 24 (6): 569–574.
53. Рикелс К., Ховард К., Гай В. Clinical Global Impressions. В: Руководство ECDEU по оценке психофармакологии . Вашингтон (округ Колумбия): Типография правительства США; Публикация DHEW; 1976: 218–222.
54. Nguyen N, Fakra E, Pradel V, et al. Эффективность этифоксина по сравнению с монотерапией лоразепамом при лечении пациентов с расстройствами адаптации с тревогой: двойное слепое контролируемое исследование в общей практике. Человек Психофармакол .2006. 21 (3): 139–149. DOI: 10.1002 / hup.757
55. Stein DJ. Этифоксин в сравнении с алпразоламом для лечения расстройства адаптации с тревогой: рандомизированное контролируемое исследование. Adv Ther . 2015; 32 (1): 57–68. DOI: 10.1007 / s12325-015-0176-6
56. Леон А.С., Олфсон М., Портера Л., Фарбер Л., Шихан Д.В. Оценка психических нарушений в первичной медико-санитарной помощи с помощью шкалы инвалидности Шихана. Int J Psychiatry Med . 1997. 27 (2): 93–105. DOI: 10.2190 / T8EM-C8YH-373N-1UWD
57.Вайсман М.М., Ботвелл С. Оценка социальной адаптации по самоотчету пациента. Arch Gen Psychiatry . 1976; 33 (9): 1111–1115.
58. Александровский Ю.А., Краснов В.Н., Незнанов Н.Г., Ромасенко Л.В. Эффективность этифоксина по сравнению с феназепамом при лечении пациентов с нарушениями адаптации (открытое рандомизированное контролируемое исследование). Российский журнал психиатрии . 2010; 1: 74–78. Русский.
59. Гамильтон М. Оценка тревожных состояний по рейтингу. Br J Med Psychol .1959; 32 (1): 50–55.
60. Stein DJ. Фармакотерапия расстройства адаптации: обзор. The World Journal of Biological Psychiatr y . 2018; 19 (sup1): S46-S52. DOI: 10.1080 / 15622975.2018.1492736
61. Коттин Дж., Гуро А., Жан-Пастор М. Дж. И др. Профиль безопасности этифоксина: французское исследование по фармаконадзору. Fundam Clin Pharmacol . 2016; 30 (2): 147–152. DOI: 10.1111 / fcp.12169
62. Micallef J, Soubrouillard C., Guet F, et al. Двойное слепое параллельное плацебо-контролируемое сравнение седативных и мнестических эффектов этифоксина и лоразепама у здоровых субъектов [исправлено]. Fundam Clin Pharmacol . 2001. 15 (3): 209–216.
63. Депланк Д., Мачурон Ф., Вокье Н. и др. Этифоксин не ухудшает ни внимательность, ни когнитивные функции пожилых людей: рандомизированное двойное слепое плацебо-контролируемое перекрестное исследование. Eur Neuropsychopharmacol . 2018; 28 (8): 925–932. DOI: 10.1016 / j.euroneuro.2018.05.011
64. Рупрехт Р., Пападопулос В., Раммес Г. и др. Белок-транслокатор (18 кДа) (TSPO) как терапевтическая мишень при неврологических и психических расстройствах. Nat Rev Drug Discov . 2010. 9 (12): 971–988. DOI: 10.1038 / nrd3295
65. Gazzo G, Girard P, Kamoun N, Verleye M, Poisbeau P. Обезболивающие и противоотечные свойства этифоксина в моделях воспалительной сенсибилизации. Eur J Pharmacol . 2019; 843: 316–322. DOI: 10.1016 / j.ejphar.2018.12.018
66. Autry AE, Monteggia LM. Нейротрофический фактор головного мозга и нервно-психические расстройства. Pharmacol Rev . 2012. 64 (2): 238–258. DOI: 10.1124 / pr.111.005108
67.Марига А, Митра М, Чао М.В. Последствия отмены нейротрофического фактора головного мозга в нейронах ЦНС и последствия для заболевания. Нейробиол Дис . 2017; 97 (Pt B): 73–79. DOI: 10.1016 / j.nbd.2016.03.009
68. Nothdurfter C, Rammes G, Baghai TC, et al. TSPO (18 кДа) в качестве мишени для новых анксиолитиков с благоприятным профилем побочных эффектов. Дж Нейроэндокринол . 2011: 24 (1): 82–92
69. Чжоу X, He X, He B и др. Этифоксин способствует индуцированному глиальным нейротрофическим фактору разрастанию нейритов в клетках PC12. Мол Мед Реп . 2013. 8 (1): 75–80. DOI: 10.3892 / mmr.2013.1474
70. Дай Т., Чжоу Х, Ли И и др. Этифоксин способствует разрастанию нейритов из глии in vitro и in vivo. J Reconstr Microsurg . 2014. 30 (6): 381–388. DOI: 10.1055 / с-0034-1381751
71. Li HD, Li M, Shi E, et al. Агонист белка-транслокатора 18 кДа защищает от церебральной ишемии / реперфузионного повреждения. Дж Нейровоспаление . 2017; 14 (1): 151. DOI: 10.1186 / s12974-017-0921-7
72.Ли М., Рен Х., Шет К.Н., Ши Ф.Д., Лю К. Лиганд TSPO ослабляет повреждение головного мозга после внутримозгового кровоизлияния. Фасеб Дж. . 2017; 31 (8): 3278–3287. DOI: 10.1096 / fj.201601377RR
73. Aouad M, Zell V, Juif PE, et al. Этифоксиновая анальгезия при экспериментальном моноартрите: комбинированное действие, которое защищает спинальное торможение и ограничивает центральные воспалительные процессы. Боль . 2014; 155 (2): 403–412. DOI: 10.1016 / j.pain.2013.11.003
74. Догерти DJ, Селварадж В., Чечнева О.В., Лю XB, Pleasure DE, Deng W.Лиганд TSPO является защитным в мышиной модели рассеянного склероза. EMBO Mol Med . 2013. 5 (6): 891–903. DOI: 10.1002 / emmm.201202124
75. Liere P, Pianos A, Oudinet JP, Schumacher M, Akwa Y. Дифференциальные эффекты лиганда этифоксина 18-кДа транслокаторного белка (TSPO) на стероидогенез в мозге крыс, плазме и стероидогенных железах: фармакодинамические исследования. Психонейроэндокринология . 2017; 83: 122–134. DOI: 10.1016 / j.psyneuen.2017.05.022
76. Aouad M, Charlet A, Rodeau JL, Poisbeau P.Уменьшение и предотвращение симптомов нейропатической боли, вызванных винкристином, небензодиазепиновым анксиолитическим этифоксином опосредовано 3-альфа-восстановленными нейростероидами. Боль . 2009. 147 (1–3): 54–59. DOI: 10.1016 / j.pain.2009.08.001
77. Aouad M, Petit-Demouliere N, Goumon Y, Poisbeau P. Этифоксин стимулирует синтез аллопрегнанолона в спинном мозге для обезболивания при экспериментальной мононевропатии. евро J Pain . 2014. 18 (2): 258–268. DOI: 10.1002 / j.1532-2149.2013.00367.x
78. Совет Европы. Комитет министров. Постановление AP (90) 3 о назначении бензодиазепинов. J Gen Microbiol . 1990; 136: 327–330. DOI: 10.1099 / 00221287-136-2-327
.
 1 мг: 50 шт.
1 мг: 50 шт.

 0.5 мг: 10, 20, 30, 40 или 50 шт.
0.5 мг: 10, 20, 30, 40 или 50 шт. 50 мг: 30 шт.
50 мг: 30 шт. 250 мкг: 30 шт.
250 мкг: 30 шт.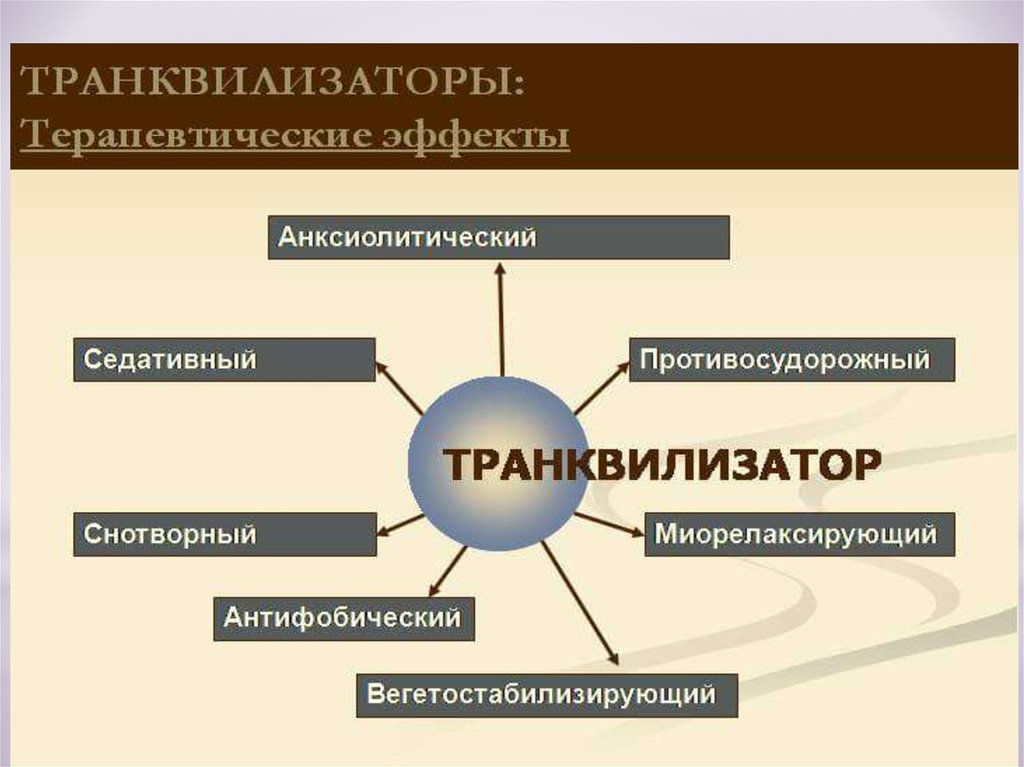 , покрытые пленочной оболочкой, 2.5 мг: 30 шт.
, покрытые пленочной оболочкой, 2.5 мг: 30 шт. , покрытые оболочкой, 2.5 мг: 25 шт.
, покрытые оболочкой, 2.5 мг: 25 шт. , покр. оболочкой, 5 мг: 20, 6000, 12000 или 17000 шт.
, покр. оболочкой, 5 мг: 20, 6000, 12000 или 17000 шт. 5% (10 мг/2 мл): амп. 5, 10 или 500 шт.
5% (10 мг/2 мл): амп. 5, 10 или 500 шт. 2 мл 5 или 10 шт.
2 мл 5 или 10 шт. 5 мг: 20, 50, 1000, 2000 или 4000 шт.
5 мг: 20, 50, 1000, 2000 или 4000 шт. 5 мг: 60 шт.
5 мг: 60 шт. с пролонг. высвобождением, покр. пленочной оболочкой, 20 мг: 30 шт.
с пролонг. высвобождением, покр. пленочной оболочкой, 20 мг: 30 шт. 50 мг: 20 или 60 шт.
50 мг: 20 или 60 шт. 10 шт.
10 шт. 500 мкг: 50 шт.
500 мкг: 50 шт. 5, 10, 20, 50 или 100 шт.
5, 10, 20, 50 или 100 шт. 1 мг: 50 шт.
1 мг: 50 шт. , диспергируемые в полости рта, 0.25 мг: 7, 10, 14, 20, 21, 28, 30, 35, 42, 50 или 70 шт.
, диспергируемые в полости рта, 0.25 мг: 7, 10, 14, 20, 21, 28, 30, 35, 42, 50 или 70 шт. 1 мг: 20, 25, 50 или 100 шт.
1 мг: 20, 25, 50 или 100 шт. 1 мг: 50 шт.
1 мг: 50 шт.